猪繁殖与呼吸综合征的研究进展
史静,王许刚,卢佳慧,李龙飞,张瑞华,徐彤★
(1.河北北方学院动物科技学院,河北张家口 075000;2.兆丰华生物科技(南京)有限公司,江苏南京 211100)
猪繁殖与呼吸综合征,俗称“蓝耳病”,是由繁殖呼吸综合征病毒 (porcine reproductive and respiratory syndrome virus,PPRSV)引起猪的一种具有高度接触性和高死亡率的传染性疾病。 典型的临床症状为断奶前后的仔猪会出现呼吸系统疾病以及妊娠后期母猪繁殖障碍, 该病自1987 年首次报道以来,尤其是2006 年变异性高致病性PPRSV 的出现,给我国生猪养殖行业带来了巨大的经济损失。 尽管非洲猪瘟在我国的发生对生猪养殖业导致严重经济损失, 但是在常态化非洲猪瘟防控下如何做好以繁殖呼吸综合征等重要疾病对于提高生猪养殖业提质增效仍具有重要意义。现将PPRS 的现状以及防控措施综述如下。
1 PRRSV 的历史
1987 年美国首次报道了PRRS 的存在,随后在欧洲和亚洲分别报道该病的存在(1990-1992)。 科学家Vensvoort 和Collins 分别于1991年和1992 年在荷兰和美国分离出猪繁殖与呼吸综合征病毒(PRRSV)。 最初分离的毒株分别为命名为Lelystad 病毒(欧洲毒株)和猪不育和呼吸综合征(SIRS) 病毒(也称为ATCC VR-2332,北美毒株)。1992 年正式命名为猪繁殖呼吸综合征病毒。 我国于1996 年分离出PRRSV 两种不同毒株分别为CH-1a 和BJ-4。 同年,从加拿大进口种猪中成功分离出PRRSV 毒株, 与BJ-4的基因组同源性约为99.6%,CH-1a 与JA142的基因组同源性约为94.5%。 两者(尤其是BJ-4)与北美分离株密切相关,说明PRRSV 的传播很大可能由进口种猪传入我国。另外,PRRSV 在1995~2005 年间主要呈地方性流行。 2006 年,在中国出现的HP-PRRSV 变种导致PRRS 大流行和20%的猪死亡率。自2013 年以来,PRRS 再次在中国流行, 这是由新的PRRSV 变种NADC30样毒株引起, 是从北美进口并在中国发生了毒株变异。 此后,PRRSV 迅速蔓延到中国其他地区,对中国养猪生产造成了很大的影响。
PRRSV 属于多尼病毒目、动脉炎病毒科、动脉炎病毒属。 PRRSV 分为欧洲型(PRRSV-1)和北美型(PRRSV-2)两个基因型,共有核苷酸序列只有55%~70%。最近国际病毒委员会(ICVA)新分类为猪乙型动脉炎病毒1 型(Betaarterivirus suid1) 和猪乙型动脉炎毒2 型(Betaarterivirus suid2)即种1 和种2。 我国的流行毒株主要以2型PRRSV 为主。 PRRSV 为球状颗粒,直径不超过100 纳米,有囊膜,表面有刺突,磷脂双分子层构成病毒外壳。 内部是由核衣壳蛋白包裹着病毒单股正链RNA 组成, 基因组全长约为15kb。 病毒模型见下图。 PRRSV 易受光照、温度和pH 的影响,耐低温不耐高温,可在-70℃和-20℃下存活数年及数月。在4℃存活1 个月;20℃~21℃下可存活1~6 天;在37℃下只可存活数小时;56℃时20 分钟就会将其灭活。 PRRSV 对酸碱易感,在pH6.5~7.5 稳定,但当pH 高于7.5 或低于6.5 时, 感染力迅速丧失。 从宿主分离的PRRSV 是没有血凝活性, 但经非离子去污剂及脂质溶剂处理后, 可使小鼠红细胞发生凝集现象。 此外,经Tween-80 或乙醚处理后也可出现血凝现象,但凝集特性可以被PRRSV 特异性抗血清所抑制。
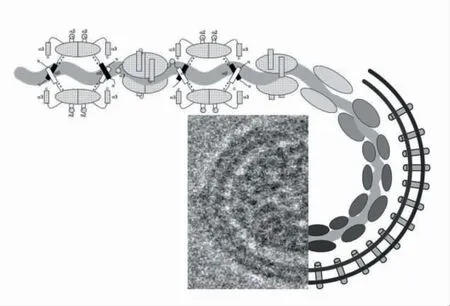
图 病毒模型图
2 PRRSV 的基因组及蛋白结构
PRRSV 基因组长约为15.4kb,由11 个已知的开放阅读框(ORFs)互相重叠构成。 其中位于5′-近端的ORF1a 和1b 长度占整个基因组的80%左右,其翻译产物均为多聚蛋白,编码病毒RNA 聚合酶以及复制酶。ORF1a 和ORF1b 区域编码两个复制酶-多聚蛋白前体pp1a (polyprotein 1a)、pplab。pp1a 和pplab 被病毒自身的蛋白酶Nsp1,Nsp2 及Nsp4 分解成16 个不同的非结构蛋白,包括Nsp1α/β、Nsp2-6、Nsp7α/β、Nsp8-12、Nsp2TF 和Nsp2N。它们携带具有酶活性如病毒RNA 聚合酶、解旋酶、核酸内切酶等。 这些蛋白在病毒的基因组转录、复制、翻译和蛋白组装过程中可以激活蛋白酶、 复制酶和剪切酶的活性。 ORF2a、ORF2b、ORF3-ORF7 和ORF5a 编码八种结构蛋白:GP2、包膜蛋白(E)、GP3-5、膜蛋白(M)、核衣壳蛋白(N)和ORF5a 蛋白。
Nsp4 是主要的蛋白酶, 可介导大多数Nsp加工。 Nsp1α、Nsp1β 和Nsp2 为三种辅助半胱氨酸蛋白酶,其作用是单个切割位点自催化加工。Nsp2 包含几个免疫显性B 细胞表位, 虽然对于病毒复制是可有可无的, 但是可以以某种方式调节宿主免疫反应。 ORF1b 编码的Nsp9-11,包含病毒RNA 依赖性RNA 聚合酶(RdRp)、解旋酶的假定结构域和尿苷酸特异性内切核糖核酸酶 (NendoU)。 在 不 同 程 度 上,Nsp1α、Nsp1β、Nsp2 和Nsp4 、Nsp11 通过抑制干扰素β (IFNβ)启动子的激活来减弱I 型IFN 反应,破坏宿主先天免疫。
ORF2a 与ORF3-5 编码四种膜相关N-糖基 化 蛋 白, 分 别 为GP2a、GP3、GP4 和GP5,ORF2b 与ORF6 编码E 和M 两种非糖基化膜蛋白。 ORF7 编码包裹病毒RNA 基因组的核衣壳蛋白N。GP2a、GP3 和GP4 形成异源三聚体复合物, 是组装感染性PRRSV 病毒粒子所必需的,还可与GP5 的相互作用, 但只有GP2a 和GP4被发现与PCD163 PRRSV 受体相互作用。
N 蛋白是ORF7 病毒基因所编码,为病毒衣壳的唯一组成部分, 可通过共价和非共价相互作用与自身相互作用。N 蛋白基本作用是病毒生命周期的细胞外阶段为病毒基因组提供保护性外壳。鉴于N 蛋白是PRRSV 衣壳的唯一组成部分,具有高度免疫原性的蛋白,因而成为检测病毒特异性抗体和诊断疾病的合适候选蛋白。PRRSV N 蛋白在病毒感染过程中起双重作用,细胞核/核仁中的病毒粒子结构蛋白功能和非结构蛋白作用, 表明这些隔间中的N 蛋白定位可能在病毒发病机制中起基础作用, 例如细胞基因表达的调节等。
M 蛋白是一种18 至19KDa 的III 类膜蛋白,由ORF6 病毒基因编码。 该蛋白膜结构由三个连续跨膜结构域的核心组成, 其前为13-18AA 的外结构域, 后为81-87 AA 的C 端内结构域。 正如冠状病毒密切相关的M 蛋白实验所证明的那样,M 蛋白可能在病毒组装和出芽过程中发挥关键作用。 M蛋白是非糖基化的, 是动脉病毒和PRRSV 最保守的结构蛋白。
GP5–M 异二聚体对病毒感染性至关重要,是马动脉炎病毒(EAV)病毒粒子组装的关键步骤。 PRRSV GP5 和M蛋白之间的二硫键可能分别发生在位置50 和8(欧盟分离株)的半胱氨酸残基之间。这些残基中的任何一个突变都会导致粒子产生的完全阻断, 这表明GP5 和M 的共价结合对于病毒组装至关重要。
GP5 蛋白是最丰富的包膜糖蛋白, 含有主要的中和表位。 GP5 蛋白是一种重要的病毒结构蛋白,暴露于病毒粒子表面,并参与感染或免疫动物的细胞凋亡、识别与结合、免疫保护及抗体依赖性病毒中和等。 GP5 通过N-糖基化降低中和表位的免疫原性, 同时也是逃避中和抗体免疫反应的一种途径。 其他能够诱导中和抗体但程度明显低于GP5 的病毒表位似乎驻留在其他PRRSV 蛋白上,如M、GP2a、GP3 和GP4。GP5免疫动物可产生部分保护性免疫反应, 与单独使 用GP5 相 比,GP5 融 合 蛋 白 (如MGP5、GP3GP5、GP4GP5、或者GP3GP4GP5)可增强接种动物的保护性免疫反应。 因此, 在疫苗开发中,GP5 应该通过与其他病毒蛋白进行融合或者通过降低N-糖基化状态,提高其诱导中和抗体的能力。
GP3 蛋白由ORF3 基因编码, 是最可变的PRRSV 蛋白之一,具有高度的抗原性。尽管猪体内存在极低水平的GP3 抗体, 但据报道它在清除病毒感染方面发挥作用, 并可能与GP5 和M蛋白一起参与病毒中和作用。
GP4 蛋白是一种I 类整合膜蛋白分子量为31 至35 KDa,具有N 端信号序列和C 端膜锚定区。 GP4 蛋白在通过内质网-高尔基体复合体转运过程中高度糖基化。 在蛋白质中发现了四个假定的N-连接糖基化位点, 在NA 和EU PRRSV 毒株中是保守的。 氨基酸序列显示,GP4在位置1-22 处含有一个假定的N-末端信号序列,在C-末端的位置162-178 处含有一个额外的疏水序列。 GP4 蛋白是一种次要结构蛋白,分别由178 和183 个氨基酸组成, 适用于NA 和EU 毒株,与GP5 类似,能够在较小程度上诱导中和抗体。用ORF4 缺失的感染性cDNA 克隆转染PRRSV 许可细胞表明ORF4 基因对病毒复制至关重要。
3 PRRSV 的致病机理
猪是唯一已知的PRRSV 自然宿主。 PRRSV感染后最先攻击的是肺脏器官,PRRSV 破坏呼吸道假复层纤毛上皮, 并且在猪肺泡巨噬细胞(PAM) 进行复制, 阻止微生物从呼吸系统中清除。PAM 主要功能包括吞噬作用、抗原呈递和细胞因子的产生。PRRSV 诱导PAM 的坏死或凋亡并且还诱导肺和淋巴器官中淋巴细胞和巨噬细胞的凋亡,损害宿主免疫反应。
PRRSV 感染分为急性感染、 持续感染与消亡三个阶段。第一阶段为急性感染,PRRSV 首先攻击肺部的巨噬细胞和树突细胞, 并在感染后6~12 小时内出现病毒血症。虽然存在循环抗体,但血清病毒血症一直存在数周。 第二阶段为持续感染,由于病毒的复制减弱,此时在血液及肺部检测不到病毒,临床症状不明显。 在这个阶段病毒复制主要局限在扁桃体和淋巴结。 局部淋巴结中持续的病毒复制是病毒通过口鼻分泌物和精液传播给未感染的猪的主要原因。 感染的最后阶段为病毒的消亡,随着病毒复制的减少,宿主清除病毒,直至消失。 目前病毒消失的时间尚不明确, 但感染后的排毒最高可持续8 个月以上,造成“终身”感染。 因此,PRRSV 复制不会建立稳定状态的平衡, 而是随着时间的推移逐渐下降, 淋巴器官是病毒消亡前病毒复制的最后部位。
母胎界面内的细胞变化和局部免疫反应的机制以及在PRRS 相关生殖疾病中的病理生理作用尚不清楚。 PRRSV 到达子宫内膜结缔组织最可能与通过子宫内膜血管迁移的单核细胞有关;随后病毒可在Sn/CD169 和CD163 巨噬细胞中复制。 病毒复制通过凋亡和可能的继发性坏死导致局部感染细胞和周围细胞死亡, 导致胎儿胎盘的局灶性脱离和变性, 这可能是胎儿死亡的原因,而不是PRRSV 在胎儿组织内复制的直接结果。 病毒复制受子宫内膜和胎儿胎盘中靶细胞数量的影响。 尽管CD163 细胞的数量在整个妊娠期一直较高,但Sn/CD169 细胞的数量在胎儿胎盘内的细胞及妊娠晚期最高。 PRRSV到达胎儿后,病毒复制发生在肺、肝、脾、心和肾等组织中。 可以在淋巴组织和胎儿胸腺中检测到病毒,后者被认为是病毒复制的主要位点。

母体来源或通过接种获得的PRRSV 特异性抗体可促进病毒进入靶细胞, 从而增加传染性,称为抗体依赖性增强(ADE),其潜在机制目前尚不清楚, 但ADE 现象影响PRRSV 疫苗的开发。 其他RNA 病毒研究发现表明ADE 不仅能增强病毒摄取,还可能抑制宿主的I 型干扰素系统。 ADE 使病毒避免于自分泌和旁分泌所产生的IL-10 的抗炎和免疫抑制作用。 由于PRRSV 感染猪的支气管肺泡灌洗液中IL-10 的产生显着增加, 推测在PRRSV 感染的ADE 过程中,PAM 中IL-10 会发生显著的上调,这可能有助于下调IFN-α/β 和其他炎性细胞因子的产生。 因此, 减弱或消除可能由疫苗接种引起的ADE 的负面影响应被视为开发新型PRRSV 疫苗的关键因素。
由于对免疫细胞的影响导致的免疫抑制,PRRSV 增加了宿主对多种病毒及细菌呼吸道病原的易感性,使猪的临床症状更加明显,肺部病变也更为严重。PRRSV 常与一些疾病混合感染,包括猪呼吸道冠状病毒(PRCV)、 猪流感病毒(SIV)和猪圆环病毒2 型(PCV2)等疾病。与单独感染PRRSV 的猪相比,混合感染的猪会出现更严重的临床症状和生长迟缓等现象。 在同时感染PRRSV 和PRCV 的猪中,严重的临床症状与肺部先天免疫反应受损有关, 特别是由于干扰素(IFN)-α 表达降低导致自然杀伤细胞(NK) 介导的细胞毒性降低。 适应性免疫反应也受损,白细胞介素IL-6 和IL-10 浓度增加进而引起PAM 细胞凋亡增强有关。
4 国内PRRSV 感染情况
汤国祥对2006~2007 年湖南省5 个市猪蓝耳病感染情况进行调查。 结果发现蓝耳病感染率68.94%。 其中6~8 月感染率最高,12~2 月最低。 范京惠等研究发现2008~2009 年河北省不同猪场PRRS 的总体阳性率53.04%, 其中未免疫疫苗的猪场阳性率33.57%; 免疫过的阳性率73.94%; 仔猪的阳性率为33.86%。 高许雷等对2008~2009 年我国五省区 屠宰场的样品进行了HPPRRSV 检测, 结果检出阳性率为44%。张子佳等研究发现2006~2011 年唐山地区64 个县级屠宰场的总阳性率为51.56%。 另外,样品总阳性率为20.29%, 其中高致病性PRRSV 和 经 典PRRSV 样 品分别为15.94%和4.35%。 汪招雄等对湖北省12 个集约化养猪场血清蓝耳病毒(PRRSV) 抗体检测结果显示PRRSV 总阳性率为26.38%,其中母猪群阳性率最高,保育仔猪阳性率最低。杨克礼等研究发现鄂西山区2013~2015 年间全部未免疫PRRSV 疫苗猪的PRRSV 抗体阳性率为48.45%并且PRRSV 与PCV2、PRV 出现混合感染。 邹秀明等发现2016~2018 年怀化市部分地区猪场PRRS 抗体阳性率为75.52%。 免疫疫苗的抗体阳性率为86.41%, 未免疫的规模化猪场为27.63%。 综上所述,PRRSV 感染已在全国各省不同地区猪场中普遍存在,同时存在较高比例的隐性感染猪群, 以NADC30-like 株为主多种毒株共存,临床症状多样化,因此繁殖呼吸综合征病毒感染仍然是影响我国生猪健康养殖的重要传染病之一。
5 PRRSV 防治措施
PRRS 具有致病力强、致死率高、传播快、易变异等特点,给养猪业带来巨大的经济损失。 当今猪场危害最大的疾病是PRRS,增强猪群免疫力,最大限度的降低感染压力,综合防治结合疫苗的策略进行防控。PRRSV 的传播多样且复杂,均能引起动物发病。 有研究表明,新感染的猪一部分是直接通过病猪或者感染公猪的精液的途径而感染,75%以上的比例是由飞禽,老鼠,蚊虫以及运输途中携带病毒的运输工具引起。
对于PRRS 的防控管理是首位;其次是做好临床监测和规范合理的疫苗免疫, 最终实现净化和根除PRRS 才是根本。在管理上要制定科学合理的生物安全制度,如猪场的合理布局、坚持全进全出制度、坚持自繁自养、猪场内的消毒问题、做好药物保健降低寄生虫疾病,细菌性疾病的感染压力、 加强免疫营养减少应激增强猪群的非特异性免疫、 猪场物资和人员进场制定使用合理的消毒程序;要控制合理的养殖密度,在养殖密集区可以选择安装空气过滤系统以降低感染风险; 当今猪场引种成了最大的生物安全挑战,因为引种而导致重大疾病时有发生,因此在引种前要建立引种及隔离程序, 而且程序是经过技术验证科学可行的,并保证执行到位。 做好猪场生物安全能够降低感染病原微生物的压力, 阻止疾病传播, 提高养殖场经济效益的目的。
PRRS 防控的核心是科学合理的疫苗免疫,目前我国使用的PRRS 疫苗按疫苗种类分为:灭活疫苗、减毒活疫苗、基因工程苗。 按毒株分类有:经典毒株疫苗、高致病性毒株疫苗、经典毒株(ORF1a)+高致病性毒株(ORF2-7)疫苗三类。其中经典毒株疫苗包括灭活疫苗的CH-1a 株,减毒活疫苗的CH-IR 株、R98 株、VR-2332 株。 高致病性毒株包括灭活疫苗的JXA1 株、减毒活疫苗的GDr180、 JXA1-R 株、TJM-F92 株、HuN4-F112 株。 经典毒株 (ORF1a)+高致病性毒株(ORF2-7)为基因工程疫苗PC 株。 这10 种疫苗在我国各个地区广泛使用, 而且有研究证实经典毒株或高致病性毒株疫苗面对现在的NADC30-like 主导毒株能提供60%~70%的保护。 面对种类繁多的疫苗猪场要选择适合本场实际情况的疫苗,切忌多毒株疫苗混用,要充分考虑活疫苗的安全性问题和灭活苗的有效性问题,规模化猪场建议进行实验室检测,制定合理免疫程序,做好定期的抗体检测。 未来希望可以研究出可以具有标记的DIVA 疫苗,来区分自然感染和疫苗免疫, 提供更广的交叉保护并能刺激较好的非特异性免疫应答的PRRS 疫苗,终止现在多疫苗混用的局面。实现PRRS 的净化与根除才是根本。

