红藜种子黄酮物质的提取及体外抗氧化活性测定
李涛,刘婷,周琼
(1.安康市质量技术检验检测中心,陕西 安康 725000;2.安康学院现代农业与生物科技学院,陕西 安康 725000)
红藜(Chenopodium formosanumKoidz),俗称台湾藜,一年生木质草本,一般高2.5 m,柄长3˜10 cm,身长6˜20 cm,宽4˜7 cm,是苋科藜属植物的一种。台湾藜的种子在成熟时显深褐色,耐旱性、抗逆性、环境适应性非常强,又由于自身气味对山麻雀和一些害虫有抵制作用,可达一年两生的高产量。
红藜的功能性成分以皂素、多酚类、甜菜色素为主,而黄酮类化合物作为自然界存在的最大类别的酚类物质之一,能够增强超氧化物歧化酶(SOD)活性,降低过氧化脂质、清除自由基生成,在体内代谢产生大量酚酸类物质,具有一定的延缓氧化、抑菌消炎、防癌、降血压、保护心血管等作用[1-5]。
以台湾藜的种子为原料,通过合理的技术手段提取出红藜种子中的黄酮物质,是对其合理利用的有效途径。并对提取出的黄酮物质进行体外抗氧化活性测定,为今后广泛用于医药、化妆品和食品加工提供了理论依据。
1 材料与方法
1.1 试验材料与试剂
台湾当地种植的红藜。无水/95%乙醇、丙酮(分析纯),天津市恒兴化学试剂制造有限公司;维生素C(食品级),石家庄石药集团维生药业有限公司;1,1-二苯基-2-苦基肼(DPPH)、50 U/mg纤维素酶、芦丁标准品,上海源叶生物科技有限公司。
1.2 主要仪器和设备
DHG-92140A型电热鼓风干燥箱,上海一恒科学仪器有限公司;FW100型高速万能粉碎机,天津市泰斯特仪器有限公司;KH2200E型超声波清洗机,昆山禾创超声仪器有限公司;XYJ-A型大容量电动离心机,江苏金坛市福华仪器有限公司;EV60S型紫外可见分光光度计,美国热电有限公司;HH-S4型电热恒温水浴锅,北京科伟永兴仪器有限公司;电子天平,赛多利斯科学仪器有限公司。
1.3 试验方法
1.3.1 原料预处理选取台湾红藜种子置于60℃电热鼓风干燥箱中烘干至恒重,碾碎过60目筛,装入自封袋内干燥避光,并置于冰箱中备用[6,7]。
1.3.2 黄酮物质的测定方法
1)芦丁标准溶液的配制。参照赖红芳等[8]的方法,配制0.01 mg/mL的芦丁标准溶液。
2)黄酮物质最大吸收波长的确定。参照杨萌等[9]的处理方法,以第1管为空白,将第2管置于波长480˜530 nm进行扫描,以吸光度值(A)为响应值绘制波长与吸光值的曲线图,确定提取黄酮的最大吸收波长。
3)标准曲线的绘制。参照王磊等[10]的方法,将0.1 mg/mL芦丁储备液稀释成浓度为0、0.01、0.02、0.03、0.04、0.05 mg/mL的溶液,在最佳波长处测定吸光度,绘制标准曲线。
4)黄酮物质的计算方法。用1 mL移液管量取红藜种子黄酮物质提取液于10 mL容量瓶中,以相应溶剂作空白对照,在510 nm处测吸光度,由吸光值根据回归方程计算出红藜种子黄酮物质提取液的质量浓度(C),从而计算得率。计算公式如下。

式中,C表示黄酮物质提取液的质量浓度(mg/mL);V0表示测定吸光值所用待测样的体积(mL);V1表示提取剂的总体积(mL);V2表示待测液定容后体积(mL);M表示台湾红藜种子粉末的质量(g)。
1.3.3 红藜种子黄酮物质的提取方法提取剂的确定。于100 mL三角瓶中准确加入红藜粉末1.00 g,分别加入甲醇、乙醇和去离子水各30 mL,50℃水浴浸提2 h,使用4 000 r/min离心机离心10 min。将所得待测液置于特定波长下测吸光度。同时只加试剂,不加样品做空白,做3组平行,取平均值。确定出红藜种子黄酮物质的最佳提取溶剂。
1)乙醇浸提法。参照并改进孙雪婷等[11]的方法,称取1.00 g红藜种子粉于100 mL三角瓶中,加入85%乙醇30 mL,50℃水浴加热2 h,4 000 r/min离心10 min,取上清液低温避光保存、待用。
2)超声波辅助提取法。参照并改进张海容等[12]的方法,称取1.00 g红藜种子粉置于100 mL三角瓶中,加入85%乙醇30 mL,50℃水浴提取2 h,超声波清洗30 min,4 000 r/min离心10 min,取上清液低温避光保存、待用。
3)纤维素酶辅助提取法。参照并改进李育峰等[13]的方法,称取1.00 g红藜种子粉置于100 mL三角瓶中,加入85%乙醇30 mL,调节pH 5.0,再加入0.4%纤维素酶于50℃水浴提取2 h,4 000 r/min离心10 min,取上清液低温避光保存、待用。
4)超声波-纤维素酶复合提取法。参照并改进石松标等[14]的方法,称取1.00 g红藜种子粉于100mL三角瓶中,加入85%乙醇30 mL,调节pH 5.0,再加入0.4%纤维素酶于50℃水浴中酶解2 h,超声清洗30 min,4 000 r/min离心10 min,取上清液低温避光保存、待用。
1.3.4 单因素试验
1)最适纤维素酶质量分数的确定。分别加入质量分数为0.2%、0.4%、0.6%、0.8%、1.0%纤维素酶,其余参照“1.3.3”超声波-纤维素酶复合提取法。在510 nm波长下测其吸光度。同时只加试剂不加样品做空白,3组平行,取平均值。
2)最适提取温度的确定。分别将水浴温度调至30、40、50、60、70℃,其余参照“1.3.3”超声波-纤维素酶复合提取法。在510 nm波长下测其吸光度。同时只加试剂不加样品做空白,3组平行,取平均值。
3)最适乙醇体积分数的确定。分别加入体积分数为55%、65%、75%、85%、95%的乙醇溶液30 mL,其余参照“1.3.3”超声波-纤维素酶复合提取法。在510 nm波长下测其吸光度。同时只加试剂不加样品做空白,3组平行,取平均值。
4)最适液料比的确定。分别加入85%乙醇溶液10、20、30、40、50 mL,其余参照“1.3.3”超声波-纤维素酶复合提取法。在510 nm波长下测其吸光度。同时只加试剂不加样品做空白,3组平行,取平均值。
5)最适提取时间的确定。分别水浴提取30、60、90、120、150 min,其余参照“1.3.3”超声波-纤维素酶复合提取法。在510 nm波长下测其吸光度。同时只加试剂不加样品做空白,3组平行,取平均值。
6)最适酶解pH的确定。分别加pH为4.0、4.4、5.0、5.4、5.8的缓冲液,其余参照“1.3.3”超声波-纤维素酶复合提取法。在510 nm波长下测其吸光度。同时只加试剂不加样品做空白,3组平行,取平均值。
7)最适超声时间的确定。分别置于超声波清洗器10、20、30、40、50 min,其余参照上述超声波-纤维素酶复合提取法。在510 nm波长下测其吸光度。同时只加试剂不加样品做空白,3组平行,取平均值。
1.3.5 正交试验将红藜种子黄酮物质得率作为考察项目,以单因素试验为分析基础,得出纤维素酶的质量分数、酶解温度、超声时间、料液比4因子为显著影响因素,采用L9(34)正交表。如表1所示。

表1 正交试验因素与水平
1.3.6 黄酮物质体外抗氧化活性的测定方法
1)DPPH自由基清除率的测定。参照孙雪婷等[15]的方法,进行全波长扫描,证实在517 nm附近有强吸收。后续于此波长检测吸光度A样品(Ai),用2 mL无水乙醇与2 mL黄酮物质提取液测定吸光度A对照(Aj),用2 mL 0.1 mg/mL DPPH-乙醇溶液与2 mL无水乙醇测定吸光度为A空白(Ac),用维生素C作阳性对照。

2)羟自由基(·OH)清除率的测定。参照孙雪婷等[15]的方法,进行全波长扫描,证实在510 nm附近有吸收峰。将所得待测液置于510 nm处测定其吸光度A样品(Ai),用去离子水替换水杨酸测定吸光度A对照(Aj),用去离子水替换红藜种子总黄酮提取液测定吸光度A空白(Ac),用维生素C作阳性对照。

3)半抑制浓度(IC50)的计算。由于体外抗氧化活性测定试验常以半抑制浓度(IC50)作为考察指标,因此需根据黄酮物质提取液对自由基的清除率及自身浓度关系绘制线性回归方程。当清除率达50%时,与之对应的提取液浓度大小即为IC50。当IC50越小时,说明红藜种子中的黄酮物质清除自由基的能力越强[16]。
2 结果与分析
2.1 提取黄酮物质的结果与分析
2.1.1 黄酮物质最大吸收波长的确定波长-吸光值关系曲线如图1所示。由图1可知,最大吸收波长出现在513 nm处,故后续试验于513 nm处测定红藜种子中的黄酮物质。

图1 黄酮物质最大吸收波长的确定
2.1.2 标准曲线的确定按照“1.3.2”的方法测得表2数据,绘制标准曲线如图2所示,该芦丁标准曲线以芦丁浓度作x轴,吸光度作y轴,回归方程为y=8.185 7x+0.002 9,R2=0.999 5。
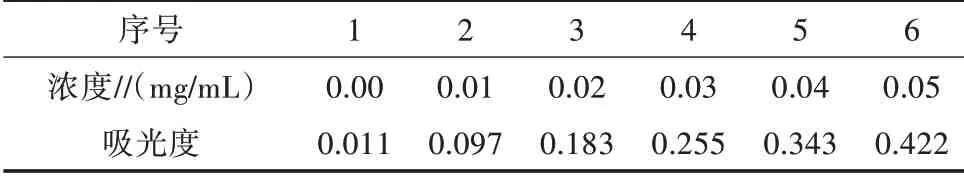
表2 芦丁标准曲线数据

图2 芦丁标准曲线
2.1.3 提取溶剂的确定提取溶剂试验结果见表3。水提取红藜种子黄酮物质的效果明显不如有机试剂,虽然甲醇、乙醇提取效果差别不显著,但相对乙醇,甲醇易挥发、有毒性、成本高,故此次试验选用乙醇作为最佳提取溶剂。

表3 不同提取溶剂的黄酮提取率
2.1.4 提取方法的确定提取方法的试验结果见表4。超声波-纤维素酶复合提取法使红藜种子黄酮物质的提取率显著提高,这可能因为超声波高频振动增加了物料与提取剂的接触面积,且纤维素酶能破坏植物的细胞壁,利于黄酮物质的溶解和扩散,从而大大提高提取率。故后续选用超声波-纤维素酶复合提取法提取红藜种子黄酮物质。

表4 不同提取方法的选择
2.2 单因素试验的结果与分析
2.2.1 纤维素酶质量分数对红藜种子黄酮得率的影响纤维素酶质量分数对黄酮得率的影响结果见图3。红藜种子的黄酮物质得率随纤维素酶质量分数的增大整体呈先增长后降低的趋势,并于0.4%时达到最大。可能是因为酶浓度较低时,底物和纤维素酶的接触机会少,不足以使底物酶解完全;酶浓度增加到0.4%时,酶解接近完全,黄酮物质得率最大;0.4%以上时,随着酶量增加,抑制酶解,提取率下降。因此酶的最适浓度在0.4%。

图3 不同纤维素酶的质量分数对黄酮得率的影响
2.2.2 料液比对红藜种子黄酮得率的影响料液比对黄酮得率的影响结果见图4。当提取剂体积从10 mL增至20 mL时,黄酮得率显著增大,20˜40 mL内增长缓慢,大于40 mL开始有降低的趋势。可能是因为当提取溶剂体积增大时,提取液中黄酮浓度逐渐减小(浓度差越大),有利于种子细胞中的黄酮物质向胞外扩散和溶解;当达到一定量时,黄酮物质浓度达到饱和,再加大提取剂用量对提取效果无积极作用且造成浪费。因此,从经济效率与提取效率综合考虑,最佳料液比为1∶40。

图4 料液比对黄酮得率的影响
2.2.3 乙醇体积分数对红藜种子黄酮得率的影响乙醇体积分数对黄酮得率的影响结果见图5。一定浓度范围内,黄酮得率几乎呈线性增长;当乙醇体积分数为65%时,黄酮物质溶解量最多,得率最大;当大于65%时,黄酮提取率逐渐降低。可能因为随着乙醇体积分数的增加使一部分醇溶性、亲脂性强的成分、色素逐渐溶出,竞争乙醇,从而导致黄酮物质的提取率逐渐减少[17]。故提取黄酮物质的最适乙醇体积分数为65%。

图5 乙醇体积分数对黄酮得率的影响
2.2.4 酶解温度对红藜种子黄酮得率的影响酶解温度对黄酮得率的影响结果见图6。30˜60℃时,黄酮得率随温度的上升几乎呈线性增长;60℃时黄酮得率最高;当超过60℃时黄酮物质得率开始降低。一方面可能由于低温抑制黄酮物质在溶剂中的溶解和扩散,提取率低;另一方面纤维素酶的最适温度为60℃,此时酶活最高,使黄酮得率达最高;高于60℃,随温度增加,黄酮物质的结构逐渐遭到破坏,且纤维素酶的活性降低,不利于黄酮物质提取,故得率降低。因此,最适温度在60℃。
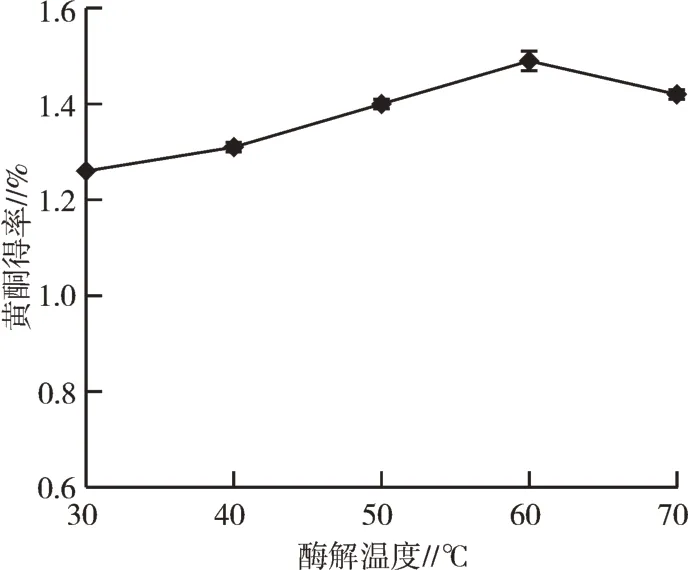
图6 酶解温度对黄酮得率的影响
2.2.5 提取时间对红藜种子黄酮得率的影响提取时间对黄酮得率的影响结果见图7。提取时间达2 h时黄酮得率最高;2 h之后,随时间的推移黄酮得率降低。一方面可能因为2 h时,刚好酶解完全,黄酮物质完全溶于溶剂中,提取率达最高。另一方面是因为长时间提取,其他物质逐渐溶出,与黄酮竞争提取剂,使黄酮得率降低;并且长时间提取,会造成乙醇挥发量增多,也不利于提取黄酮。为在有效的周期内达到理想效果,提取时间选取120 min为宜。

图7 提取时间对黄酮得率的影响
2.2.6 酶解pH对红藜种子黄酮得率的影响酶解pH对黄酮得率的影响结果见图8。随pH的增大,黄酮得率逐渐降低。这可能由于pH 4.0时纤维素酶的活性达到最强,破除细胞壁的能力也越强,利于细胞内黄酮物质的溶出提取。因此酶解的最佳pH应选为4.0。
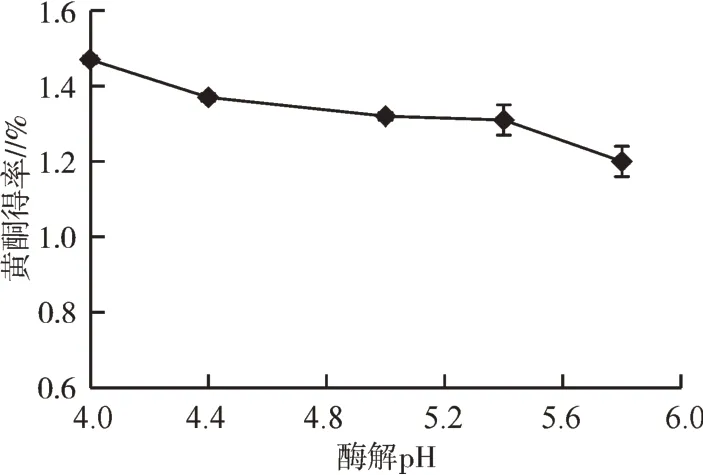
图8 酶解pH对黄酮得率的影响
2.2.7 超声时间对红藜种子黄酮得率的影响超声时间对黄酮得率的影响结果见图9。超声时间30 min内黄酮物质得率升降不明显;超声30 min后黄酮物质得率显著降低。这可能因为随着超声时间增大,纤维素酶的结构及黄酮物质成分被破坏,使提取液中的黄酮物质浓度降低,导致测定结果降低。继续延长超声时间不但浪费时间,还加大提取成本。综合来看,前30 min内的超声波基本上能有效提取红藜种子黄酮物质,最适超声提取时间选为10 min。

图9 超声时间对黄酮得率的影响
2.3 正交试验结果与分析
2.3.1 红藜种子黄酮物质提取的结果与分析按照“1.3.5”项表1所示,利用正交设计对各因素的提取条件进行优化,以黄酮物质得率为考察指标,平行测量2次,结果见表7。

表7 红藜种子黄酮物质提取正交试验的结果分析
根据表7中的极差分析,比较极差R大小,得影响红藜种子黄酮物质得率的因素主次顺序为料液比(A)>酶的质量分数(B)>酶解温度(C)>超声时间(D)。得到提取黄酮物质的最优组合为A2B3C2D1,即超声时间为10 min,料液比为1∶40(g∶mL),纤维素酶的质量分数为0.6%,酶解温度60℃。此条件下黄酮物质得率达2.78%。
2.3.2 验证试验的结果与分析由于正交优化得到的提取黄酮物质的最佳工艺参数与表7中黄酮得率最高的试验组合不相匹配,所以进行验证试验,同时做2组水平,得表8数据。如表8所示,在最优工艺条件A2B3C2D1提取黄酮比试验组合A3B3C2D1提取黄酮效果更好,因此后续试验选择最优工艺参数较为合理。

表8 验证性试验结果比较
2.4 体外抗氧化活性测定结果
2.4.1 清除DPPH·的能力分析
1)DPPH·最大吸收波长的确定。DPPH·最大吸收波长的测定结果见图10。由图10可知,实际值与理论值相符,即DPPH·在517 nm处有最大吸收峰。

图10 DPPH·最大波长的确定
2)红藜种子黄酮物质对DPPH自由基的清除效果。红藜种子黄酮提取液对DPPH自由基的清除效果如图11、图12所示。在一定浓度范围内,随浓度的增大,黄酮提取液对DPPH自由基的清除作用增强,两者成一定量效关系。当黄酮物质浓度为0.084 6 mg/mL时,对DPPH自由基的清除率达92.91%;当维生素C浓度仅为0.003 mg/mL时,对DPPH自由基的清除率高达95.83%;且0.08 mg/mL黄酮提取液与0.000 5 mg/mL维生素C清除DPPH自由基的能力相当。通过模拟曲线方程,得维生素C的IC50为0.028 8 mg/mL,红藜种子黄酮提取液的IC50为0.368 9 mg/mL,表明红藜种子黄酮物质具有一定的抗氧化活性。

图11 红藜种子黄酮物质对DPPH·的清除作用

图12 维生素C对DPPH·的清除作用
2.4.2 清除·OH的能力分析
1)·OH最大吸收波长的确定。·OH最大吸收波长的测定结果见图13。如图13可知,实际值与理论值相符,测定·OH清除率时的最大波长在510 nm处。

图13 ·OH最大波长的确定
2)红藜种子黄酮物质对·OH的清除效果。红藜种子黄酮提取液对·OH的清除效果如图14、图15所示。在一定浓度范围内,随着浓度的增大,红藜种子黄酮物质对·OH的清除作用也逐渐增强。当低浓度时,红藜种子黄酮物质提取液对·OH的清除效果不及维生素C。当红藜种子黄酮物质提取液浓度为0.084 6 mg/mL时,对·OH清除率是94.72%;而维生素C的浓度仅为0.003 mg/mL时,对·OH清除率高达99.84%;且0.08 mg/mL黄酮提取液与0.001 5 mg/mL维生素C清除·OH的能力相当。通过模拟曲线方程,可知维生素C的IC50为0.007 9 mg/mL,黄酮的IC50为0.017 6 mg/mL。表明红藜种子黄酮物质具有一定的抗氧化活性。
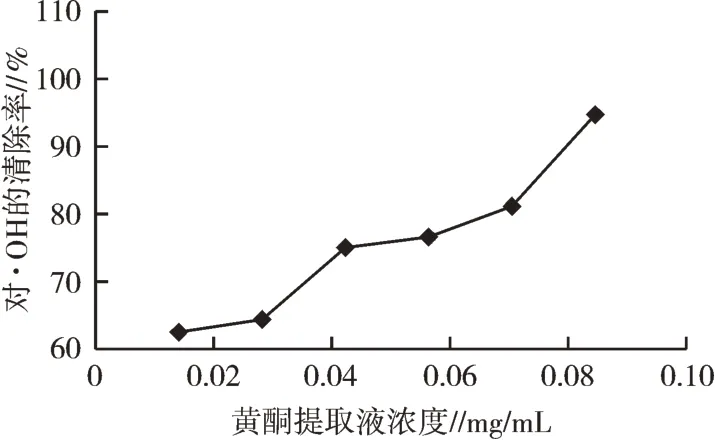
图14 红藜种子黄酮物质对·OH的清除作用

图15 维生素C对·OH的清除作用
3 小结
在确定红藜种子黄酮物质提取方法前经过多次预试验,参考并调整前人的研究方案。对比4种提取方法,得出在天然活性成分提取过程中,加以物理、生物方法辅助,能显著提高活性成分提取率且不引入毒害物质,具有一定的工业实践价值。
通过正交试验对提取方法的各因素进行优化,最终把纤维素酶质量分数0.6%,料液比1∶40(g∶mL),酶解温度60℃,超声时间10 min确定为最佳提取条件,黄酮得率达27.81 mg/g。且经验证得实际值与理论值相符,具有一定的参考价值。
通过测定红藜种子提取液对DPPH·及·OH的清除效果,研究了黄酮物质的体外抗氧化活性,结果显示红藜种子黄酮提取液具有较高的清除DPPH·及·OH的能力,特别在较高浓度下,抗氧化能力接近维生素C。这一结果进一步证实从台湾红藜种子中提取出的黄酮物质具有一定的应用前景,且作为一种天然有效的抗氧化剂,可广泛应用于医药、保健品、食品加工等方面。

