枸杞化学成分及其药理作用研究
邹新,产柳佳,易冰,丁世磊,裴栋,魏鉴滕,赵立春
(1.广西中医药大学药学院,南宁 530200;2.广西壮瑶药工程技术研究中心,南宁 530200;3.中国科学院兰州化学物理研究所/中国科学院西北特色植物资源化学重点实验室,兰州 730000)
枸杞系茄科枸杞属(Lycium)落叶多棘刺灌木植物,主要生于温带和亚温带地区的山坡、沙地,在全球有约80种,中国有7个种3个变种,主产区在宁夏、甘肃、山西、新疆、青海、陕西、河北、内蒙古等省份[1,2],本研究对枸杞(Lycium chinense)和宁夏枸杞(Lycium barbarum)化学成分及药理作用研究进展进行综述。最早在中国《诗经》中就描述了枸杞采摘的地理位置及形状特征[3]。枸杞全草可药用,《本草经集注》中记载[4]:“冬采根,春、夏采叶,秋采茎、实,阴干”。明代《本草纲目》将枸杞列为上品并记载[5]:“盖其苗乃天精,苦甘而凉,上焦心肺客热者宜之;根乃地骨甘淡而寒,下焦肝肾虚热者宜之,此皆三焦气分之药。”现代研究也表明,枸杞全身可用,果实、叶子、根皮均有药用价值[6],中医上枸杞子用于虚劳精亏、腰膝酸痛、眩晕耳鸣、阳萎遗精、内热消渴、血虚萎黄等病症,地骨皮用于阴虚潮热、骨蒸盗汗、肺热咳嗽、咯血、衄血等病症[7]。枸杞叶用于养阴清火、解渴生津[8]。枸杞的果实和根皮作为中药被收载于2020年版中国药典。
枸杞相关部位化学成分研究始于20世纪50年代,是日本学者对“汉方药”中地骨皮的化学成分研究[9],1963年报道枸杞叶中分离得到β-sitosterol-β-D-glucoside[10],70年代 开 始 分离 得 到 一些 甾 族 成分,80年代对叶子和果实研究较多[11],随后发现枸杞中含有阿托品和莨菪碱[12],至今国内外研究者从枸杞属植物中分离鉴定出的化学成分类型包括生物碱类、多糖类、黄酮类、苯丙素类及其他类化学成分。本研究对国内外相关文献进行分析研究,从化学成分研究及其药理作用研究进展进行了归纳,以期为枸杞的资源价值挖掘与资源开发提供参考。
1 枸杞的化学成分
1.1 生物碱类
生物碱类化合物是枸杞属植物的主要特征成分之一,主要包括打碗花精类生物碱、托品类生物碱、酰胺类生物碱、吡咯类生物碱、哌啶类生物碱、咔啉类生物碱和其他生物碱,具体1˜14号化合物分别为calystegine A3、calystegine A5、calystegine A6、calystegine A7、calystegine B1、calystegine B2、calystegine B3、calystegine B4、calystegine B5、calystegine C1、calystegine C2、calystegine N1、N-methyl-calystegine B2、N-methyl-calystegine C1,来源部位均为根部[13]。
1.1.1 打碗花精类生物碱1997年Asano等[13]从枸杞根中发现了打碗花精类成分,其对半乳糖苷酶具有特异性的抑制作用。
1.1.2 托品类生物碱Harsh[14]在1989年从枸杞中分离了阿托品(Atropine)、东莨菪碱(Scopolamine)、莨菪碱(Hyoscyamine),具体见表1。

表1 枸杞中分离得到的托品类生物碱
1.1.3 酰胺类生物碱酰胺类生物碱是枸杞中研究较多的一类生物碱,其抗氧化效果显著。化合物18˜20通过了NBT超氧化物清除试验[16]。表2为枸杞中分离得到的酰胺类生物碱来源部位和参考文献。1˜40号生物碱类化合物化学结构见图1。

表2 枸杞中分离得到的酰胺类生物碱

图1 枸杞中1~40号生物碱类化合物化学结构
1.1.4 吡咯类生物碱吡咯类生物碱主要存在于枸杞果实中,药理作用为具有保肝活性,其化学结构见图2,其中化合物43、44显著阻断了GPT从CCl4损伤肝细胞中的释放[27]。表3为枸杞中分离得到的吡咯类生物碱。

表3 枸杞中分离得到的吡咯类生物碱
1.1.5 哌啶类生物碱枸杞中哌啶类生物碱是六元环胺,1997年Asano等[13]从枸杞根部发现了Fagomine和6-Deoxy fagomine,对应编号为50和51,其化学结构见图2。
1.1.6 咔啉类生物碱Han等[29]从枸杞果实中分离了咔啉类生物碱,此类成分在枸杞中较少。具体报道的化合物分别为Lycii-alkaloid-i、Lycii-alkaloidiii、Lycii-alkaloid-iv,来源部位为果实,对应编号为52˜54,其化学结构见图2。
1.1.7 枸杞中其他生物碱甜菜碱在枸杞子中的含量是其质量判断的重要标准之一[30]。表4为枸杞中分离得到的其他生物碱,其化学结构见图2。谢忱等[31]从枸杞果实水提物中分离了甜菜碱。

表4 枸杞中分离得到的其他生物碱
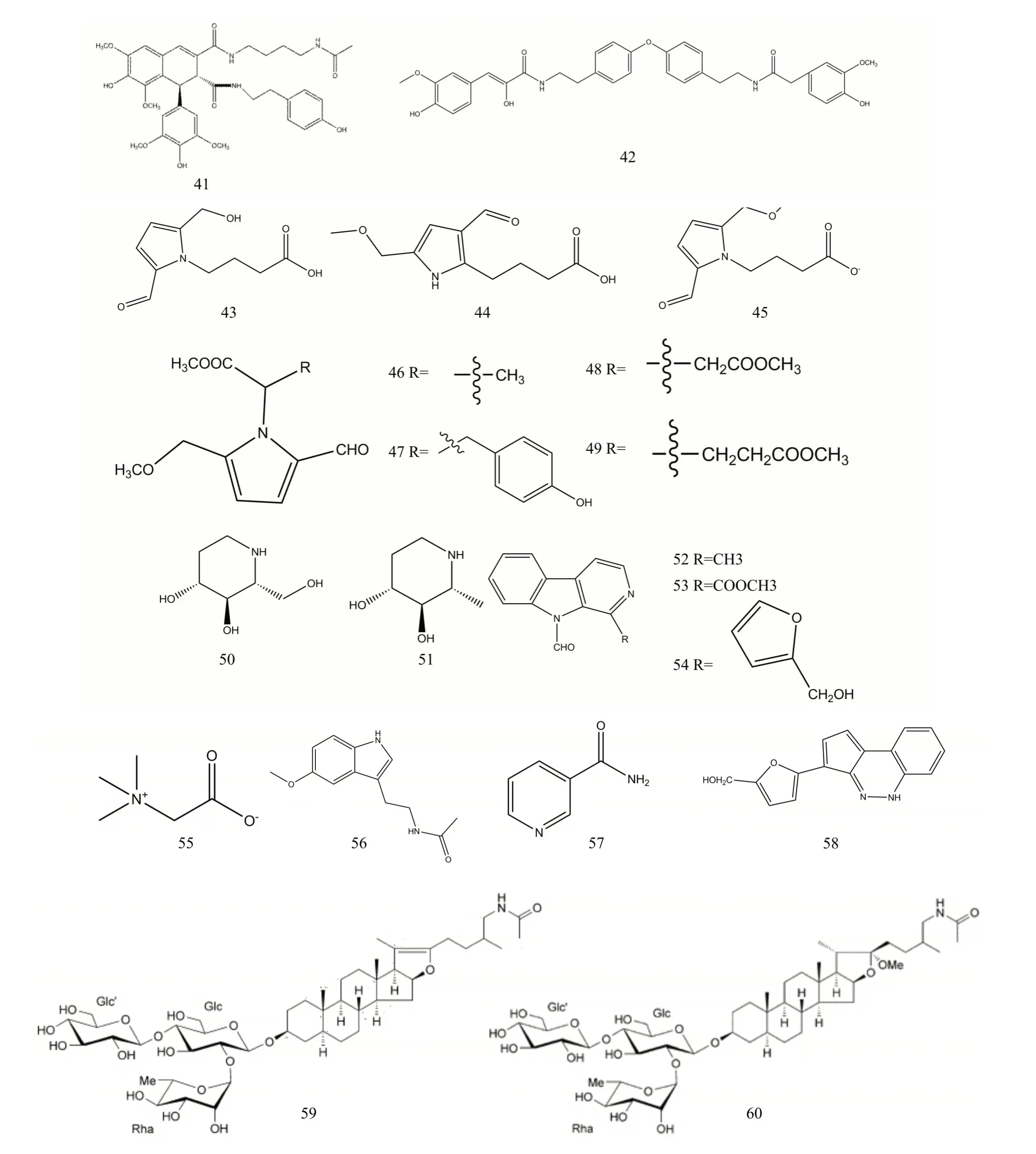
图2 枸杞中41~60生物碱类化合物化学结构
1.2 糖类
枸杞多糖被认为是枸杞发挥生物学功效的最重要的组成成分,由多种单糖、多糖、糖醛酸与氨基酸或者脂质形成,具有多种活性和药理作用,化学物见表5,化学结构见图3。
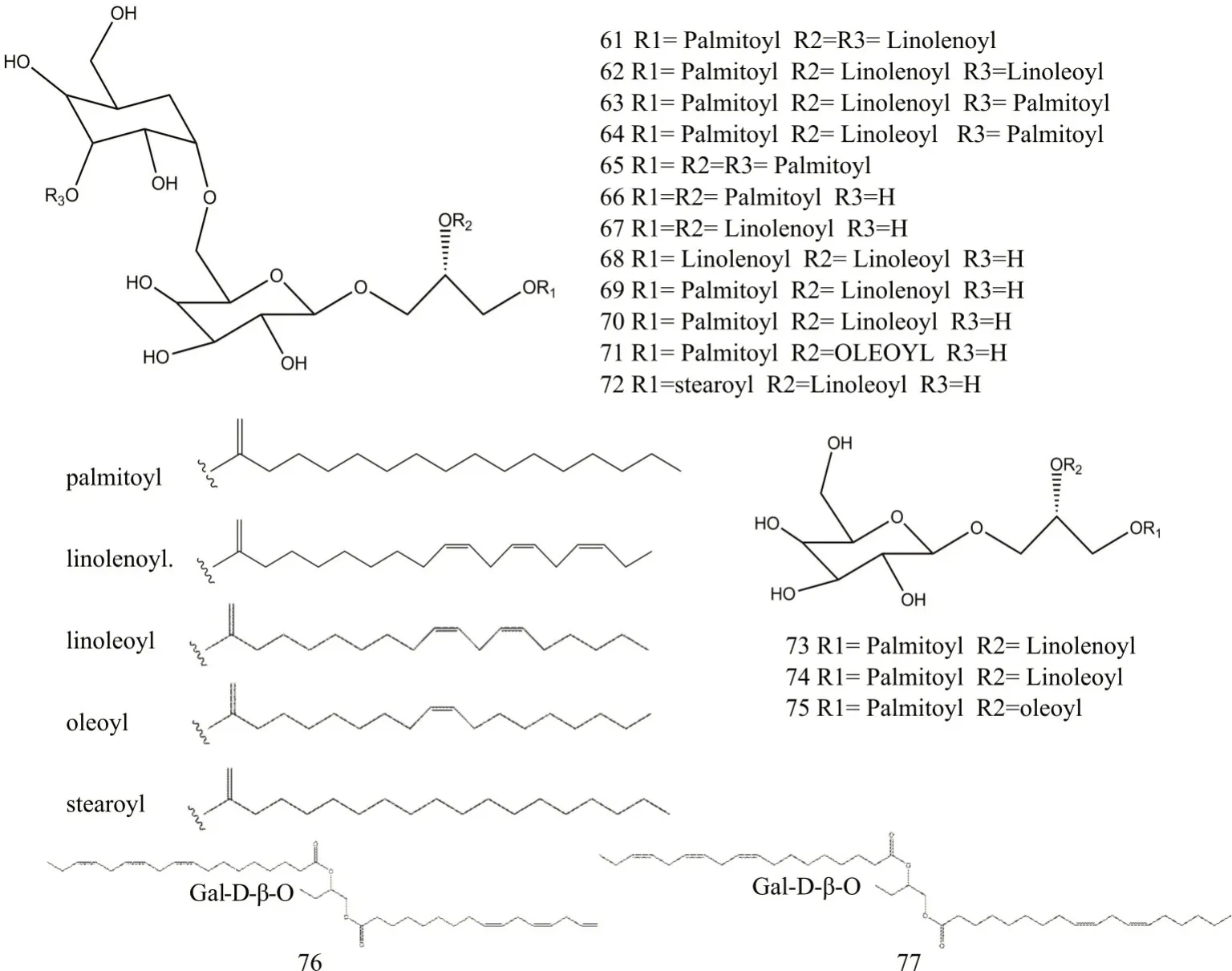
图3 枸杞中糖类化合物化学结构

表5 枸杞中分离得到的糖类
1.3 黄酮类
枸杞中黄酮苷主要以山柰酚和槲皮素为母核,该类化合物是枸杞中的主要抗氧化成分,其中化合物78、89通过了ABTS自由基清除活性以及亚铁离子螯合活性测试[38],化合物见表6,化学结构见图4。
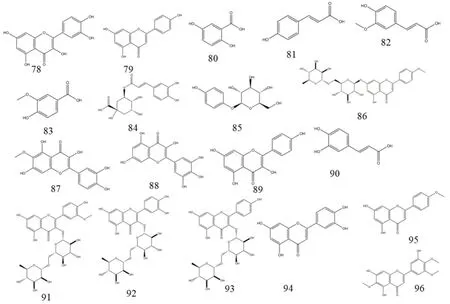
图4 枸杞黄酮类化合物化学结构

表6 枸杞中分离得到的黄酮类化合物
1.4 苯丙素类
李行诺等[43]从枸杞根皮中首次分离得到Saikolignanoside A,魏秀丽等[44]从枸杞根皮中首次分离得到东莨菪甙(Scopolin)、Fabiatrin化合物,其他化合物见表7,化学结构见图5。

图5 枸杞中分离得到的苯丙素类化合物化学结构

表7 枸杞中分离得到的苯丙素类化合物
1.5 其他化合物
枸杞中除上述几类化合物,枸杞中含类胡萝卜素,主要包括β-胡萝卜素、β-隐黄质、叶黄素、玉米黄质,还有一些类胡萝卜素脂肪酸酯[19,32,47]、花青素及苷类[48]。枸杞中含有20多种氨基酸[49]以及钾、铜、镁、铁、锌、锗、锰等多种对人体有益的微量元素[50]。
2 药理作用
2.1 保护肝肾
枸杞能够对扑热息痛导致的肝炎Ⅰ期、Ⅲ期损伤,CCL4导致的肝损伤有良好的改善作用,在肝炎中使用枸杞可使天冬氨酸转氨酶(AST)、丙氨酸转氨酶(ALT)、氧化应激指数(OSI)明显下降,使得抗氧化酶水平恢复[51,52]。通过高脂饮食诱导NASH大鼠模型,枸杞多糖喂食的大鼠病理样本结果表明,枸杞多糖可提高游离脂肪酸水平,改善脂质代谢,通过TGF-β/SMAD下调促纤维因子表达,通过P53信号通路改善肝细胞凋亡[53]。
枸杞能减轻X射线对肾脏组织造成的氧化损伤和细胞凋亡,可能是通过提高肾脏组织对自由基的清除能力实现的[54],枸杞多糖对阴茎海绵体有改善作用,刘波等[55]用海绵体钳夹损伤大鼠海绵体,通过腹腔注射枸杞多糖后,结果表明,枸杞多糖组阴茎充血勃起指标ICP和海绵体甲苯胺蓝染色阳性神经轴突数目高于损伤对照组,枸杞多糖有助于海绵体神经再生及勃起功能。对于高温导致睾丸组织受损大鼠,枸杞多糖能改善生精功能,促进睾丸正常发育,其机制可能是促进垂体分泌性腺激素[56]。Wu等[57]研究发现,枸杞多糖对于LPS诱导的脓毒症大鼠模型肾脏进行保护,枸杞多糖组可上调HO-1、NQO1和Nrf2的mRNA水 平,下调NF-κB和Keap1的蛋白水平,但是枸杞多糖调节Keap1-Nrf2/ARE信号传导的分子机制还需要进一步探讨。
2.2 保护眼睛
一方面,枸杞提取物可以增强视网膜色素上皮细胞ARPE-19生存能力,可能是通过调节caspase蛋白表达酶的活性,在高糖诱导下对ARPE-19细胞起保护作用[58];另一方面,可以通过抑制炎症因子和NF-κB/MAPK通路相关因子磷酸化对细菌脂多糖(LPS)诱导人视网膜色素上皮细胞产生的炎性反应,黄洁[59]用枸杞多糖干预光诱导ARPE-19细胞24 h可显著降低ARPE-19细胞的凋亡率,其机制可能是激活PI3K/Akt/mTOR信号通路,从而发挥其对光诱导ARPE-19细胞损伤的保护作用,降低光损伤后ARPE-19细胞ROS水平,降低MDA含量,增加总SOD活力。有学者发现,枸杞的提取物及其牛酸成分上调PPAR-γ mRNA和蛋白质,在糖尿病视网膜病变进展中发挥作用[60]。
2.3 抗氧化、抗衰老
枸杞中富含多糖和黄酮多酚类化合物,可以清除自由基,存在抗氧化性,枸杞水提物和醇提物都具有抗氧化性,且存在明显的剂量关系,醇提物抗氧化强于水提物[61]。枸杞子的乙酸乙酯提取部位也具有较好的抗氧化能力,具有浓度依赖性,其对羟自由基有很强的抑制和清除作用[62]。枸杞多糖体外抗氧化活性也很强,可以对对羟基自由基、超氧阴离子和DPPH自由基产生清除作用[62]。
枸杞多糖提取物有延缓D-gal诱导小鼠衰老的潜力,可以通过其抗氧化能力从而延缓衰老,对于D-gal诱导小鼠模型,可以通过增加血液中SOD、CAT和GSH-px水平并降低MDA水平实现,还可以改善皮肤SD活性、减少皮肤MDA含量[63]。基于网络药理学发现,枸杞子多个活性成分对VEGFA、TNF、MMP-9、白细胞介素-8、白细胞介素-6等靶点进行调控,影响AGE、RAGE、IL-17、TNF等信号通路,发挥改善AMD的作用[64]。李晶等[65]通过Wistar大鼠衰老模型发现,枸杞多糖组能明显降低羰基蛋白含量,增加GSH含量和增强GST活性,延缓衰老。
2.5 抗肿瘤
雷蕾等[66]通过体外试验发现,枸杞叶总黄酮明显抑制人肝癌细胞HepG2增殖和诱导细胞凋亡,其机制可能是通过上调促凋亡蛋白Bax、破坏细胞内稳态环境、激活Caspase-3蛋白使得肝癌细胞HepG2凋亡。Zhang等[67]发现枸杞叶多糖成分对于人体肝癌细胞(SMMC-7721)也有抑制作用,可能是降低细胞膜流动性,抑制细胞生长。胡妮等[68]建立了H22荷瘤小鼠模型,灌胃给药发现枸杞多糖单用和枸杞多糖+CXCL10联合相较于空白组都有较高的抑癌率,可以显著提高外周血IL-12、TNF-α mRNA表达,其作用机制可能是通过诱导DC功能成熟的关键性细胞因子IL-12、TNF-α分泌,从而增加肿瘤微环境的DC数量,进而抑制肿瘤。
2.6 神经保护活性
眼内压力(IOP)的增加被认为是视网膜结膜细胞(RGCs)逐渐丧失的主要危险因素,Chan等[69]发现枸杞对于眼部高血压模型大鼠,可以降低RGC的损失,为保护视网膜神经节细胞丧失提供新治疗途径。Ho等[70]发现枸杞水提物可以降低乳酸脱氢酶(LDH)释放水平,减少caspase-3酶的活性,为神经退行性疾病的药物开发开辟了一条新途径。Liu等[71]研究发现,地骨皮中含有的Kukoamine A可以调节氧化状态并调节细胞凋亡以减轻脑缺血大鼠的神经损伤,能够保护大脑免受由pMCAO通过线粒体介导凋亡信号通路引起的伤害。Li等[72]发现枸杞中Kukoamine A能有效防止H2O2诱导的原发性小脑颗粒神经元(CGNs)模型中的细胞损伤,其机制可能是通过PI3-K/Akt/GSK3β通路来抑制神经元凋亡。枸杞叶和枸杞多糖还能改善快速老化模型小鼠的老化征象和学习记忆能力[73]。Chen等[74]研究发现,枸杞多糖可以改善东莨菪碱(SCO)引起的认知和记忆障碍,阻止SCO诱导的细胞增殖和神经母细胞分化的减少,LBP对SCO诱导的免疫活性神经元突起的丢失也有保护作用。
2.7 抗炎、退热
枸杞具有抗炎活性,其主要抗炎成分包括黄酮类、酚酸类和酚醛酰胺,Chen等[75]发现枸杞提取物可以缓解小鼠胃溃疡、减少炎症介质产生和下调caspase-3活性。Xie等[20]发现地骨皮中的酰胺类成分可抑制NF-κB的活性,其中Trans-N-caffeoyltyramine有较强的抑制作用(IC50=18.4 μmol/L),地骨皮也有抗炎效果,其主要活性成分是N-反-阿魏酰酪胺,通过抑制LPS诱导的RAW 264.7巨噬细胞,通过参与AP-1和MAP激酶信号通路抑制NO和PGE2的产生,从而达到抗炎作用[76]。
2.8 降血糖
枸杞多糖、地骨皮水煎剂、枸杞叶具有降血糖作用[77-79]。降糖效果与剂量有明显关系,尹长江等[80]发现枸杞多糖对于2型糖尿病大鼠具有良好的降血糖效果,高剂量改善作用最明显,效果与格列本脲相近。高剂量的枸杞叶降糖作用优于中低剂量的枸杞叶,且与苯乙双胍效果相近[79]。枸杞多糖对于链脲佐菌素(STZ)致糖尿病大鼠有明显疗效,可以显著降低糖尿病大鼠的血糖以及恢复胰岛素水平,该机制可能通过下调胰岛组织中iNOS mRNA的表达,增强抗氧化应激能力从而恢复受损胰岛功能[81]。粗提物的降糖效果可能与其抗氧化作用有关[82,83]。
2.9 其他药理作用
枸杞可以抗辐射损伤,枸杞多糖可以保护UVA及UVB致人皮肤成纤维细胞的损伤和人角质形成细胞,机制可能与抗氧化作用和促进细胞增殖作用有关[84,85],也可以降低辐射带来的染色体畸变、精子畸形率[86]。
Zhao等[87]发现,枸杞多糖可以使力竭运动的大鼠SD、NO、HSP70显著增加,上调eNOS的表达,以此来改善主动脉环血管内皮依赖性的舒张。张文娟等[88]在游泳训练力竭运动致大鼠胸主动脉血管内皮细胞损伤研究中,发现枸杞多糖口服可改善去甲肾上腺素(NE)诱导的血管收缩。
李雯等[89]发现枸杞多糖可以改善LPS诱导的小鼠急性呼吸窘迫综合征(ARDS)肺损伤,缓解肺微血管内皮屏障损伤,机制可能与激活Akt/eNOS信号通路、减少氧化应激以及细胞凋亡有关。枸杞多糖对半胱氨酸(Hcy)诱导的血管平滑肌细胞增殖和表型转化具有潜在的治疗作用,通过抑制PI3K/Akt信号通路表达,抑制Hcy引起的血管平滑肌细胞增殖,抑制Hcy引起的血管平滑肌细胞由收缩型向合成型转化[90]。
3 小结
枸杞资源丰富,主要含有生物碱类、、黄酮类、多糖类、苯丙素类及其他类化学成分,目前多为多糖、黄酮、酰胺类药理作用报道,主要药用部位为枸杞果实、根皮、叶子,药效显著,但现在多为粗提物研究,还可以更进一步研究其化学成分,分析其单体成分。药理研究多处于细胞或者动物水平,未来方向可结合分子生物学、蛋白组学、代谢组学进一步深入分析枸杞作用的靶点。枸杞还存在研究空间,为更加合理、有效利用枸杞亟待进一步开发和探索。

