基于“磷酸-铁粉”体系回收锂离子电池金属方法探讨
张金钟,樊相汝,李 岚,黎育才,羊依金
(1.中国石油工程建设有限公司西南分公司,成都 610094;2.成都信息工程大学,成都 610225; 3.中国石油天然气股份有限公司西南油气田川东北作业分公司,四川 达州 636164)
引 言
电池产品使用在我们日常生活的方方面面[1~5],而锂离子电池由于具有工作电压高、体积小、无记忆效应、自放电小、循环寿命长等优点,被广泛应用于手机、笔记本电脑、充电宝等电子产品中。随着锂离子电池用量增长,伴随而来的是退役或失效电池的快速增长,而后大量的废旧锂离子电池无法得到妥当安置,直接废弃会对环境问题造成严重的影响。废弃锂离子电池不仅是危险废弃物,还是可进行回收再利用的可用资源[8]。废旧的锂离子电池中含有Co、Li、Mn、Fe等金属,通过高效的回收利用废旧锂离子电池中的金属[9],不仅可以减少废弃物对环境的危害,还有利于资源循环利用和经济可持续发展。因此,对电池进行综合回收利用,特别是可回收金属类别多的锂离子电池的回收利用,将会是未来重要的研究方向[10-11]。
目前,废旧锂离子电池的回收领域主要是对电池正极材料的回收,处理工艺以湿法浸出和火法冶金为主。湿法浸出包括酸浸和碱浸,由于酸浸法效果更好,使用更为普遍[12]。酸浸法多是采用“酸+双氧水(H2O2)”以浸出废旧锂离子电池中的金属离子,在加以回收,其中的酸主要是利用强酸,如盐酸、硫酸和硝酸等。由于硝酸和硫酸腐蚀性强,对设备有较高的要求,盐酸在浸出过程中会产生氯气(Cl2)等毒气体及酸性废水,使得后续处理困难,且严重污染环境[13]。本研究用“磷酸+还原铁粉”体系浸出钴酸锂回收金属钴和锂,磷酸较温和,对设备没有较高的要求,且不会产生有毒气体和酸性较高的废水,易处理,价格便宜,生产成本较小;另外用还原铁粉(Fe)代替H2O2,克服了实际工程应用H2O2容易分解,用量难以控制这一缺点,环境效益及经济效益明显。
1 材料与方法
1.1 实验材料
原料:钴酸锂(LiCoO2),取自笔记本电脑电池。
试剂:盐酸(HCl)、磷酸(H3PO4)、还原铁粉(Fe)、氢氧化钠(NaOH),均为分析纯,由成都市科龙化工试剂厂提供。
仪器:SHZ-82气浴恒温振荡器(上海福马实验设备有限公司)、GGX-6赛曼火焰原子吸收分光光度计(北京海光仪器公司)、PHB-1型便携式酸度计(杭州奥立龙仪器有限公司)、分析天平(北京赛多利斯科学仪器有限公司)、DX-2700HB 型X射线衍射仪(辽宁丹东浩元仪器厂)、ICPOES-725电感耦合等离子体光谱仪(Agilent Technologies)。
1.2 实验方法
1.2.1 LiCoO2成分含量测定
用盐酸浸出钴酸锂,研究电池正极的主要成分[14]。
取两份1 g样品于50 mL锥形瓶中,向两个锥形瓶中分别加入20 mL浓盐酸和20 mL浓盐酸+2 mL H2O2,待溶解反应完全后,过滤杂质,将滤液定容至10 L,然后用火焰原子吸收分光光度计测定溶液中的各金属浓度。
1.2.2 浸出实验
取1 g LiCoO2粉末,与一定浓度的磷酸按一定的液固比于50 mL锥形瓶中混合,向其中加入一定量的Fe粉,置于一定温度下的气浴恒温振荡器中。待反应完成后将浸出液过滤,并用蒸馏水洗涤滤渣,调节pH并定容至10 L。用火焰原子吸收分光光度计测定溶液中Li和Co的浓度。
浸出率(%)= (H3PO4+ Fe粉浸出金属浓度)/(浓HCl浸出金属浓度)×100%
1.2.3 金属Co、Li、Al的回收与表征
利用溶度积差异将浸出滤液中的Co、Li、Fe以Co3(PO4)2、Li3PO4和Fe3(PO4)2的形式沉淀分离回收,并通过XRD和ICP表征回收物。
2 结果与讨论
2.1 LiCoO2成分组成
通过盐酸浸出得到所用废旧锂电池的正极材料LiCoO2主要成分含量如表1、图1所示。

表1 盐酸浸出溶液的金属浓度Tab.1 Metal concentration of hydrochloric acid leaching solution (μg/mL)

图1 钴酸锂中成分含量比例图Fig.1 Proportional diagram of composition ratio of lithium cobalt acid
由表1、图1可知,浓盐酸添加H2O2浸出样品的效果与只用浓盐酸的浸出浓度相差不大,说明浓盐酸能在不加H2O2的条件下将钴酸锂中的Li和Co很好地浸出来。正极材料LiCoO2中Co的含量最多,已超过50%,除了Co和Li两种金属外还有如Ni等金属存在,其他成分中主要包括氧和一些未被检测出来的金属元素。
2.2 单因素试验
采用“磷酸+还原铁粉”体系浸出钴酸锂回收金属钴和锂,由氧化还原电位可知,浸出过程中Fe会被Co3+氧化为Fe3+,可能的反应方程式如下:
3Co3++Fe→3Co2++Fe3+
(1)
Fe+2H+→Fe2++H2↑
(2)
Co3++Fe2+→Co2++Fe3+
(3)
反应过程中,在Fe3+生成的同时,也存在与酸反应生成Fe2+,最后都将以Fe3+的形式回收。
2.2.1 Fe粉添加量的影响
固定浸出温度T = 35℃,时间t = 1 h,液固比L/S = 20 mL/g,磷酸浓度c = 2 mol/L,改变还原铁粉的用量,探究Fe粉添加量WFe(Fe与LiCoO2的摩尔比,%)对浸出效果的影响。

图2 还原剂Fe粉添加量的影响Fig.2 Effect of adding amount of reducing agent Fe powder
由图2可知,Co和Li浸出浓度随着还原剂用量的增大而增加,在还原铁粉添加量为60%时达到最大,而后略微下降。这可能是由于Fe量的增加,参与还原Co3+的Fe越多,从而还原得到的Co2+增多,但是当Fe过量时,剩余的Fe与H3PO4反应使得浸出液pH降低,溶液中的Fe3+产生水解反应可能会生成Fe(OH)3胶体,而Fe(OH)3胶体具有一定的吸附作用,从而使得溶液中的金属浓度降低。综上所述,最佳的铁粉投加量为Fe与LiCoO2摩尔比的60%。
2.2.2 磷酸浓度的影响
固定浸出温度T=35℃,时间t=1h,液固比L/S = 20 mL/g,还原剂Fe粉用量WFe= 60%,改变磷酸浓度,探究磷酸浓度对浸出效果的影响。

图3 磷酸浓度的影响Fig.3 Effect of phosphoric acid concentration
由图3可知,当磷酸浓度很小(< 0.8 mol/L)时,Co、Li的浸出浓度都很小,分别为5.8846 μg/mL和1.6354 μg/mL,这可能是因为溶液中电离出的H+较少,不能与LiCoO2充分接触,阻止内扩散的进行。当酸浓度大于0.8 mol/L时,两种金属浓度随酸浓度增加而急剧增加,直到磷酸浓度为2 mol/L时增长趋于平缓,表明此时电极材料中的Co、Li很好地浸出到溶液中。当然酸浓度越高越能更快更完全的浸出金属,但是考虑到经济效益,选择2 mol/L的磷酸为最佳浸出浓度。
2.2.3 浸出时间的影响
固定浸出温度T=35℃,磷酸浓度c = 2 mol/L,液固比L/S = 20 mL/g,Fe粉量WFe= 60%,改变浸出时间,探究浸出时间对浸出效果的影响。
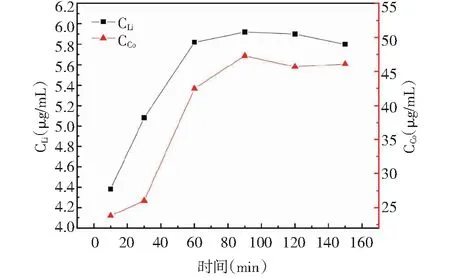
图4 浸出时间的影响Fig.4 Effect of leaching time
由图4可知,在90 min内两种金属浓度随时间增长而升高,Co的浓度是在90min后就开始下降,而Li却在120min后才缓慢下降。这可能是由于随着时间的推移,溶液中的H+在逐渐消耗,同时也会致使pH升高使金属产生沉淀,所以选取最佳浸出时间为90min。
2.2.4 液固比的影响
固定浸出温度T = 35℃,磷酸浓度c = 2 mol/L,Fe粉量WFe= 60%,时间t = 90min,改变固液比,探究液固比对浸出效果的影响。

图5 液固比影响Fig.5 Effect of liquid-solid ratio
由图5可知,两种金属浸出率随着液固比的增大先升高并逐渐趋于平缓,表明加大液固比可以使酸溶液与钴酸锂充分接触,增大反应面积,加快反应速率。考虑到资源成本,选择最佳的液固比为30 mL/g。
2.2.5 浸出温度的影响
固定磷酸浓度c = 2 mol/L,Fe粉量WFe=60%,时间t = 90 min,液固比L/S = 30 mL/g,改变浸出温度,探究浸出温度对浸出效果的影响。

图6 浸出温度的影响Fig.6 Effect of leaching temperature
由图6可知,Co和Li的浸出浓度随温度的升高先增大,在温度达到45℃时逐趋于平缓。这是由于温度的升高能加快溶液的扩散,促进酸溶液与钴酸锂的反应速率,也能加快Co3+与Fe以及Co3+还原成Co2+的反应速率,使得钴酸锂更快的溶解在浸出液中,所以选取最佳的浸出温度为45℃。
2.3 正交实验探究最佳条件
为进一步确定 LiCoO2的最佳浸出条件,以单因素实验为基础,在最佳单因素条件附近缩小范围,以此进一步确定最佳浸出条件。将磷酸浓度、浸出温度、浸出时间、液固比、Fe粉量5个因素各选取4个水平,设计正交实验L16(45),结果如表2所示。
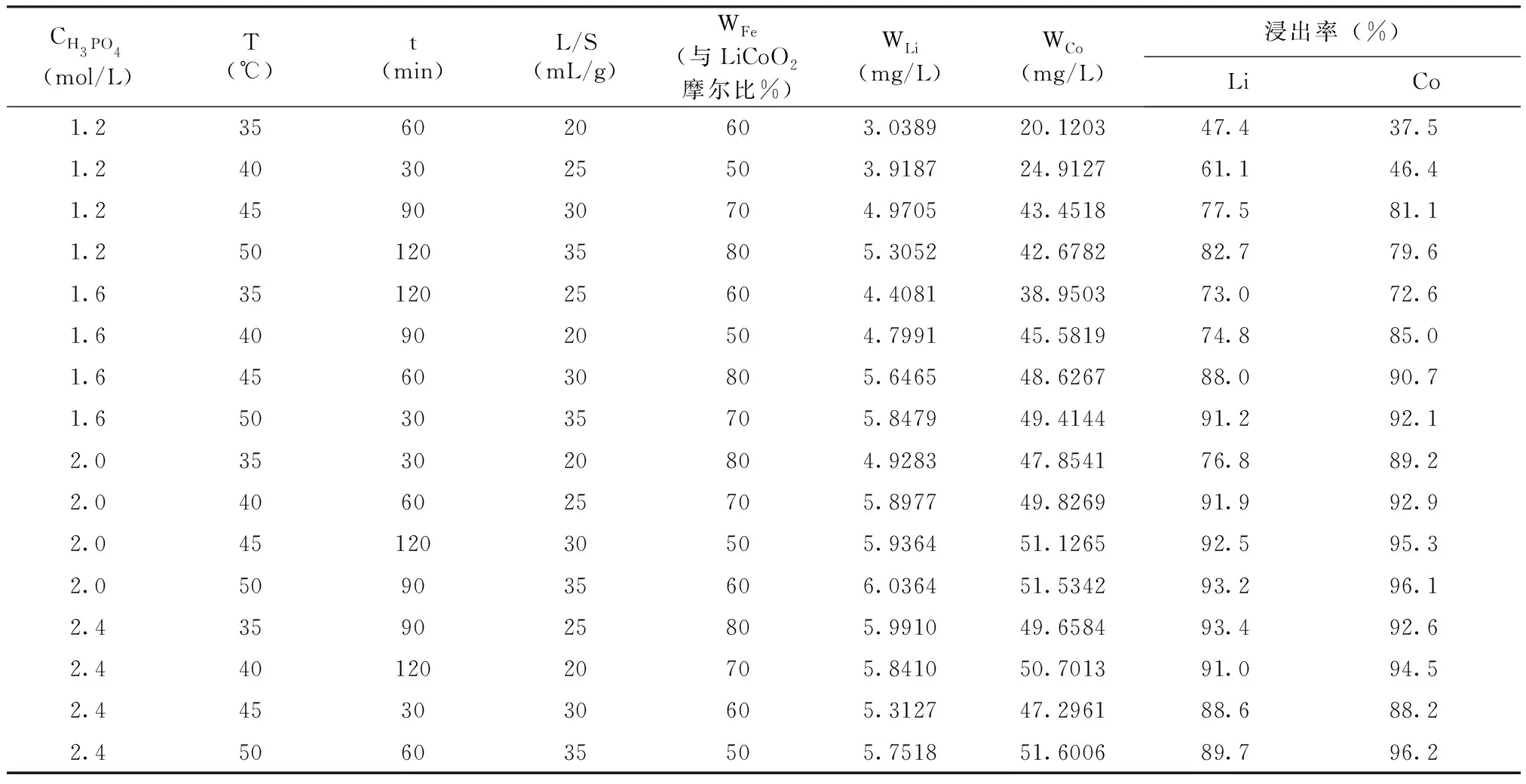
表2 正交实验表Tab.2 Orthogonal test table
考虑到单因素实验、回收金属的价值(以2021年6月的市场平均价格作为参考,金属Li 65万元/t、金属Co 35万元/t),综合分析得出的最佳浸出条件为:磷酸2 mol/L、温度50℃、浸出时间90 min、液固比35 mL/g、Fe粉量WFe= 60%,此时Co和Li的浸出率分别达到了96.1%和93.2%。

表3 极差分析表Tab.3 Range analysis table
另外,由极差(R)分析可知,在所选水平范围内,以Co为目标探究各因素对浸出率影响,结果如表3,各因素影响顺序为:CH3PO4> T >WFe> L/S > t,表明磷酸浓度在整个实验过程中对于金属的浸出效率影响最大,这也就印证了正交实验结果,当酸浓度较低时浸出效率较低,酸浓度较高时浸出效率较高。而浸出时间对浸出结果影响较小,当时间达到60min时,浸出率已达到较高水平,之后随着时间的增加浸出率变化不大。
2.4 浸出液中Co3(PO4)2、Li3PO4、FePO4的沉淀回收
利用溶度积常数Ksp对浸出液中的金属元素进行回收。梅光贵[15]等研究表明,FePO4、Li3PO4和Co3(PO4)2的溶度积常数Ksp分别为1.3×10-22、5.00×10-31和2.00×10-35,用氢氧化钠溶液调节“磷酸+还原铁粉”体系浸出滤液pH值,利用溶度积差异沉淀回收FePO4、Co3(PO4)2、Li3PO4,Co3(PO4)2、Li3PO4、FePO4的沉淀pH区间以及观察到的颜色如表4所示,沉淀pH区间、沉淀化合物的颜色与Li[16]、Chen[17]等研究的结果相符。
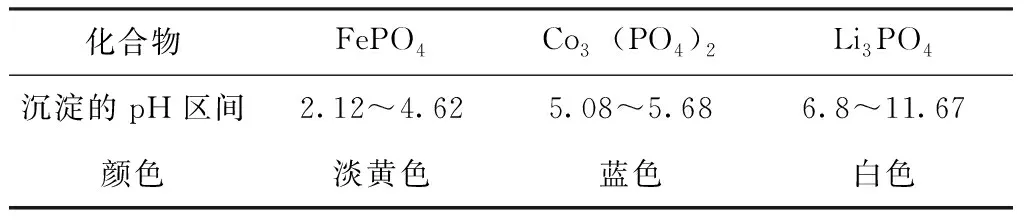
表4 回收化合物的性质Tab.4 Properties of recovered compounds
2.5 回收物质的表征
2.5.1 XRD分析
使用XRD测定样品可过谱图信息,可判定所测样品的组成成分。图7为使用XRD测定的Co3(PO4)2、FePO4的特征谱图,图8为回收的Li3PO4特征谱图。

图7 Co3(PO4)2 、FePO4 的XRD图Fig.7 XRD patterns of Co3(PO4)2 and FePO4
由图7可知,沉淀生成的Co3(PO4)2、FePO4都无明显的吸收峰,峰型较宽,存在较多的低矮杂峰,说明回收得到的化合物没有一定的形态,呈不规则颗粒状。这与周文彩[18]等的研究结果一致,在常温下通过沉淀反应合成的FePO4,在经高温煅烧之前难以形成化合物的晶型状态。
由图8可看出,Li3PO4(标准卡片:15-760)的峰形尖锐信号强,通过特征峰位置说明回收的Li3PO4属于γ-Li3PO4结构[19],Li3PO4有明显吸收峰。并且回收的Li3PO4中还含有Li2HPO4(标准卡片:35-172),但相对Li3PO4的峰信号较弱,这可能是因为在沉淀过程中先生成的是Li2HPO4,随着沉淀反应的进行Li3PO4的量逐渐增大,而Li2HPO4的量逐渐减小,直到最后有少量的Li2HPO4被大量Li3PO4所包裹,从而阻断了与NaOH的反应,最后导致样品中含有少量Li2HPO4。

图8 回收Li3PO4 的XRD图Fig.8 XRD pattern of recovered Li3PO4
2.5.2 ICP分析
向三种沉淀回收化合物中添加硝酸进行溶解,稀释后用ICP测定各金属浓度,通过浓度计算回收化合物的纯度及化合物中各金属的含量和目标,结果如表5所示。

表5 回收化合物的组成及纯度Tab.5 Composition and purity of recovered compounds
由表5可知,沉淀回收得到FePO4、Co3(PO4)2、Li3PO4三种物质,其纯度分别达到81.69%、87.83%、91.00%。三种沉淀回收物中均含有杂质铝,这些铝元素可能来自于预处理时未将包裹锂电池的铝箔完全去除。因为常温下,铝在pH为3.8~5.3之间产生沉淀[20],FePO4在pH为4.62时才沉淀完全,Co3(PO4)2在pH大约为5.08时就开始沉淀,因此在化合物FePO4和Co3(PO4)2中铝杂质较多。而Li3PO4的溶度积与FePO4和Co3(PO4)2的差异较大在pH为11.67才能沉淀完全,因此Li3PO4中的铝含量极低。
3 结 论
3.1 锂离子电池正极材料LiCoO2中以Co为主要成分,同时存在Ni、Li等金属元素。
3.2 湿法浸出的最佳浸出条件为磷酸浓度为2 mol/L、温度50℃、浸出时间90 min、液固比35 mL/g、Fe粉添加量60%,此时Co和Li的浸出率分别达到96.1%、93.2%,不同因素影响浸出效果的顺序为:CH3PO4> T > WFe> L/S > t。
3.3 利用溶度积差异沉淀法回收得到的FePO4、Co3(PO4)2、Li3PO4的纯度分别为81.69%、87.83%、91.00%,样品呈无定形晶体,含少量铝杂质。
3.4 通过使用“磷酸-铁粉”体系处理锂离子电池进行回收再利用,在保证回收率的的情况下,降低了成本、减少了污染,这种低能耗、低污染的处理方式将会是未来锂离子电池处理的新方向。

