外源添加剂对羊草种子萌发的影响
梁润芳, 李志勇, 武自念, 贺有权, 郝 龙, 孔令琪(.中国农业科学院草原研究所, 内蒙古 呼和浩特 0000;.丰镇市农牧和科技局, 内蒙古 乌兰察布 099)
羊草(Leymuschinensis)又名碱草,是禾本科赖草属多年生优质牧草,在我国北方广泛分布。羊草不仅产量高、品质好、适口性好、再生力强,而且具有抗寒、抗旱[1]、耐盐碱[2]等优良特性,是一种优质高产的牧草资源。羊草对我国发展人工草地建设、退化草地修复和荒漠治理等方面具有重要作用[3]。羊草在自然生境中无性繁殖占绝对优势,而有性繁殖能力较弱[4],主要表现为严重的“三低”现象:发芽率低(20%~30%)、抽穗率低(20%~40%)、结实率低(30%~50%)[5]。近年来,畜牧业飞速发展,改良天然草地,建立优质高产的人工草地等都需要大量的羊草种子[6],而种子发芽率低严重影响了羊草的生产应用。过氧化氢(Hydrogen peroxide,H2O2)是细胞有氧代谢的产物,是活性氧的一种[8]。马悦等[9]研究表明,适量浓度的H2O2可以打破种子休眠,促进种子萌发,如今已广泛应用于农业生产中。甲基紫精(Methylviologen,MV)是过氧化氢的合成前体,MV在植物体内可作为电子受体将光系统反应Ⅰ(PSⅠ)的电子传递给氧气,在光下分解产生H2O2,从而促进种子萌发[10]。脱落酸(Abscisic Acid,ABA)是植物体内源激素,有研究指出,ABA是引起种子休眠的主要因素[4]。N-乙酰半胱氨酸(N-acetyl-L-cysteine,NAC)属于抗氧化剂的一种,具有清除植物体内过多活性氧的作用。本试验以4种外源添加剂(H2O2、MV、ABA、NAC)对羊草种子进行处理,分析发芽率、发芽势、发芽指数、活力指数、根长、苗长及根长/苗长参数,研究外源添加剂对羊草种子萌发的影响,为促进羊草种子萌发,提高羊草种子产量及品质提供新的理论方法。
1 材料与方法
1.1 材 料
本试验所用羊草种子于2018年收获于内蒙古锡林郭勒盟西乌珠穆沁旗,室温贮藏,由中国农业科学院草原研究所提供。
1.2 试验设计
挑选籽粒大小相当且饱满的羊草种子,分别以不同浓度的H2O2、MV、ABA、NAC对羊草种子进行处理,蒸馏水为对照(ck)。其中H2O2的浓度分别为1 mmol/L、25 mmol/L、50 mmol/L、100 mmol/L;MV的浓度分别为0.1 μmol/L、1 μmol/L、10 μmol/L;ABA浓度分别为10 μmol/L、50 μmol/L、100 μmol/L;NAC的浓度分别为1 mmol/L、5 mmol/L、10 mmol/L。将种子放入铺有双层润湿滤纸(不见明显水层)的培养皿(90 mm×90 mm)中。设置4个重复,每个重复50粒种子。使用人工气候培养箱,在20 ℃、12 h黑暗,30 ℃、12 h光照条件下进行发芽试验。以50 μmol/L ABA和5 mmol/L的NAC分别与1 mmol/L、25 mmol/L、50 mmol/L、100 mmol/L H2O2及0.1 μmol/L、1 μmol/L、10 μmol/L MV进行交互作用。试验方法同上。
1.3 指标测定
每天定时观察发芽情况,适当补充蒸馏水和相应的外源添加剂处理液,以胚根伸出种皮1~2 mm作为种子发芽标志,记录发芽数[11]。计算种子发芽率、发芽势、发芽指数、活力指数、根长、苗长和根长/苗长。
发芽率(%)=(发芽终期正常发芽种子数/供试种子总数)×100%;
发芽势(%)=(发芽第7天发芽种子数/供试种子总数)×100%;
发芽指数=∑Gt/Dt,式中:Gt为第t日的发芽数,Dt为相应的发芽日数;
活力指数=S×GI,式中:S为平均幼苗的长度,GI为种子发芽指数。
根长和苗长测定:种子萌发第20天结束时,在每个处理的4个重复中,每皿随机选取10株苗,测定每株的根长及苗长(外源添加剂处理的羊草种子时,每个处理培养皿未生长10株幼苗的,取全部幼苗测定其根长及苗长),计算其平均值。
1.4 数据的统计与分析
试验所得数据采用SPSS 16.0软件进行方差分析,采用Microsoft Excel 2010软件作图。
2 结果与分析
2.1 不同浓度H2O2对羊草种子萌发及幼苗生长的影响
1 mmol/L、25 mmol/L和50 mmol/L的H2O2处理对羊草种子萌发均有促进作用,可显著提高羊草种子的发芽率、发芽势、发芽指数、活力指数及发芽速率(p<0.05);1 mmol/L、25 mmol/L和50 mmol/L的H2O2处理下,发芽率相较ck分别提高44%、44%和42%;100 mmol/L的H2O2处理的羊草种子的发芽率、发芽势、发芽指数、活力指数均为0;随着H2O2浓度增加,羊草种子的根长逐渐降低,苗长无显著影响,不同浓度H2O2的根长/苗长逐渐降低,由此可知,高浓度的H2O2抑制了根长生长,从而降低了根长/苗长(表1)。

表1 不同浓度的 H2O2 对羊草种子发芽的影响Table 1 The effect of different concentrations of H2O2 on the germination of Leymus chinensis seeds
2.2 不同浓度MV对羊草种子萌发及幼苗生长的影响
由表2可见,0.1 μmol/L与1 μmol/L的MV处理可显著促进羊草种子的发芽率、发芽势、发芽指数、活力指数;与ck相比,0.1 μmol/L与1 μmol/L的MV处理使羊草种子的发芽率提高了44%和47%,但10 μmol/L的MV处理下显著抑制了羊草种子萌发(p<0.05),说明低浓度的MV促进羊草种子萌发,而高浓度的MV抑制了种子萌发;0.1 μmol/L MV处理的根长与ck无显著差异,均显著高于1 μmol/L与10 μmol/L MV处理;0.1 μmol/L与1 μmol/L MV处理下,苗长显著高于ck;ck的根长/苗长显著高于不同浓度的MV处理。

表2 不同浓度的MV对羊草种子发芽的影响Table 2 The effect of different concentrations of MV on the germination of Leymus chinensis seeds
2.3 不同浓度的NAC对羊草种子萌发及幼苗生长的影响
由表3可见,1 mmol/L的NAC处理显著促进羊草种子的发芽率、发芽势、发芽指数、活力指数与发芽速率;与ck相比,1 mmol/L的NAC处理使发芽率提高34%,发芽势提高39%,发芽指数提高约3.8倍,活力指数提高约3.2倍,发芽速率提高约1.2倍,说明低浓度的NAC处理可促进羊草种子萌发;ck显著高于5 mmol/L与10 mmol/L NAC处理的发芽情况,说明5 mmol/L与10 mmol/L的NAC处理明显抑制了羊草种子的萌发;随着NAC浓度增加,根长逐渐降低,ck显著高于1 mmol/L与5 mmol/L的NAC处理下羊草种子的苗长;ck的根长/苗长值最大,显著高于1 mmol/L、5 mmol/L与10 mmol/L NAC处理。
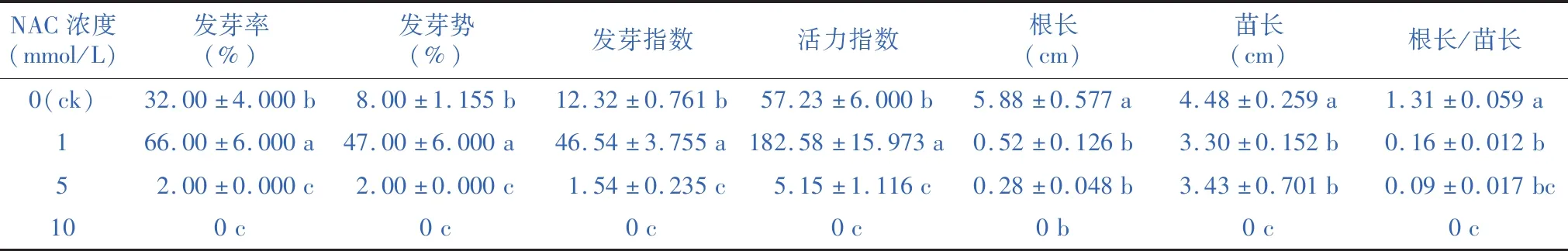
表3 不同浓度的 NAC 对羊草种子发芽的影响Table 3 The effect of different concentrations of NAC on the germination of Leymus chinensis seeds
2.4 不同浓度ABA对羊草种子萌发及幼苗生长的影响
由表4可知,10 μmol/L的ABA处理羊草种子,发芽率、发芽势、发芽指数均与ck无显著差异;10 μmol/L的ABA处理与ck相比,活力指数降低;50 μmol/L与100 μmol/L的ABA处理下的羊草种子发芽率、发芽势、发芽指数及活力指数均显著低于ck,说明高浓度的ABA抑制了羊草种子的萌发;随着ABA浓度增加,根长、苗长及根长/苗长均显著降低。

表4 不同浓度的ABA对羊草种子发芽的影响Table 4 The effect of different concentrations of ABA on the germination of Leymus chinensis seeds
综合上述实验结果,选取50 μmol/L ABA以及5 mmol/L NAC进行后续实验。
2.5 50 μmol/L ABA与不同浓度H2O2交互作用对羊草种子萌发及幼苗生长的影响
由表4,表5可见,羊草种子在50 μmol/L ABA处理的发芽率仅为3%,加入不同浓度H2O2可显著提高ABA处理下的羊草种子发芽率(p<0.05),随着H2O2浓度升高,发芽率呈先升后降的趋势,在1 mmol/L H2O2处理时羊草种子发芽率最高达到76%。羊草种子在50 μmol/L ABA处理的发芽势和发芽指数仅为2.00%和2.71,加入不同浓度H2O2可显著提高ABA处理下的羊草种子发芽势和发芽指数(p<0.05),随着H2O2浓度升高呈先升后降趋势,发芽势和发芽指数在1 mmol/L和25 mmol/L H2O2处理时差异不显著(p>0.05)。加入不同浓度H2O2可显著提高ABA处理下的羊草种子活力指数和苗长(p<0.05),在1 mmol/L H2O2处理时羊草种子活力指数和苗长最高,而根长仅在1 mmol/L H2O2处理时显著提高(p<0.05),其余H2O2处理显著低于未添加(p<0.05)。

表5 50 μmol/L ABA与不同浓度H2O2交互作用对羊草种子发芽参数的影响Table 5 The effect of interaction between 50 μmol/L ABA and different concentrations of H2O2 on the germination parameters of Leymus chinensis seeds
2.6 50 μmol/L ABA与不同浓度MV交互作用对羊草种子萌发及幼苗生长的影响
由表6可知,羊草种子在50 μmol/L ABA处理的发芽率仅为3%,加入不同浓度MV可显著提高羊草种子发芽率(p<0.05),随着MV浓度升高发芽率逐渐下降,在0.1 mmol/L MV处理时羊草种子发芽率最高达到72%。羊草种子在50 μmol/L ABA处理的发芽势和发芽指数仅为2.00%和2.71,加入不同浓度MV可显著提高ABA处理下的羊草种子发芽势和发芽指数(p<0.05),随着MV浓度升高呈先升后降趋势,发芽势和发芽指数在0.1 μmol/L和1 μmol/L MV处理时差异不显著(p>0.05)。加入不同浓度MV可显著提高ABA处理下的羊草种子活力指数和苗长(p<0.05),在1 μmol/L MV处理时羊草种子活力指数和苗长最高,而根长仅在0.1 μmol/L MV处理时显著提高(p<0.05),其余MV处理显著低于未添加(p<0.05)。
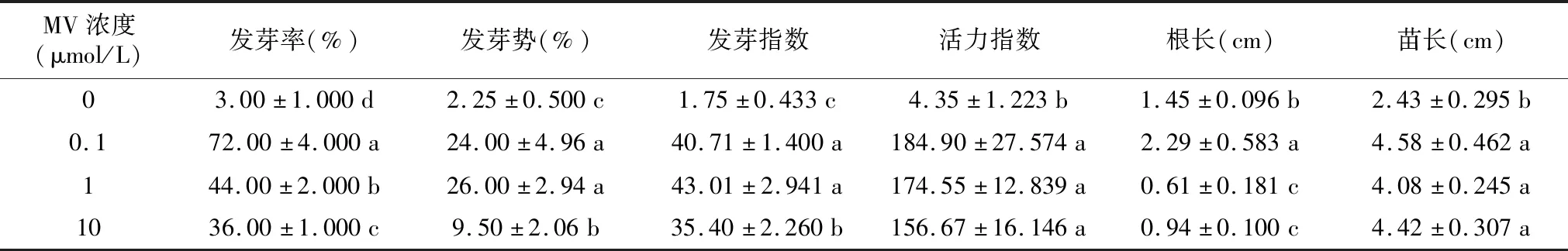
表6 50 μmol/L ABA与不同浓度MV交互作用对羊草种子发芽参数的影响Table 6 The effect of interaction between 50 μmol/L ABA and different concentrations of MV on the germination parameters of Leymus chinensis seeds
2.7 5 mmol/L NAC与不同浓度H2O2交互作用对羊草种子萌发及幼苗生长的影响
由表7可知,羊草种子在5 mmol/L NAC处理的发芽率仅为2%,加入不同浓度H2O2可显著提高NAC处理下的羊草种子发芽率(p<0.05),各浓度H2O2处理间差异不显著(p>0.05)。羊草种子在5 mmol/L NAC处理的发芽势和发芽指数仅为2%和1.54,加入不同浓度H2O2可显著提高NAC处理下的羊草种子发芽势和发芽指数(p<0.05),且各处理间差异不显著(p>0.05)。加入不同浓度H2O2可显著提高NAC处理下的羊草种子活力指数和根长(p<0.05),在1 mmol/L H2O2处理时羊草种子活力指数和根长最高,而苗长仅在1 mmol/L H2O2处理时显著提高(p<0.05),其余H2O2处理与未添加差异不显著(p>0.05)。

表7 5 mmol/L NAC与不同浓度H2O2交互作用对羊草种子发芽参数的影响Table 7 The effect of interaction between 5 mmol/L NAC and different concentrations of H2O2 on the germination parameters of Leymus chinensis seeds
2.8 NAC与MV交互作用对羊草种子萌发及幼苗生长的影响
由表8可知,羊草种子在5 mmol/L NAC处理的发芽率仅为2%,加入不同浓度MV可显著提高NAC处理下的羊草种子发芽率(p<0.05),0.1 μmol/L MV处理显著高于其余浓度处理(p<0.05)。羊草种子在5 mmol/L NAC处理的发芽势、发芽指数和活力指数仅为2%、1.54和5.15,加入不同浓度MV可显著提高NAC处理下的羊草种子发芽势、发芽指数和活力指数(p<0.05),且各处理间差异不显著(p>0.05)。加入不同浓度MV可显著提高NAC处理下的羊草种子根长(p<0.05),在0.1 μmol/L MV处理时羊草种子根长最长,而苗长未添加差异不显著(p>0.05)。

表8 5 mmol/L NAC 与不同浓度 MV 交互作用对羊草种子发芽参数的影响Table 8 The effect of interaction between 5 mmol/L NAC and different concentrations of MV on the germination parameters of Leymus chinensis seeds
3 讨 论
3.1 不同浓度H2O2及MV对羊草种子萌发的影响
本研究中,1 mmol/L、25 mmol/L和50 mmol/L H2O2处理均有利于羊草种子萌发,但随着H2O2浓度的升高羊草种子根长的生长逐渐受到抑制,100 mmol/L时抑制了羊草种子萌发,1 mmol/L H2O2处理作用最显著。有研究表明,使用0.3%的H2O2可显著提高狗尾草种子的萌发率[8]。5%的H2O2可以解除种子休眠,显著促进甜菜种子萌发[9];本研究结果与赵东兴等[12]使用H2O2处理槟榔种子的结果相似,随着H2O2浓度的升高萌发率逐渐升高,但根长生长逐渐减弱,其中4 mg/L的H2O2作用最显著。有研究表明,H2O2解除种子休眠可能与胚乳物质代谢途径——磷酸戊糖途径有关[9];本研究结果可能是因为H2O2具有一定的腐蚀性,较小程度腐蚀了羊草种子的表皮通透性,为种子萌发提供了充足的氧气,从而促进羊草种子萌发;或者在磷酸戊糖途径中提高了某些酶的活性,促进羊草种子胚生长。
MV是H2O2的合成前体,本研究中,0.1 μmol/L与1 μmol/L的MV显著促进羊草种子萌发,但随着MV浓度升高,根长生长减弱,但苗长显著高于ck,10 μmol/L MV完全抑制了羊草种子的生长。Oracz等[13]研究发现,0.1 mmol/L的MV可解除向日葵种子休眠,加快种子萌发;林桂珠等[10]研究发现,5~10 μmol/L的MV处理未吸涨或已萌动的杂交水稻种子1 d后,种子发芽率与ck差异不太,但活力指数和胚根的生长受抑制最明显。本试验结果可能是低浓度的MV促进了羊草种子分解H2O2,从而促进萌发,而10 μmol/L MV可能分解产生的H2O2过多,抑制了羊草种子的活性;或者是由于高浓度的MV使羊草种子胚乳中物质运转或新生芽与根的合成能力的某一环节上出现了障碍而使其难以继续生长存活。
3.2 不同浓度NAC及ABA对羊草种子萌发的影响
NAC具有抗氧化作用,并对植物体内已有的自由基有清理作用[14]。Yushi等[15]在大豆种子研究中发现,抗氧化剂NAC则随着浓度增加对种子萌发起抑制作用。Su等[16]对细枝岩黄芪研究表明,随着NAC浓度增加,发芽率逐渐降低,其中50 mmol/L NAC即可显著抑制冷层积细枝岩黄芪种子的萌发;本研究中,1 mmol/L的NAC可显著促进羊草种子萌发,但5 mmol/L与10 mmol/L NAC显著抑制了羊草种子萌发,原因可能是低浓度的NAC促进了羊草种子萌发时体内某些酶的活性从而促进羊草种子萌发,而高浓度NAC抑制了胚轴尖端H2O2的产生,阻碍羊草种子萌发,NAC对种子萌发的作用机理研究较少,还有待进一步研究。
在许多物种中,ABA是参与种子休眠和萌发的关键激素。崔雪莲,夏超[17]研究表明,外源喷施2.0 mg/L的ABA对醉马草种子的发芽率有显著促进作用,而当浓度增加到4.0 mg/L时表现为明显的抑制作用;张翔等[18]研究表明,低浓度的ABA(10 mg/L)处理水稻种子对其萌发有促进作用,并能有效促进根和芽的伸长生长,高浓度ABA(50~90 mg/L)对种子萌发和根、芽的伸长生长具有明显的抑制作用;本研究中,10 μmol/L ABA未能促进羊草种子萌发,但50 μmol/L ABA即可明显对羊草种子起抑制作用。种子萌发是一个非常复杂的生理过程,种子体内的多种激素互作会引起萌发过程中一系列的生理生化反应,有研究表明,种子萌发过程中,ABA阻止糊粉层中mRNA的合成,抑制赤霉素(GA)所促进的α-淀粉酶的积累,从而抑制β-淀粉酶的活力[19],抑制了种子萌发;另外,ABA会抑制参与种子萌发的水解酶的活性,例如异柠檬酸裂解酶和内甘露聚糖等。本研究结果可能是羊草种子体内ABA含量升高,降低了GA的含量,也可能是由于高浓度的ABA抑制了某些水解酶的活性,阻碍了种子萌发过程中一些重要代谢途径,从而抑制羊草种子萌发。
3.3 H2O2和MV与NAC和ABA的交互作用对羊草种子萌发的影响
不同浓度的H2O2和MV均可缓解5 mmol/L NAC的抑制作用,1 mmol/L H2O2和0.1 μmol/L MV效果最显著。有研究表明,NAC是通过抑制种子胚轴尖端H2O2的产生而抑制发芽的[17],因此,推测本研究结果可能是H2O2和MV补充了由NAC抑制的胚轴尖端H2O2,进而缓解了由其引起的羊草种子低萌发率。
50 μmol/L ABA与不同浓度H2O2和MV的交互作用表明,各浓度H2O2和MV均可缓解其抑制作用,1 mmol/L H2O2和0.1 μmol/L MV效果最佳。有研究表明,外源H2O2处理可促进内源NO的产生,从而促进ABA分解代谢,使ABA含量减少,打破ABA和GA的平衡,从而导致休眠解除,促进发芽[20]。本研究结果可能是外源H2O2和MV减少ABA含量,从而促进萌发。对于ABA抑制种子萌发的研究较多,但外源添加H2O2和MV对ABA的缓解作用较少,而且不同的物种,同一物种的不同基因型,外界环境因素等都存在一定的影响,本研究结果具体原因有待进一步研究。
4 结 论
1 mmol/L、25 mmol/L和50 mmol/L H2O2处理促进羊草种子萌发,100 mmol/L时抑制了羊草种子萌发;0.1 μmol/L与1 μmol/L MV可显著促进羊草种子萌发,10 μmol/L MV抑制其萌发;1 mmol/L NAC促进羊草种子萌发,5 mmol/L和10 mmol/L NAC抑制羊草种子萌发;10 μmol/L ABA对羊草种子萌发无影响,但随着ABA浓度升高,抑制了羊草种子萌发。外源添加不同浓度H2O2和MV均可缓解50 μmol/L ABA及5 mmol/L NAC所引起的发芽率降低问题,1 mmol/L H2O2和0.1 μmol/L MV效果最佳。

