E2-3S在水平流人工湿地中的降解与转化
付晶淼 李 睿 杨 扬 张晓萌 陈善旭 陆慧琳 王雪丽 黄梦娜 王茜琰 戴玉女
(1.暨南大学生态学系, 广州 510632; 2.西安理工大学西北旱区生态水利工程国家重点实验室, 西安 710048; 3.黑龙江省设计集团有限公司, 哈尔滨 150040; 4.暨南大学热带亚热带水生态工程教育部工程研究中心, 广州 510632)
天然雌激素以具有活性的、疏水性自由态(Free estrogens, FEs)或失活的、极性增强的结合态(Conjugated estrogens, CEs)两种形式存在, FEs包括雌酮(Estrone, E1)、雌二醇(17β-Estradiol, E2)和雌三醇(Estriol, E3)等, CEs是FEs中的羟基与硫酸盐或葡萄糖苷酸盐形成酯键产生的, 包括硫酸盐结合态类雌激素(Sulfate conjugated estrogens, S- CEs)和葡糖苷酸盐结合态类雌激素(Glucuronide conjugated estrogens, G-CEs), 如E1-3G, E2-3S等。不同种类雌激素的污染源也不尽相同, 其主要源于哺乳动物的日常排泄、避孕药等药物的使用、制药厂、医院及生活污水的排放。Sim等[1]对韩国内进水来源不同的 11 座污水处理厂进、出水中的E1、17β-E2、17α-E2、E3和EE2五种雌激素进行了监测, 进水主要包括城市污水、畜禽废水、医院污水和制药厂污水, 其中畜禽废水处理厂进水雌激素浓度最高,浓度高达0.195—10.4 μg/L, 其次是城市污水处理厂, 浓度在0.028—1.15 μg/L, 医院污水处理厂的雌激素浓度为0.068—0.130 μg/L, 制药厂中雌激素浓度最低, 在0.015—0.070 μg/L; 畜禽废水处理厂出水中所含雌激素浓度同进水一样都是污水处理厂中最高的, 浓度在0.003—0.729 μg/L。
FEs是一类内分泌干扰活性强的新兴污染物,其在水环境中几ng/L的浓度即可引起雄鱼雌性化[2],生态风险较高, 已被列为优先控制污染物[3]。此外,FEs还可在痕量水平(ng/L)下明显抑制水体和沉积物微生物产甲烷、产二氧化碳的效率及反硝化速率[4—6], 对水环境微生态系统产生危害。CEs是生物体FEs代谢循环中的一类主要产物, 是在生物体内磺基转移酶和葡萄糖苷酸基转移酶的作用下, 由FEs结构上的羟基与硫酸盐或葡萄糖苷酸盐形成酯键而产生的, 种类结构比较复杂, 通常对于单羟基物质如E1, 仅存在单一种类的结合态形式(如葡萄糖苷酸结合态, E1-3G, 或硫酸盐结合态, E1-3S); 而对于多羟基物质如E2等, 则可能出现一个或多个羟基形成不同酯键的情况(如E2可形成E2-3S-17G、E2-3G-17S等)[7,8]。CEs在环境微生物专性酶的作用下可水解转化为干扰活性强的FEs, 从而产生风险。
多年来, FEs的环境效应与环境行为引起了广泛关注, 而CEs由于内分泌干扰活性弱而常常被忽视。已有研究发现, 极性较强的CEs可穿越土层迁移至地下水, 在微生物的水解作用下重新转化为具有活性的自由态, 对水源造成污染[9]; Kumar等[10]指出, E1在原始污水中缓慢转化, 半衰期为9h, 而E2的半衰期仅为2h, 大部分转化为E1。CEs(特别是SCEs, S-CEs的半衰期为5—173h高于G-CEs的1.5—116h[11])甚至比FEs更难降解, 且可在污水处理厂出水中被检出[12]; 据报道, 日本20个污水处理厂进出水均检出多种CEs, 有的浓度高达1000 ng/L[13],国内某污水处理厂养猪场附近6.1—8.0 m深处地下水中的E2-3G浓度高达425 ng/L[9]。而养殖场废水和污水处理系统排水中的CEs很可能是环境介质中FEs持续存留的重要原因。
由于没有考虑CEs向FEs转化的影响, 导致以往的研究中FEs在污水处理系统中的浓度变化规律性差和去除效率波动性大, 有的去除效率高达100%,而有的则为负去除[14], 因此, 综合考虑FEs与CEs在污水处理系统中的行为是全面评估雌激素类物质去除的重要方向。同时, 对CEs的环境行为研究尚处于起步阶段。对污水处理系统的研究以常规污水处理厂为主, 目前已发现G-CEs葡萄糖苷酸酶作用下水解较快, 而由于缺乏相应降解酶(芳基磺酸酶)而导致S-CEs的水解速度较慢[15—18]。国内外已陆续开展污水处理厂对CEs去除的研究[12], 主要停留在表观去除率上, 最近研究表明, 国内某污水处理厂出水中E1、E1-3S、E2-3S检出率为100%, 随着污水处理流程的进行, CEs占总雌激素的比例逐渐增加, 室内抑制试验还发现好氧活性污泥胞外酶葡萄糖苷酸酶和芳基磺酸酶分别是E1-3G和E1-3S水解的唯一因素, 胞内其他酶负责后续FEs降解[8]。以往研究通常认为, 被去除的CEs均转化为FEs[12],但近年有研究发现, 由E2代谢产生的E1可在土壤微生物的作用下转化为E1-3S, 这使得FEs与CEs间的转化关系可能比过去的认识更为复杂[16]。
人工湿地(CWs)是生活污水处理的生态解决方案, 但是关于CWs去除雌激素的研究较少[19,20], 同时考虑FEs与CEs的研究十分匮乏。本文研究团队前期系统开展了FEs在CWs中的去除效果研究, 也发现了CEs对FEs去除效率的潜在影响, 有必要进一步开展CEs在CWs中的降解规律研究[21]。基于CWs相对复杂与丰富的内环境, 已发现其对E2的降解途径具有多样性[22], 因此, CEs在CWs中的降解转化途径可能与活性污泥系统不同, 与溶解氧条件有关, 好氧活性污泥系统中E1-3S是E2-3S的主要转化产物[10], 而缺氧的水平流CWs中生成量较少。若经证实E1-3S、E2-3S和E2-3,17S等较难水解的CEs在污水处理系统中可以不经水解而直接被降解, 则可能为CEs提出一条新的归趋途径[23]。
因此, 本研究选择由活性最强的E2所形成的常见E2-3S为目标物, 研究其在有/无种植植物水平流人工湿地(Horizontal flow constructed wetlands,HFCWs)中的沿程降解规律, 同时监测15种雌激素:E1、E2、αE2、E3、E1-3G、E2-3G、E2-17G、E3-3G、E1-3S、E2-3S、αE2-3S、E3-3S、E2-3,17S、E2-3S,17G和E2-3G,17S的变化, 包括鲜少关注的雌激素对映体及双位取代CEs, 为综合评估E2-3S在HFCWs中与其他雌激素形态间的转化途径提供新认识。
1 材料与方法
1.1 试剂、材料及设备
本研究选择了15种雌激素为监测目标物, 根据分子结构和性质分成四类: (1)FEs: 包括Estrone(E1)、17β-estradiol(E2)、17α-estradiol(αE2)和17βestriol(E3); (2)G-CEs: Estrone-3-glucuronide(E1-3G)、17β-estradiol-3-glucuronide(E2-3G)、17β-estradiol-17-glucuronide(E2-17G)和Estriol-3-glucuronide(E3-3G); (3)S-CEs: Estrone-3-sulfate(E1-3S)、17β-estradiol-3-sulfate(E2-3S)、17α-estradiol-3-sulfate(αE2-3S)和Estriol-3-sulfate(E3-3S); (4)D-CEs:Estradiol-3,17-sulfate (E2-3,17S )、Estradiol-3-sulfate,-17-glucuronide(E2-3S,17G)和Estradiol-3-glucuronide,-17-sulfate(E2-3G,17S); 雌激素标准品和6种同位素内标物标准品来源与信息见表1, 购自CDN ISOTopes试剂公司(加拿大)、TRC试剂公司(加拿大)、Dr.Ehrenstorfer试剂公司(德国)和Sigma试剂公司(美国), 纯度>97%。
玻璃器皿使用前经过重铬酸钾/硫酸洗液洗涤,自来水冲洗, 蒸馏水冲洗, 并烘干后置于马弗炉(450℃)中焙烧4h。过滤水样的滤膜为Whatman GF/F(直径47 mm, 0.7 μm孔径), 过滤浓缩后样品的滤膜均为玻璃纤维滤膜(直径13 mm, 0.22 μm孔径)。固相萃取柱选用美国Waters公司的Oasis HLB小柱(500 mg, 6 mL)。所需溶剂均为色谱纯(德国默克公司)。试验用水均为Milli-Q 超纯水。
标准品均用甲醇配成标准溶液, 并配制浓度为100 mg/L的混合标准溶液, 于-20℃冰箱中保存。
主要仪器包括高效液相色谱质谱联用仪购自美国 AB SCIEX 公司(UPLC-MS/MS, ABI 5500), 氮吹仪(上海安谱), 涡旋器(海门其林贝尔), 冷冻干燥机(杭州富睿捷)。
1.2 实验设计
2017年11月, 于暨南大学校园内, 构建2个HFCWs装置: (1)无植物湿地(U-CW)与(2)种植植物湿地(P-CW)。装置材料为有机玻璃, 装置尺寸120 cm(长)×15 cm(宽)×65 cm(高), 外侧遮光(图1)。装置内填充粒径0.5 cm石英砂60 cm厚, 运行水位55 cm。分别在装置水平距离0、20、60、100和120 cm, 以及装置垂直深度20、40和60 cm处设置15个采样口(湿地基质高度低于装置高度5 cm, 因此取水口位置分别对应基质的15、35和55 cm), 用于采集湿地沿程不同空间位置出水。植物选择黄菖蒲幼苗, 每个装置均匀种植15株。湿地进水为真实生活污水[TN为(24.48±1.97) mg/L, TP为(2.63±0.20) mg/L,DO为0.49 mg/L, pH为7.255, EC为665 mS/cm], 向污水中添加E2-3S标准溶液以使进水理论浓度为2000 ng/L(浓度为5.34 nmol/L), 每个装置进水量为15 L/d, 水力负荷为0.1 m/d, 采用微量蠕动泵进行连续进水, 理论水力停留时间为1.5d。

图1 水平流人工湿地装置结构图Fig.1 Schematic design characteristics of horizontal flow constructed wetlands
2017年11月至2018年6月采用未添加E2-3S的生活污水培育湿地系统, 植物生长良好, 根须可达装置深层。2018年7月开始添加目标物E2-3S, 1个月后开始样品采集, 考察雌激素E2-3S及其产物在有无植物HFCWs不同位点中的空间分布情况。
1.3 样品采集与提取
分别采集进水及装置15个出水口水样10 mL,用GF/F滤头过滤, 收集于50 mL离心管中, 同时采用YSI监测物理指标(温度、pH、电导率、DO)。样品共采集6次, 间隔1周采1次, 采集原生活污水0.5 L,每次采集平行双样, 每升水样加入1 mL 4.0 mol/L的浓硫酸进行酸化, 以抑制细菌活性。经47 mm、0.7 μm GF/F滤膜过滤; 后加入50 mL甲醇(使甲醇含量为5%), 0.5 g 金属螯合剂Na2-EDTA, 摇匀使盐溶解; 加入100 μL 1 ppm内标, 最终定容于1 mL。采用固相萃取法提取, 提取方法根据文献报道微调[17],依次用2次×5 mL甲醇和2次×5 mL超纯水活化500 mg HLB小柱, 水样以10 mL/min的速度上柱, 最后用50 mL含5%甲醇的超纯水洗涤样品瓶2次。然后用5%甲醇+2%乙酸, 5%甲醇+2%氨水, 5%甲醇水溶液分别10 mL依次淋洗。以2次×4 mL二氯甲烷(DCM)∶甲醇(MEOH)=1∶1的溶液洗脱, 收集于15 mL玻璃管中。洗脱液于温和N2下吹至近干, 用1 mL甲醇复溶, 涡旋60s。经0.22 μm玻璃纤维滤器过滤, 转移至含0.25 mL内插管的2 mL棕色样品瓶中, 保存于-18℃冰箱待测。
1.4 分析检测方法
利用超高效液相色谱质谱联用仪(UPLCMS/MS)对15种雌激素进行检测, 仪器模式为负离子模式[ESI(-)], 选择多反应监测模式(MRM)进行分析, 具体方法参考文献[17]报道, 物质的质谱仪器参数详见表1。液相方法中色谱柱选用Waters BEH-C18 (100 mm×2.1 mm, 1.7 μm, Waters); 流动相为含1‰(v/v)色谱纯氨水的Milli-Q水(A)和含1‰(v/v)色谱纯氨水的含1‰(v/v)色谱纯氨水的甲醇、水、乙腈混合溶液(体积比1∶1∶8); 分析柱温为35℃, 进样量5 μL; 流动相流速0.2 mL/min, 洗脱程序梯度为(时间 min, B%): (0, 10), (5, 40), (5.1, 50),(8, 50), (10, 60), (10.01, 100), (12,100)。采用内标法进行定量, 方法检测限(LOD)和定量限(LOQ)分别采用信噪比的3倍和10倍计算。该方法所有物质回收率在87%—106%, 仪器LOQ在0.005—0.2 μg/L。
1.5 数据分析及可视化作图方法
试验数据采用SPSS 22 进行显著性分析, 采用Origin 2022 绘制相应数据图。两个统计变量的相关性评价采用 Spearman 相关分析。P<0.05 认为差异具有统计学意义(P<0.05 记作*,P<0.01 记作**)。
2 结果与讨论
2.1 进水水质
生活污水背景中分别检出E1、E3、E2-17G、E1-3S、E2-3S和E3-3S六种雌激素, 浓度为0.81—168.33 ng/L。如图2所示, 以E3为主, 约占生活污水中雌激素总量的72%; 其次为E1, 占雌激素总量的19%, 少量S-CEs被检出, 浓度仅为0.002—0.058 nmol/L。向生活污水中添加2000 ng/L(5.34 nmol/L)的目标物E2-3S后, 水中除了可检出上述6种雌激素, 还可检出3种D-CEs(E2-3-17S, E2-3S-17G, E2-3G-17S)。这说明湿地进水中E2-3S已开始发生降解与转化(总雌激素浓度为6.84 nmol/L), 扣除背景浓度后, 可观察到E2-3S最先依次可产生E2(2.12 nmol/L)、E1(1.21 nmol/L)、E3(0.78 nmol/L)、E1-3S(0.21 nmol/L)、E3-3S(0.08 nmol/L)及痕量DCEs(浓度0.18 nmol/L), 说明在进水低氧条件下(DO=0.49 mg/L), E2-3S更容易通过水解释放E2, 仅少量通过氧化形成E1-3S。生活污水E2-3S背景浓度(0.002 nmol/L)远低于试验浓度, 不会对E2-3S在湿地系统中的降解转化产生干扰。

图2 生活污水背景浓度及人工湿地进水浓度Fig.2 The concentrations of background of domestic sewage and influent of CWs
2.2 E2-3S的消减
E2-3S在U-CW和P-CW中初始浓度相同, 沿程浓度变化见图3。可以看出, E2-3S进入HFCWs后,水平距离0基质垂直深度15 cm的采样点转化率已经高达98%以上, 两组湿地对E2-3S的消减无显著差异(P>0.05)。U-CW中E2-3S浓度沿进水端到出水端的水平距离逐渐降低, 垂直上由上至下逐渐降低;P-CW中E2-3S浓度在水平距离距进水口约40 cm位置处达到最低值。
2.3 代谢物的降解与转化
E2-3S在湿地中可转化为E1、E3和D-CEs, 这些产物在湿地中的空间分布如图3所示。代谢物在两个系统均可发生不同程度的代谢降解, 其中E1和E3为主要代谢产物, D-CE次之。不同位点各类雌激素浓度差异较大, P-CW整体去除速率明显快于U-CW, 进水总雌激素浓度(6.84±1.54) nmol/L, PCW出水雌激素产物浓度(0.95±0.20) nmol/L, 去除率达86%, 而U-CW浓度(2.88±1.34) nmol/L, 去除率仅为58%。其上部位点累积浓度均低于中下部位点浓度, 上部位点的雌激素降解速率相对较快, PCW中的趋势更为明显, 低浓度区域分布更深; 沿着水平距离的增加, 代谢物得到进一步降解, 后部位点的累积浓度逐级低于前部位点。
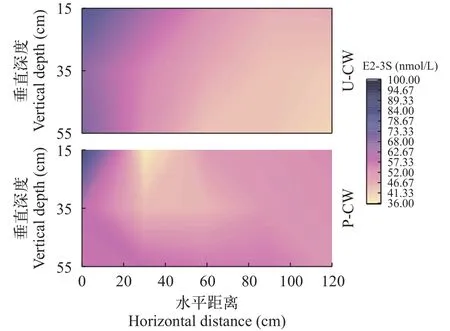
图3 E2-3S的空间消减Fig.3 The space reduction of E2-3S
可见HFCWs中植物对雌激素的转化与降解有重要影响, 据报道, 湿地植物的直接影响主要发生在根际区域[24], 部分雌激素可能会被植物根系吸收,进入植物体内, 发生一系列的迁移和降解过程。另一方面, 植物根系具有较大的比表面积和有根系泌氧功能, 不仅为根际微生物提供了良好的生境, 而且大大提高了该地区微生物的丰富度和多样性[25],因此, 相比U-CWs, P-CWs具有更好的性能。
15个位点中浓度占比最高的均为E1, 均占70%以上, 呈现先增长后降低的趋势(图4), P-CW最终出水E1浓度0.7 nmol/L显著低于进水浓度(1.21 nmol/L), 而U-CW中形成E1的积累, 出水浓度远高于进水浓度, 达2.45 nmol/L, 植物的存在会对E1降解产生促进作用。系统进水中E2、E3浓度占比较高, 进入湿地系统后所有位点均未检出E2, E3在P-CW的C8位点之后也未检出, 说明二者在湿地环境中极易被转化分解。4种G-CEs包括进出水在内的所有位点均未被检出, 说明E2-3S不会向4种G-CEs转化。在2个系统的15个位点中均检出3种D-CEs, P-CW呈现出下部位点浓度高于上部位点, 且U-CW的D-CEs浓度普遍高于P-CW, 说明植物会抑制D-CEs的产生或者有利于其降解(图5)。
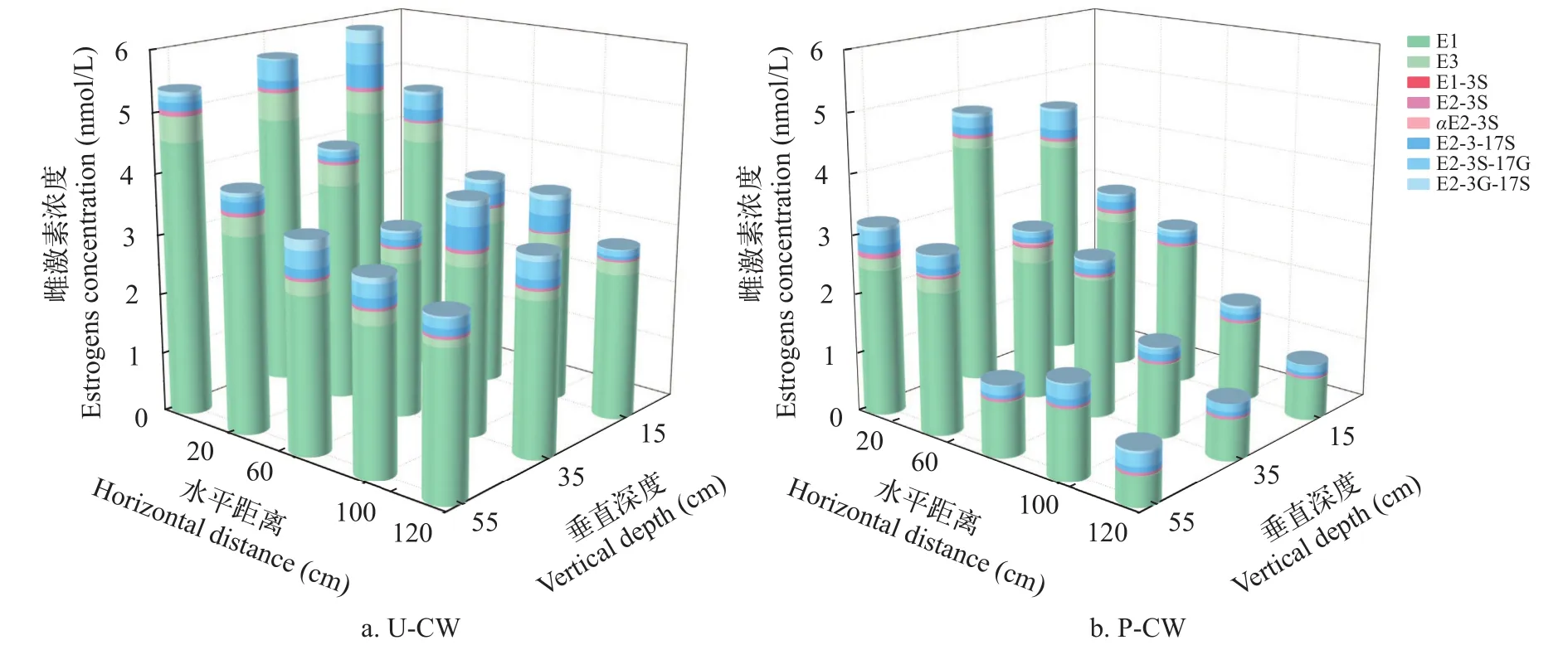
图4 水平流人工湿地不同位点雌激素累积浓度Fig.4 Cumulative concentration of estrogen at different sites in HFCWs

图5 主要代谢物降解与转化热图(a.E1; b.E3; c.D-CEs)Fig.5 Generation and elimination diagram of major metabolite
通过各位点E1浓度的对比, 可见P-CW对E1有明显的降解作用, 主要媒介可能是根系分泌物。有研究发现根系分泌物浓度越高可以提高E1的生物降解作用[26]。根际释放的根系分泌物可为根际微生物提供生长碳源, 从而提高微生物活性, 驯化出相应的微生物种群, 并诱导产生相应的降解酶, 以此来降解雌激素[27]。
2.4 雌激素与环境因子的关系
试验中同时检测了两组湿地系统中不同位点环境因子(DO、pH、EC)变化特征(图6)。其中, PCW中的DO(0.48—1.15 mg/L)明显高于U-CW(0.39—0.88 mg/L), 且DO呈现后部位点高于前部位点, 尤其是表层位点, 主要是由于湿地前端污水中有机物大量降解使得溶氧快速消耗[28], 沿着水平迁移至后部出水端污染物减少, 耗氧量降低, 水体溶解氧也逐渐上升。总体来说, 水体呈现中性偏碱的环境,U-CW从C1到C15位点沿着水平距离、垂直深度的增加pH均略有增加, 但整体变化波动不明显; PCW垂直方向趋势与之相同, 但不同的是随着水平距离增加pH逐渐减小, C3点pH为最高值。电导率基本呈现由进水到出水的水平沿程依次递减的趋势, 主要是由于大量的营养元素被消耗, 各类污染物质也逐渐被去除, 水质得到了净化。P-CW电导率低于U-CW, 表明P-CW出水水质相对更好。

图6 水平流人工湿地不同位点环境因子变化(a.DO; b.pH; c.EC)Fig.6 Dynamic change of environmental factors at different sites in HFCWs
将各位点的降解转化产物浓度与环境因子作相关性分析(图7), 可见, U-CW的环境因素对两种主要产物E1和E3均有显著性影响, 其中EC与两种产物呈显著正相关关系(P<0.001), DO和pH均与其呈显著负相关关系(P<0.01), 在U-CW中雌激素的降解转化主要受环境影响。P-CW与环境因素相关性减弱, 依然表现出DO与大多数产物呈负相关, EC与其呈正相关。pH主要是受植物的影响, 上部植物根系分泌物产酸及呼吸代谢作用会向水中释放CO2,且植物根系泌氧通常有利于硝化反应发生, 从而引起根际酸碱度的变化[29], 使pH降低, 因此pH呈现出与DO相反的趋势。

图7 E2-3S转化产物与环境因子的相关性Fig.7 Correlation between transformation products of E2-3S and environmental factors
从两个湿地的DO变化可见, P-CW中植物根系泌氧有助于形成根区有氧区域和远根区缺氧区域的共同存在[30], 为好氧、兼性厌氧和厌氧微生物提供了适宜小生境[31], 有利于FEs好氧降解[21], 因此根际充足的氧化环境为降解雌激素提供更多的途径。
2.5 转化路径
试验添加的E2-3S在进水中已经开始发生转化,如图8所示各转化产物所占比例, 仅剩32%的E2-3S未发生转化, 最先形成的主要产物为E1、E2、E3和E1-3S。根据各雌激素形态浓度变化(图1和图3)进行分析发现: 只在进水样品中检测到高浓度的E2和少量E1-3S, 与活性污泥系统中[10]E2-3S主要降解产物是E1-3S、E1和E2不同, HFCWs系统所有位点出水样品中均未检测到E2及E1-3S。进入HFCWs后, 在基质垂直深度15 cm处, E2-3S和E3浓度持续降低, 而E1在初始位点(c1-c3)浓度升高, 是由于在HFCWs中同时存在产生与降解, 初始位点E2-3S及其转化产物不断向E1转化, 生成速率大于降解速率导致E1浓度升高, 随着水流迁移, E1浓度开始降低,雌激素总累积浓度也持续降低, 说明中后部位点主要为降解过程。P-CW的c4、c5位点出现少量αE2-3S, 是E2-3S的对映异构体, 且继c4点出现αE2-3S后仅c5位点出现了E1-3S, 也说明E1-3S也是αE2-3S的转化产物, 此为有无植物两湿地系统中的转化途径的主要差异, 而各途径贡献无显著差异。

图8 E2-3S转化路径Fig.8 The transformation path of E2-3S
已有研究发现CEs在环境中优先被微生物水解为FEs[32], 再进一步发生降解。αE2-3S在厌氧的养殖废水中更容易发生水解解离而形成FEs[33], 而在好氧条件下更容易直接氧化为E1-3S[34]。生活污水由于有机物浓度高一般呈现缺氧的状态, 因此进水中产物E2浓度远高于产物E1-3S。而遵循典型的醇氧化为酮反应, E2较易氧化形成E1[35], 故E2-3S去共轭为E2后被迅速转化为E1, 团队前期研究已发现E2非常易于转化为E1[21]。类似地, E1-3S在缺氧环境中也易于发生硫酯键断裂解离出E1, 所以进水中E1浓度较高。Zhang等[34]证明E1是E2和E1-3S的共同代谢产物, 是一种二次降解产物。此外, 据报道E2-3S会发生羟基化和酮化[18], E2-3S羟基化转化为E3-3S, 但E3-3S在进水只有少量检出, 这主要由于E3-3S会进一步断裂共轭硫酯键形成E3, 因此进水中有大量的E3检出。本研究首次观察到E2-3S可形成痕量D-CEs, 取代位点为C-3和C-17位置[36], 且其形成可能与厌氧缺氧环境有关。基于以上分析, 图8描述出了E2-3S的转化途径, 可见E2-3S最终的转化产物主要为E1, E1继而发生进一步降解代谢。
3 结论
本研究中探讨了有无植物两个HFCWs对E2-3S转化途径及行为规律的影响, 得到如下结论:(1)HFCW对E2-3S降解效率高达99%, 有无植物没有显著影响, 然而, E2-3S可转化为其他雌激素产物,结合目标物与产物的共同去除, P-CW对雌激素整体去除率为86%, 显著高于U-CW(58%)。(2)E2-3S可转化为E1、E3和D-CEs, 其中占比最高的产物为E1, 达70%以上, E3次之, P-CW中发现痕量E2-3S的对映体αE2-3S; 植物提高了湿地DO水平, 有利于FEs好氧降解。(3)E2-3S的主要转化路为经硫酯键断裂形成E2再氧化生成E1, 其次路径为直接氧化为E1-3S再水解生成E1, 再次路径为羟基化形成E3-3S再水解生成E3再生成E1, 此外, 首次发现E2-3S还可以产生痕量双位取代D-CEs(<总雌激素的5%), 且植物系统中存留量更低。

