黄原胶寡糖的酶法制备及其性能
谷 金 芸, 李 宪 臻, 杨 帆
(大连工业大学 生物工程学院, 辽宁 大连 116034 )
0 引 言
黄原胶寡糖是一种新型功能性寡糖,具有抗氧化[1]、清除自由基[2]、DPPH清除和抑菌等生理活性,在商业上具有潜在的应用价值。例如,作为益生元应用于保健品改善人的胃肠功能、增强免疫力,作为农用制剂促使植物自身免疫达到抑制病原菌的功效[3]。
目前黄原胶寡糖主要通过化学法进行制备,利用酸、碱、过氧化氢等[4]随机作用于黄原胶糖苷键并使其发生断裂,但该作用过程为非特异性切割,且有副产物多、环境不友好、产量低等缺点。这些问题是制约黄原胶寡糖商业化生产的主要原因。酶法降解技术成为实现社会可持续发展的重要突破口,但是至今为止采用酶法降解黄原胶制备寡糖的相关研究仍然十分匮乏,因此需要开发高效的黄原胶降解酶系,从而达到黄原胶寡糖工业化生产的目的。
大肠杆菌是自然界中广泛存在的细菌,也是常用的基因工程菌。基因注释信息证实大肠杆菌细胞内含有大量的内源性糖苷水解酶[5],这其中可能包括潜在的黄原胶酶,因此本实验拟利用大肠杆菌的粗酶液水解黄原胶,并对其水解条件进行优化,最终对获得的寡糖产品进行表征,以期为功能性黄原胶寡糖的工业化制备打下了基础。
1 材料与方法
1.1 材料与仪器
EscherichiacoliBL21(DE3),获赠于大连化学物理研究所赵宗保研究员课题组。
LB液体培养基:胰蛋白胨10.0 g/L,酵母提取物5.0 g/L,氯化钠10.0 g/L;LB固体培养基:琼脂粉15.0 g/L,其余同LB液体培养基;黄原胶,美国Spectrum Chemical有限公司。
Constant Systems高压破碎仪,英国Constant Systems有限公司;TECAN酶标仪,瑞士TECAN公司;ICS-5000离子色谱,美国Thermo Fisher Scientific公司;凝胶渗透色谱1260,安捷伦科技有限公司;ImageQuant LAS400凝胶成像分析系统,美国GE healthcare公司。
1.2 方 法
1.2.1 菌体培养及胞内酶液提取
大肠杆菌BL21(DE3)是的大肠杆菌表达菌株,其中T7噬菌体RNA聚合酶基因的表达受控于λ噬菌体DE3区的lacUV5启动子,该区整合于BL21的染色体上。将60%甘油保存的大肠杆菌BL21(DE3)从冻管中取出少许划线于LB固体培养基上37 ℃培养16 h,挑取BL21(DE3)单菌落接种至LB液体培养基中37 ℃培养12 h。种子液1∶50转接于500 mL LB培养基,37 ℃、200 r/min培养OD600至0.6;发酵液于16 ℃培养20 h;8 000g离心3 min收集菌体,40 mL磷酸盐缓冲液重悬菌体。采用高压匀浆仪进行细胞破碎,预先打开冷却循环系统冷却样品,设定高压匀浆仪压力207~241 MPa,重复破碎菌体3次。
粗酶样品采用SDS-PAGE进行分析,通过考马斯亮蓝G-250染色。蛋白质浓度测定采用Bradford法[6]测定,得到的蛋白样品采用真空冷冻干燥仪进行冻干保存。
1.2.2 胞内酶液的酶活测定
内切酶活力测定:100 μL酶液与100 μL 0.2%黄原胶混匀,40 ℃反应20 min,冰浴10 min终止反应,在酶反应体系中加入等体积的冰冷聚氰基丙烯酸正丁酯BCA溶液,75 ℃反应30 min,测定OD562。以灭活的酶液作为阴性对照[7]。内切酶活力单位定义:每分钟释放1 μmol/L葡萄糖当量所需的酶量为1 U。
裂解酶活力测定:100 μL酶液与100 μL 0.1%黄原胶混匀,40 ℃反应120 min,煮沸10 min 终止反应,测定OD235。以灭活的酶液作为阴性对照。裂解酶活力单位定义:每分钟OD235增大1.0所需的酶量为1 U。
1.2.3 胞内酶液降解黄原胶反应条件的优化
最适酶解条件采用正交试验的方法[8],分别选取酶质量浓度0.5、1.0、1.5、2.0、2.5 mg/mL;黄原胶底物质量浓度2、4、6、8、10 mg/mL;温度梯度30、35、40、45、50 ℃;酶液缓冲液体系的pH为6.0、6.5、7.0、7.5、8.0;反应时间为30、60、90、120、150 s。
按照表1条件进行酶解反应,煮沸10 min终止反应,10 000g离心10 min取上清,加入等体积冰冷的聚氰基丙烯酸正丁酯BCA溶液,75 ℃反应30 min,测定OD562,计算产物DE。
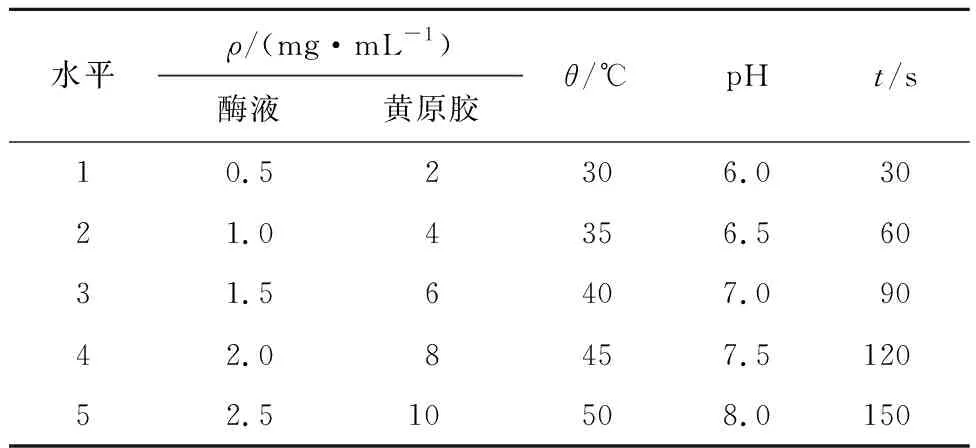
表1 正交试验的因素和水平Tab.1 Factors and levels of the orthogonal experiment
1.2.4 胞内酶液降解黄原胶制备黄原胶寡糖
100 mg黄原胶干粉,溶于50 mL 20 mmol/L pH 8.0的K2HPO4-KH2PO4的缓冲液。称取1 g 蛋白干粉充分溶解在黄原胶底物中,40 ℃反应24 h,煮沸10 min终止反应,10 000g离心10 min 取上清。选取截留量为3.5 ku的透析袋,透析除盐14 h,10 000g离心10 min取上清,液氮速冻后冷冻干燥得到黄原胶寡糖干粉。
1.2.5 黄原胶寡糖DE值的测定
DE代表葡萄糖当量,是指在反应体系中将还原性的糖全部当作葡萄糖来计算其占干物质的百分比。反应结束后计算体系中还原糖质量和反应起始黄原胶干重,求得黄原胶寡糖的DE[9]。
DE=m/m0×100%
式中:m为还原糖的质量,mg;m0为反应起始黄原胶的干重,mg。
1.2.6 黄原胶寡糖的凝胶渗透色谱分析
使用Agilent 1260 Infinity系统,色谱柱采用三柱串联(PL aquagel-OH 60,PL aquagel-OH MIXED-M和PL aquagel-OH 30分离柱)。柱温设定为40 ℃,样品为20 μL 1 g/L黄原胶寡糖,0.1 mol/L NaNO3洗脱,体积流量0.8 mL/min。采用示差折光检测,采用普鲁兰糖作为分子质量标准品。用各组分的积分折射率(RI)峰面积除以18~33 min测得的总RI峰面积,计算相对分子质量分布[10]。
1.2.7 黄原胶寡糖的离子色谱分析
使用ICS-5000系统,色谱柱为阴离子交换保护柱Carbo Pac PA100 (Guard,50 mm×4 mm,Dionex)和阴离子交换分析柱Carbo Pac PA100 (Analytical,250 mm×4 mm,Dionex)。柱温设定为30 ℃,样品(25 μL,1 g/L)由流动相200 mmol/L NaOH和1 mol/L NaAc梯度洗脱,体积流量为1 mL/min。确定产物中黄原胶寡糖组分。
1.2.8 黄原胶寡糖的DPPH自由基清除活性测定
实验组将500 μL 1.0~5.0 mg/mL的寡糖样品与500 μL 0.1 mmol/L DPPH混匀;空白组将500 μL水与500 μL乙醇混匀,33 ℃避光反应30 min,静置冷却至室温;对照组将500 μL黄原胶寡糖溶液与500 μL乙醇混匀,在517 nm测定吸光度。
清除率=(1-(Ai-Aj)/A0)×100%
式中:Ai、Aj、A0分别为实验组、对照组、空白组的吸光度。
1.2.9 黄原胶寡糖的羟基自由基清除活性测定
实验组加入500 μL 0.2 mol/L pH 7.5磷酸盐缓冲液、100 μL 0.52 mg/mL番红、500 μL 2 mmol/L 的EDTANa2-Fe2+和500 μL不同质量浓度(0.5~4.0 mg/mL)的寡糖样品,用水定容至4.9 mL,加入100 μL 1% H2O2混匀,40 ℃反应30 min,在517 nm处测定吸光度;空白组以等体积的水代替黄原胶寡糖溶液;对照组等体积的水代替黄原胶寡糖溶液和EDTANa2-Fe2+溶液。
清除率=(A′i-A′0)/(A′j-A′0)×100%
式中:A′i、A′j、A′0分别为实验组、对照组、空白组的吸光度。
1.2.10 黄原胶寡糖的还原力测定
实验组加入400 μL不同质量浓度(1.0~5.0 mg/mL)的寡糖样品、500 μL 0.2 mol/L pH 6.6磷酸盐缓冲液和500 μL 1%铁氰化钾,50 ℃反应20 min,用水定容至4.9 mL,加入0.1 mL 1%过氧化氢溶液混匀,40 ℃反应30 min,冰浴10 min冷却,加入500 μL三氯乙酸,3 000g离心10 min,取400 μL上清加入500 μL水和100 μL 0.1%三氯化铁溶液,静置10 min,在700 nm处测定吸光度。吸光度增大表明还原能力增强。
1.2.11 黄原胶寡糖的过氧化氢的清除活性测定
实验组500 μL过氧化氢溶液(0.1 mol/L)与500 μL 1.0~5.0 mg/mL的寡糖样品混匀,33 ℃反应30 min,测定230 nm处的吸光度;空白组以等体积的水代替黄原胶寡糖溶液和过氧化氢溶液;对照组以等体积的水代替黄原胶寡糖溶液。清除率按照DPPH清除率进行计算。
2 结果与讨论
2.1 酶学性质分析
从图1可以看出,胞内总蛋白分子质量分布在14.3~200.0 ku。经Bradford法检测胞内酶液质量浓度为12.02 mg/mL。黄原胶内切酶、裂解酶的比活力测定结果如表2所示,分别为(104.00±1.36)U/g、(1.28±0.62)U/mg,据文献报道微杆菌XT11中黄原胶内切酶MiXen酶活力为(15.70±0.98)U/g[11],芽孢杆菌GL1中黄原胶裂解酶酶活力为0.13 U/mg[12]。胞内酶液的内切酶、裂解酶的比酶活力分别为文献报道中的6.6倍和9.8倍。
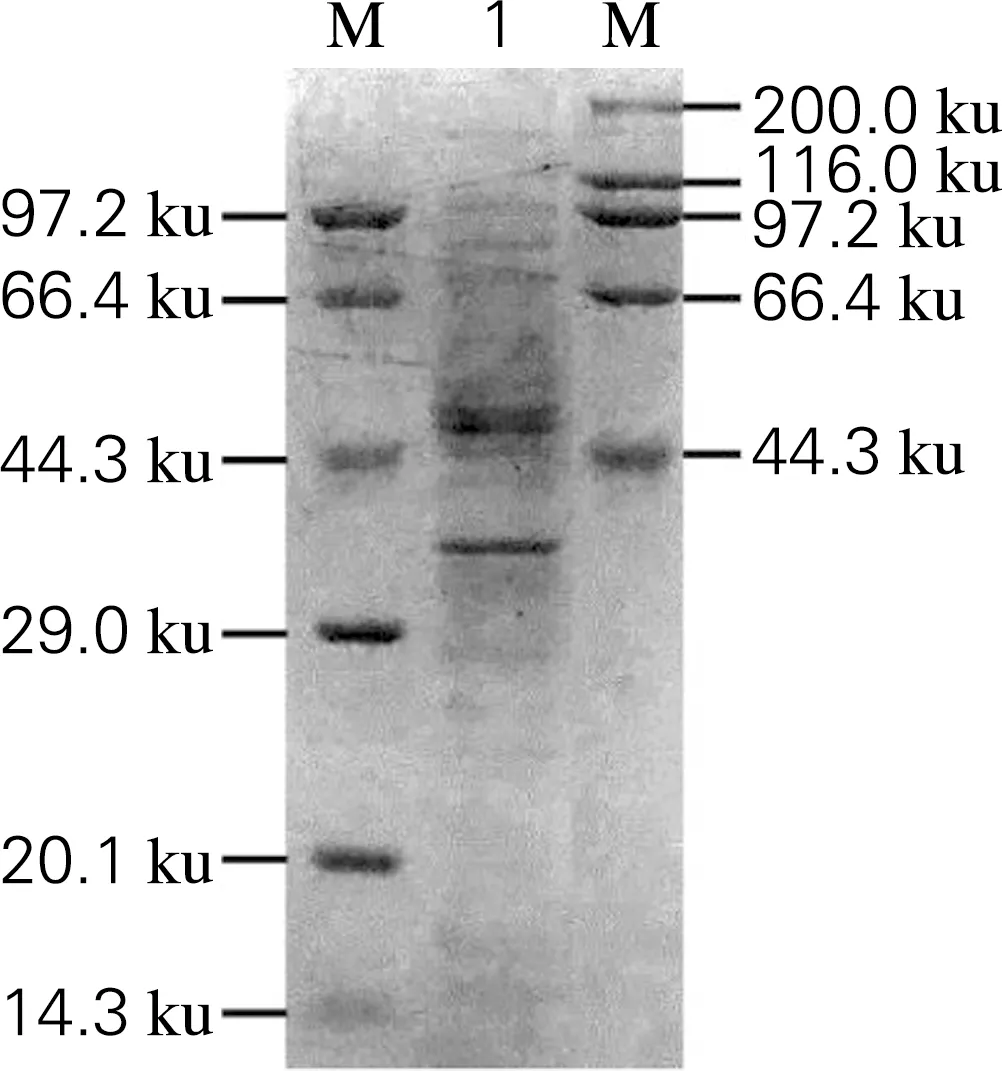
1,胞内酶液;M,蛋白marker图1 大肠杆菌BL21(DE3)胞内酶液的 SDS-PAGEFig.1 SDS-PAGE analysis of intracellular enzyme solution of BL21(DE3)
2.2 降解黄原胶的条件优化分析
通过正交试验的方法进行黄原胶水解的最适酶解反应条件分析,如表2所示。胞内酶液的质量浓度为1.0~2.5 mg/mL时具有较高DE,当酶质量浓度小于1.0 mg/mL时,DE急剧下降。黄原胶底物的质量浓度为2.0 mg/mL时具有较高的DE,随着反应体系中黄原胶底物质量浓度的升高,DE降低。胞内酶液与黄原胶底物在45 ℃ 反应时显示出了最高DE,当酶反应温度低于45 ℃或高于45 ℃时,DE均有降低。胞内酶液与黄原胶底物在pH 6.0~8.0的缓冲液中DE逐渐上升,因此该酶解体系的最适反应pH为8.0。当胞内酶液降解黄原胶反应120 s时DE最高,该反应的最佳反应时长为120 s。
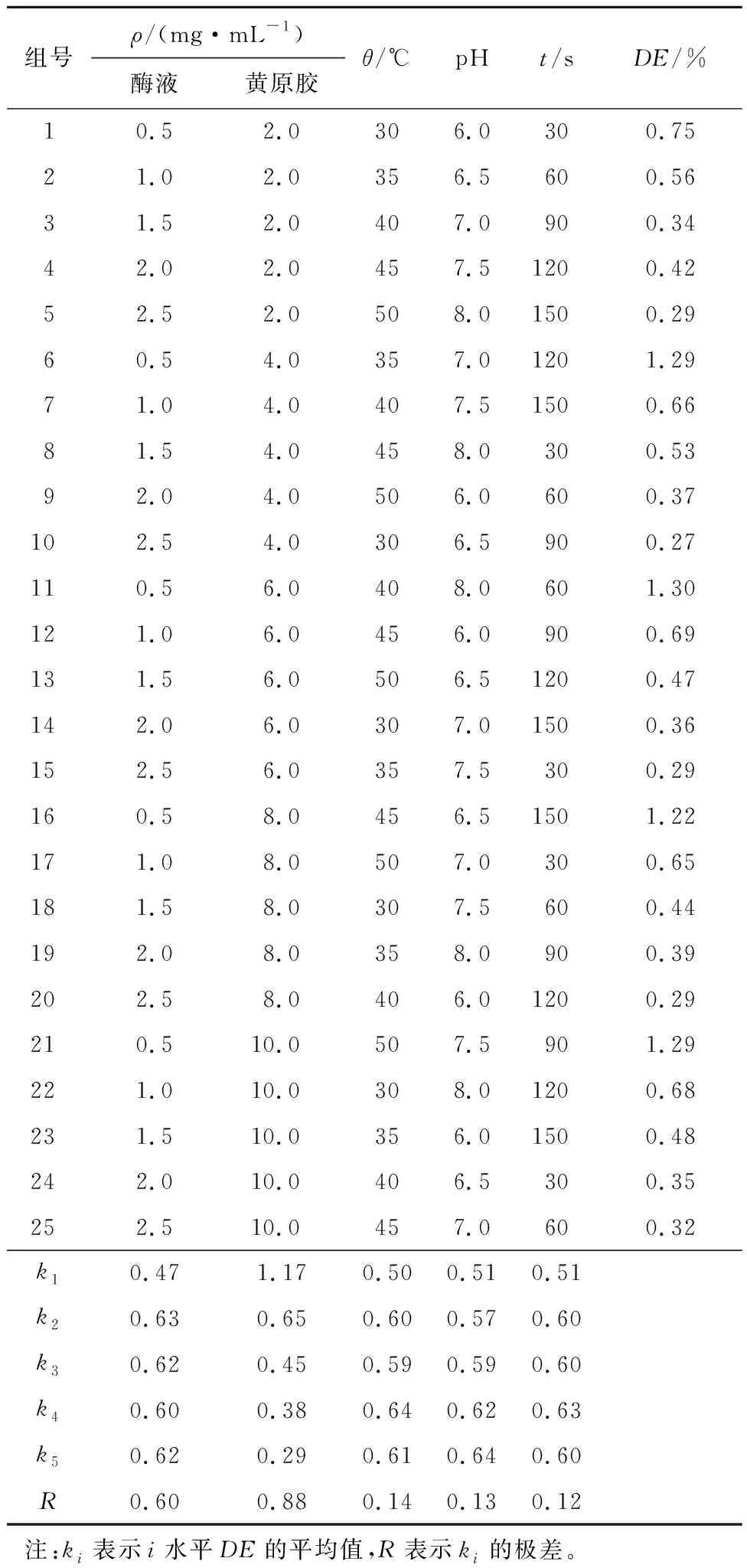
表2 黄原胶酶解条件分析Tab.2 Analysis of xanthan enzymolysis conditions
正交试验结果得到该反应的最优酶解条件为pH 8.0的缓冲体系中1.0 mg/mL胞内酶液与2.0 mg/mL黄原胶底物,45 ℃孵育2 min。在此条件下制备出黄原胶寡糖的DE为3.7%。
2.3 黄原胶寡糖的结构性质
通过使用凝胶渗透色谱对胞内酶液水解黄原胶产物的分子质量分布进行测定,结果如图2所示。黄原胶酶解后的产物包含两个主要组分,一种为部分降解的黄原胶,其分子质量为2 619 u,保留时间为19~26 min;一种为降解后低分子质量的黄原胶寡糖(941 u),保留时间为30~36 min。产物中未被酶解的黄原胶是由于其致密有序的螺旋结构使得BL21(DE3)胞内酶液无法接触到对应的酶切位点[13]。与之前相关研究结果相比,胞内酶液更好的突破了黄原胶降解的瓶颈,能够将高聚合度、结构复杂的黄原胶水解为低分子质量的产物[14]。
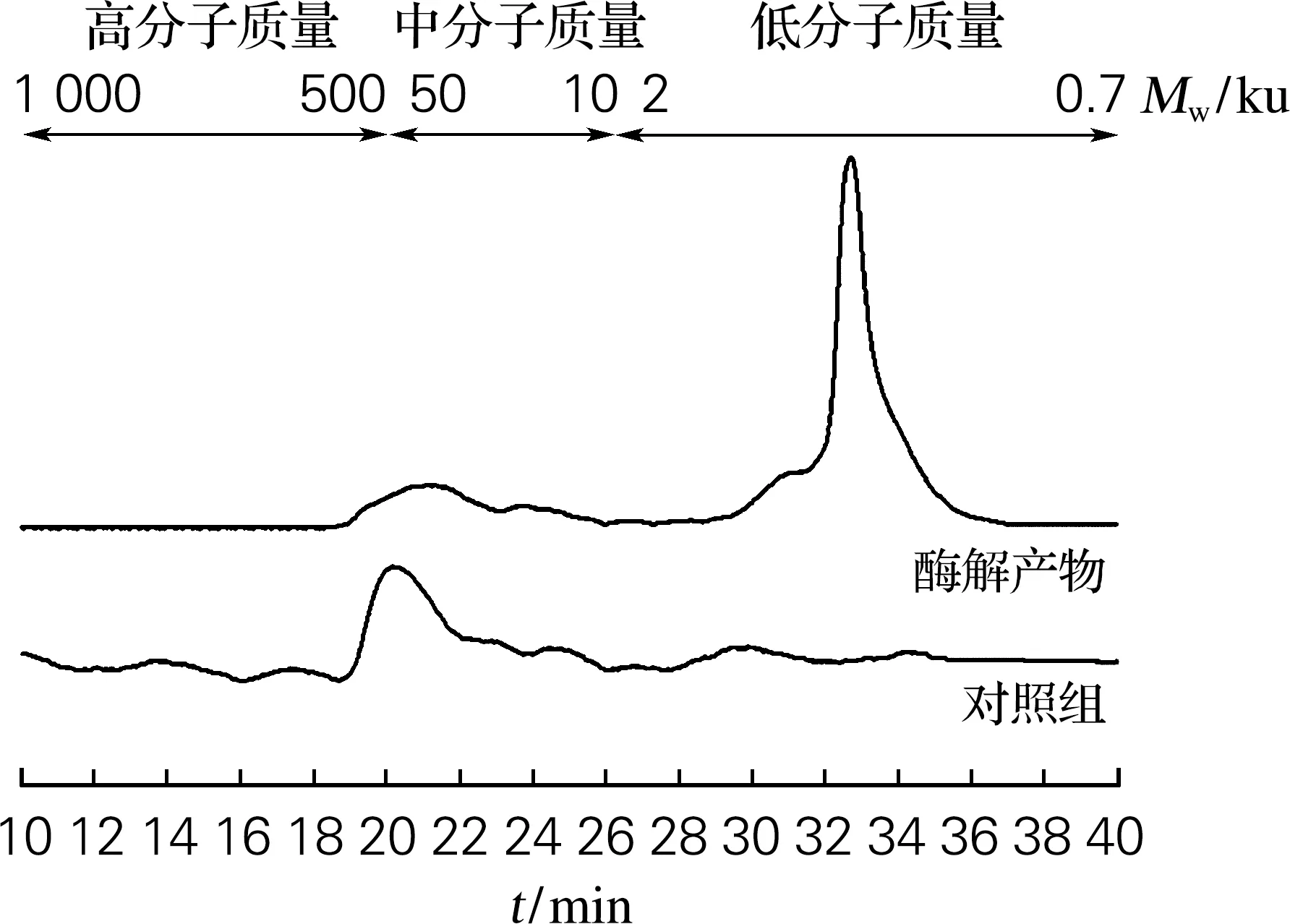
图2 胞内酶液水解黄原胶产物的凝胶渗透色 谱结果
利用离子色谱对黄原胶酶解后低分子质量产物的组分进行分析,结果如图3所示。在5~10 min 处出现的寡糖峰的聚合度(DP)为7~8,约为1个五糖结构单元;在17~23 min出现峰的聚合度为12~14,约为2个结构单元;在23~30 min 出现峰的聚合度为15~18,约为3个结构单元。这3组寡糖峰对应的分子质量在900~2 700 u,证明了凝胶渗透色谱结果中出现了941 u。说明胞内酶液具备良好的黄原胶降解能力。
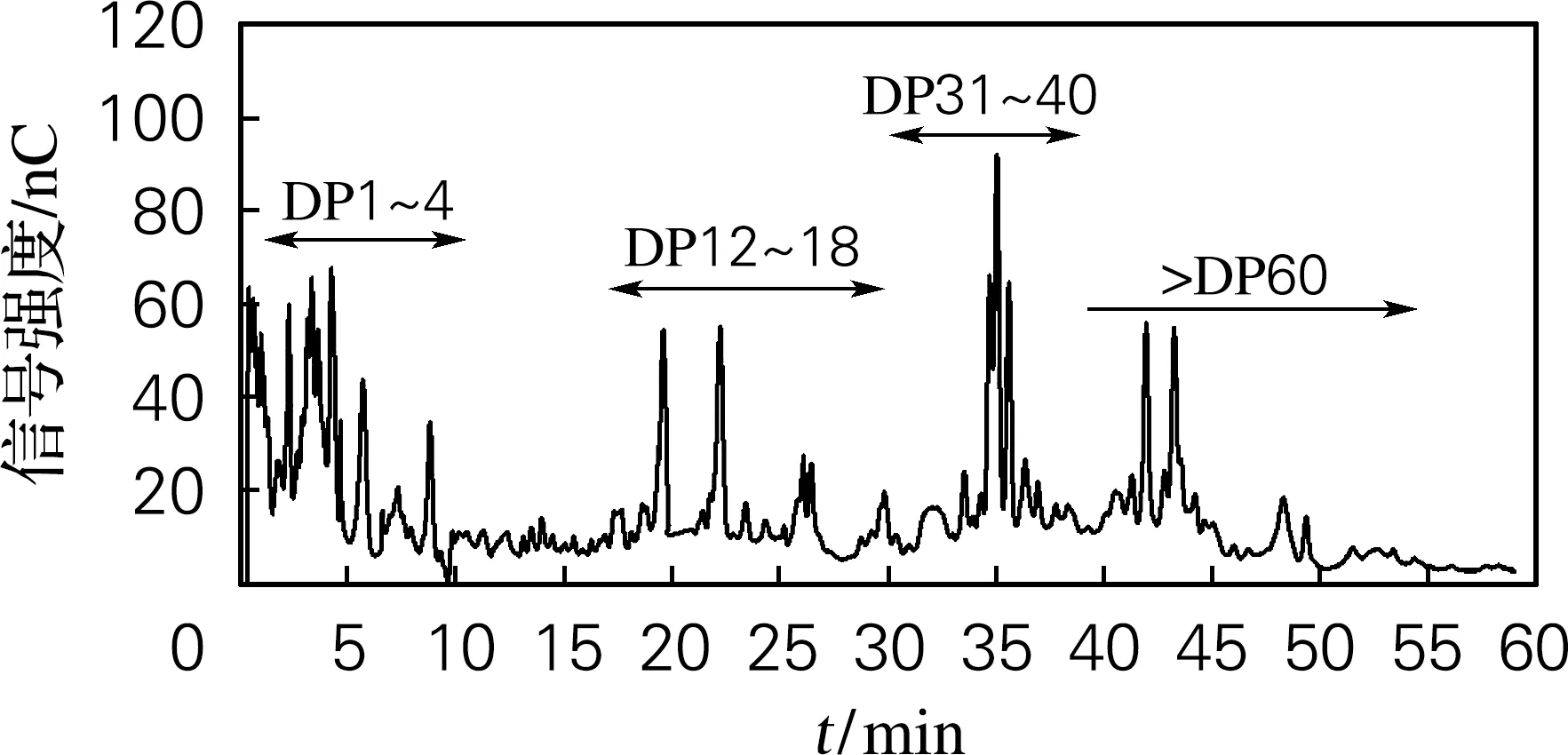
图3 胞内酶液水解黄原胶产物的离子色谱结果
2.4 黄原胶寡糖的生理活性
黄原胶寡糖对DPPH自由基的清除作用如图4(a)所示。DPPH自由基清除作用随黄原胶寡糖浓度的增加而增强。黄原胶寡糖的IC50为3.46 mg/mL。与酸氧化法制备的DPPH自由基清除活性对比有提高[1],可能是因为酶法保留下了大部分的丙酮酸基团,从而提高了黄原胶寡糖抗氧化活性。
黄原胶寡糖对羟自由基的清除作用如图4(b)所示。清除能力随黄原胶寡糖质量浓度的增加而增强,黄原胶寡糖的IC50为1.03 mg/mL。以抗坏血酸为对照,其IC50为4.71 mg/mL。结果表明,与抗坏血酸相比,黄原胶寡糖具有更强的清除羟自由基能力。与酸、碱氧化法制备黄原胶寡糖的羟基自由基IC50相比分别提高2.4倍和9.1倍[1]。
还原力试验也通常被用来评估抗氧化剂提供电子的能力[15]。黄原胶寡糖的还原力如图4(c)所示。随着黄原胶寡糖质量浓度的增加,吸光度随之增大。质量浓度为3.0 mg/mL时,黄原胶寡糖的吸光度为0.065。较之酸氧化法还原力有所提高,但略低于碱氧化法[1]。
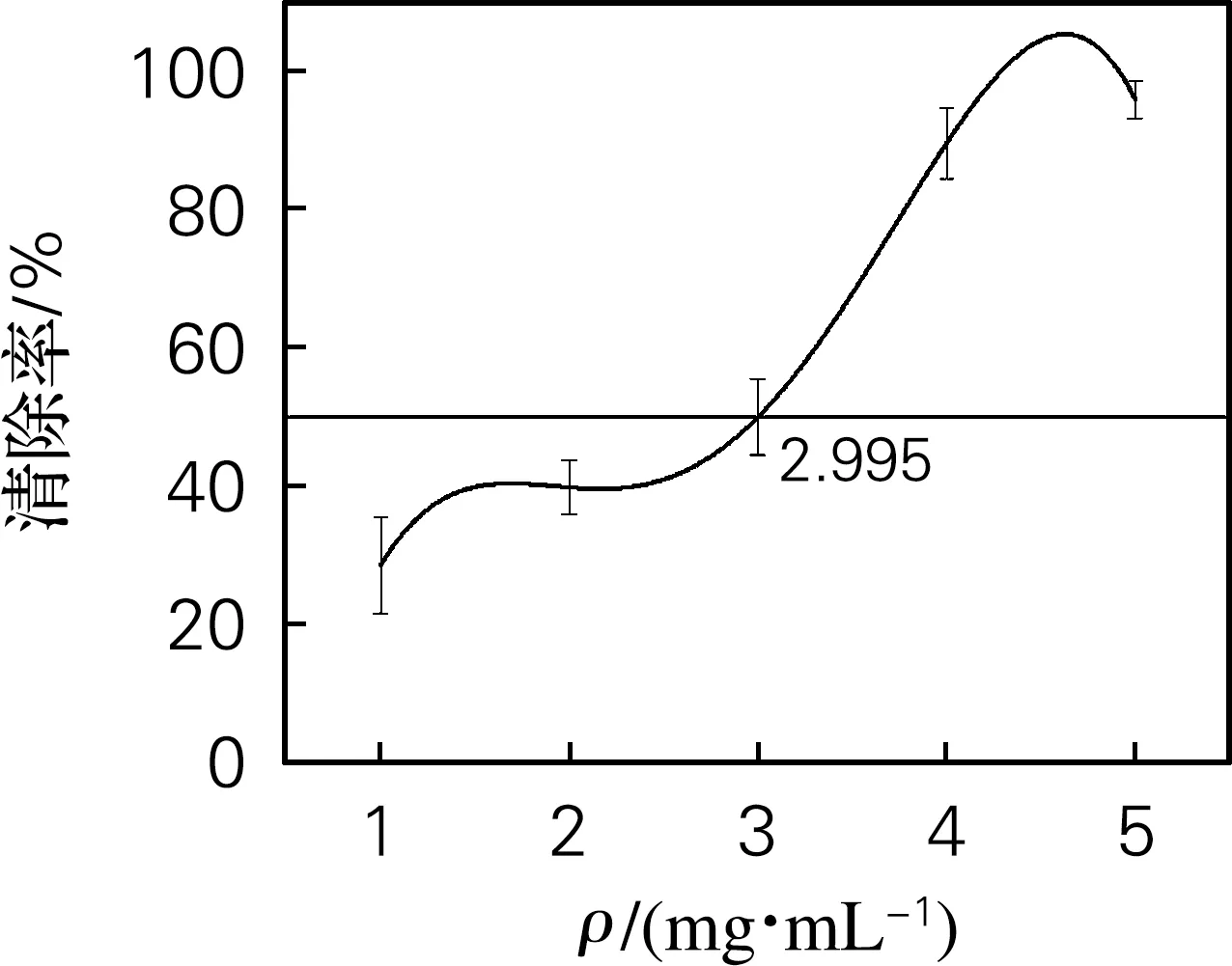
1.0~5.0 mg/mL黄原胶寡糖对H2O2的清除活性如图4(d)所示。黄原胶寡糖的IC50为2.995 mg/mL,与酸、碱氧化法制备黄原胶寡糖的H2O2清除率IC50对比,清除活性略低[1]。
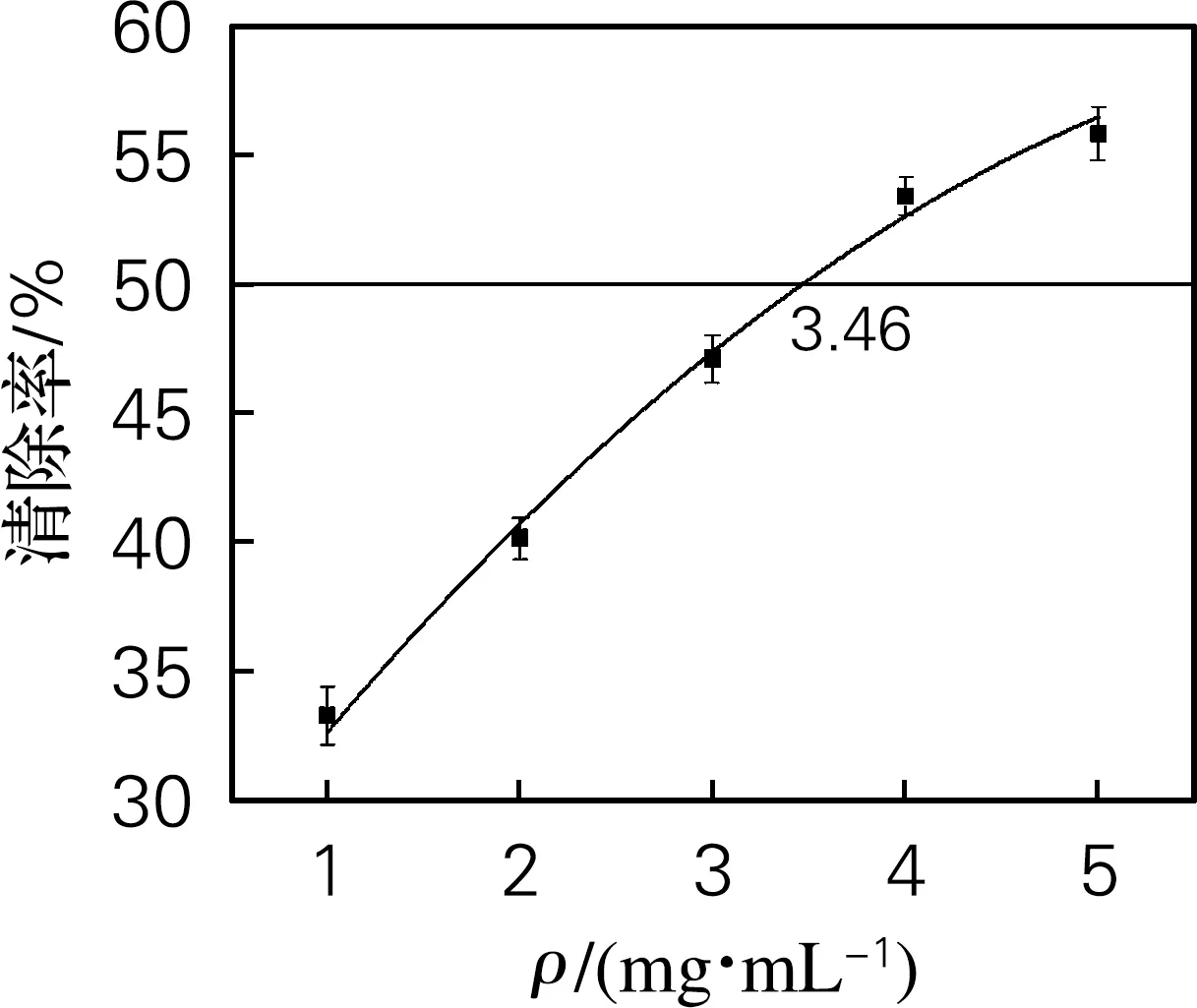
(a) DPPH自由基清除率
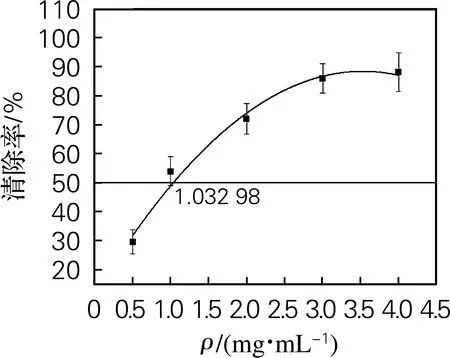
(b) 羟基自由基清除率
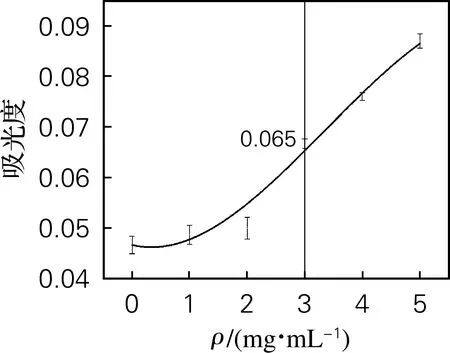
(c) 还原力
(d) H2O2清除率
3 结 论
对大肠杆菌BL21(DE3)胞内酶液水解黄原胶的酶学性质进行分析,发现其对黄原胶具有较高的内切酶和裂解酶活力,分别为(104.00±1.36) U/g和(1.28±0.62) U/mg。对黄原胶酶解条件优化分析结果表明,该酶解体系中最适酶质量浓度为1.0 mg/mL,底物质量浓度为2.0 mg/mL,酶反应温度为45 ℃,pH为8.0,反应时间2 min。在此条件下制备出黄原胶寡糖的DE为3.7%。BL21(DE3)胞内酶液能有效切割黄原胶主链,得到不同聚合度大小的黄原胶寡糖。通过与既往文献相比,使用优化后的方法酶解制备出的黄原胶寡糖在DPPH自由基清除活性、羟基自由基清除活性、还原力、过氧化氢清除活性方面效果良好。

