瑞香素对坐骨神经慢性压迫性损伤诱导大鼠神经病理性疼痛的作用及其机制*
张 奕,贾蔓箐,刘园园,刘 军
(新疆医科大学第七附属医院药学部,乌鲁木齐 830028)
神经病理性疼痛(NP)是一种由体感神经系统损伤或功能障碍引起的以痛觉超敏、痛觉过敏、自发性疼痛和感觉异常为特征的慢性疼痛。据统计,NP 在成年人中的患病率为7%,严重影响患者的生活质量[1]。NP的病因复杂,其诊断和治疗仍是目前临床面临的难题[2]。近年来有研究发现,脊髓内星形胶质细胞和小胶质细胞的偶联改变在NP的发生中起着关键作用[3]。活化的星形胶质细胞和小胶质细胞可能通过促进炎性细胞因子和趋化因子释放诱发局部神经炎症,使神经元致敏,从而促进NP的产生[4]。而阻断促炎趋化因子的分泌或维持促炎细胞因子与抗炎细胞因子的平衡能够减轻疼痛超敏反应[5]。以上研究结果提示,活化的胶质细胞调节炎症反应可能是NP的重要发病机制之一。
瑞香素(DAPH)是从瑞香中提取的主要活性成分,具有抗炎、抗菌、抗氧化、抗肿瘤和镇静、镇痛等广泛的生物活性,已被临床用于治疗炎症性疾病[6]。动物实验表明,DAPH 对伴有慢性疼痛的实验性自身免疫性脑脊髓炎和类风湿性关节炎均具有良好的改善作用[7-8]。此外,DAPH 透皮贴片可减轻醋酸诱导的小鼠疼痛[9]。然而,DAPH 的镇痛作用,尤其在慢性炎性疼痛方面的作用及其机制尚未明确。基于此,本研究通过采用坐骨神经慢性压迫性损伤(CCI)诱导大鼠NP,探索DAPH在慢性炎性疼痛中的作用及相关分子机制。
1 材料与方法
1.1 实验动物 SPF 级SD 雄性大鼠60 只,8~10 周龄,体重250~280 g,购于新疆医科大学实验动物中心,合格证号:SCXK(新)2018-0002。动物饲养于标准动物房,以标准饲料喂养,自由饮水、进食。
1.2 实验试剂与仪器 DAPH(纯度≥98%,规格:20 mg)购自成都艾博克生物科技有限公司;BCA蛋白定量试剂盒、RIPA 裂解液、ECL 均购自合肥莱尔生物科技有限公司;肿瘤坏死因子-α(TNF-α)、白细胞介素(IL)-1β、IL-6酶联免疫吸附试验(ELISA)检测试剂盒购自武汉艾迪抗生物科技有限公司;鼠抗胶质原纤维酸性蛋白(GFAP)单克隆抗体、鼠抗钙离子接头蛋白1(Iba-1)单克隆抗体均购自上海碧云天生物科技有限公司;兔抗硫氧还蛋白相互作用蛋白(TXNIP)单克隆抗体、兔抗Nod 样受体蛋白3(NLRP3)单克隆抗体、兔抗凋亡相关斑点样蛋白(ASC)单克隆抗体、兔抗含半胱氨酸的天冬氨酸蛋白水解酶-1(Caspase-1)单克隆抗体、鼠抗β-actin单克隆抗体、HRP 标记的抗鼠IgG 和抗兔IgG 抗体均购自艾博抗(上海)贸易有限公司。
BW-EVF2393型电子Von Frey测痛仪购自上海阮隆科技发展有限公司;BME-410C 型全自动足底镇痛测试仪购自上海玉研科学仪器有限公司;自动凝胶成像分析系统购自美国Thermo Fisher Scientific公司;CX43荧光显微镜购自南京贝登医疗股份有限公司;SuPerMax 3100 型多功能酶标仪购自上海闪谱生物科技公司。
1.3 NP大鼠模型的建立[10]腹腔注射戊巴比妥钠(40 mg/kg)麻醉并固定大鼠,用止血钳钝性分离股二头肌暴露坐骨神经,采用4-0 铬制羊肠线在坐骨神经主干中部进行4 圈环形结扎,每圈结扎间隔1 mm 的距离,术毕逐层缝合伤口,并腹腔注射100 mg/mL氨苄青霉素预防感染。若大鼠患肢足趾并拢且呈轻度外翻,出现蜷缩、跛行、自发性抬足等现象,机械缩足反射阈值(MWT)明显降低,缩足反射潜伏期(TWL)明显缩短,即说明CCI 诱导的NP大鼠模型构建成功。
1.4 实验分组与处理 将60只大鼠随机分为假手术组、模型组、DAPH低剂量组(DAPH-L组)、DAPH高剂量组(DAPH-H 组),每组15 只。模型组、DAPH-L 组、DAPH-H 组均建立NP 模型,假手术组手术操作同模型组但不结扎坐骨神经。DAPH-L组和DAPH-H 组分别灌胃给予30 mg/kg 和90 mg/kg的DAPH[11],假手术组和模型组灌胃给予等量生理盐水。术后第1天开始给药,连续14 d。
1.5 大鼠疼痛行为测定 分别于术前1 d 和术后1 d、3 d、7 d、14 d进行MWT和TWL测试。(1)MWT测试:将大鼠置于有机玻璃室内30 min以适应测试环境,随后用不同压力的von Frey 纤维丝刺激大鼠患肢足底中部,刺激强度由小到大,每种强度刺激重复5 次,每次刺激保持3~5 s,每两次刺激间隔时间为30 s。记录诱发大鼠缩足反应≥3 次时的压力值,记为阳性反应。MWT 测试重复10 次,取平均值。(2)TWL测试:使用全自动足底镇痛测试仪测量大鼠足底对热刺激的敏感性。将大鼠置于3 mm厚的玻璃板表面,玻璃板上覆盖有机玻璃室,辐射热源位于玻璃板下方固定距离处,热刺激直接作用于左后爪的暴露部位,记录诱发大鼠频繁抬足、舔足等现象的时间。测试仪切断时间设置为30 s,以避免组织损伤。每隔5 min 进行5 次热刺激,取平均值。
1.6 标本采集 疼痛行为测试结束后,麻醉大鼠,经心脏灌注生理盐水,分离大鼠L5 背根神经节(DRG)组织和L4~L6节段之间的脊髓组织,保存备用。
1.7 ELISA法检测大鼠脊髓组织中炎症因子水平 取大鼠L4~L6 段脊髓组织,加入预冷的PBS,4 ℃、8 000 r/min 离心10 min,收集上清液,用酶标仪检测450 nm 处的吸光度值,绘制标准曲线,计算大鼠脊髓组织中TNF-α、IL-1β和IL-6水平。检测过程严格按照试剂盒说明书操作。
1.8 免疫荧光染色法检测大鼠脊髓组织中GFAP和Iba-1 表达水平 取大鼠脊髓组织,置于4%多聚甲醛中,4 ℃冰箱固定过夜,30%蔗糖溶液脱水,取组织制备16 μm厚的冰冻切片,PBS漂洗3次,每次5 min。加入含有0.3%Triton X-100的5%山羊血清封闭液,室温封闭2 h,清除血清,加入一抗GFAP(1∶1 000)、Iba-1(1∶1 000)稀释液4 ℃冰箱孵育过夜,PBS 漂洗3 次,每次5 min;滴加二抗,室温避光孵育2 h,DAPI 染色,PBS 充分漂洗,滴加抗荧光猝灭剂封片,荧光显微镜下观察并拍照,采用Image J图像分析软件分析GFAP和Iba-1的荧光强度。
1.9 Western blotting 法检测TXNIP、NLRP3、ASC、Caspase-1 蛋白表达 取大鼠DRG 组织,加入RIPA裂解缓,冰上裂解,提取总蛋白,BCA法检测蛋白浓度。用10%SDS-PAGE 电泳分离蛋白,将蛋白转移到PVDF 膜,加入5%脱脂奶粉,室温封闭2 h;加入一抗TXNIP、NLRP3、ASC、Caspase-1、β-actin(均1∶1 000)4 ℃冰箱孵育过夜,洗膜,加入HRP标记的二抗(1∶1 000)室温孵育2 h,ECL显影,Image J软件分析目的蛋白条带灰度值。
1.10 统计学方法 采用GraphPad Prism 8.0 软件进行统计分析,计量资料以均数±标准差()表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 各组大鼠一般情况及体重变化 各组大鼠术后均未感染,切口愈合良好,精神状况佳,饮水、进食正常,体重无明显差异(P>0.05),见图1。模型组、DAPH-L 组、DAPH-H 组大鼠术后1~3 d 出现跛行、左后肢负重困难等现象,在术后3~14 d 表现明显。
图1 各组大鼠体重变化
2.2 各组大鼠MWT 和TWL 比较 术前1 d,各组MWT和TWL比较,差异均无统计学意义(P>0.05);术后1 d、3 d、7 d、14 d,与假手术组比较,模型组MWT 和TWL 降低(P<0.05);与模型组比较,DAPH-L 组 和DAPH-H 组 术 后3 d、7 d、14 d 时MWT 和TWL 升高,且DAPH-H 组高于DAPH-L 组(均P<0.05),见图2。
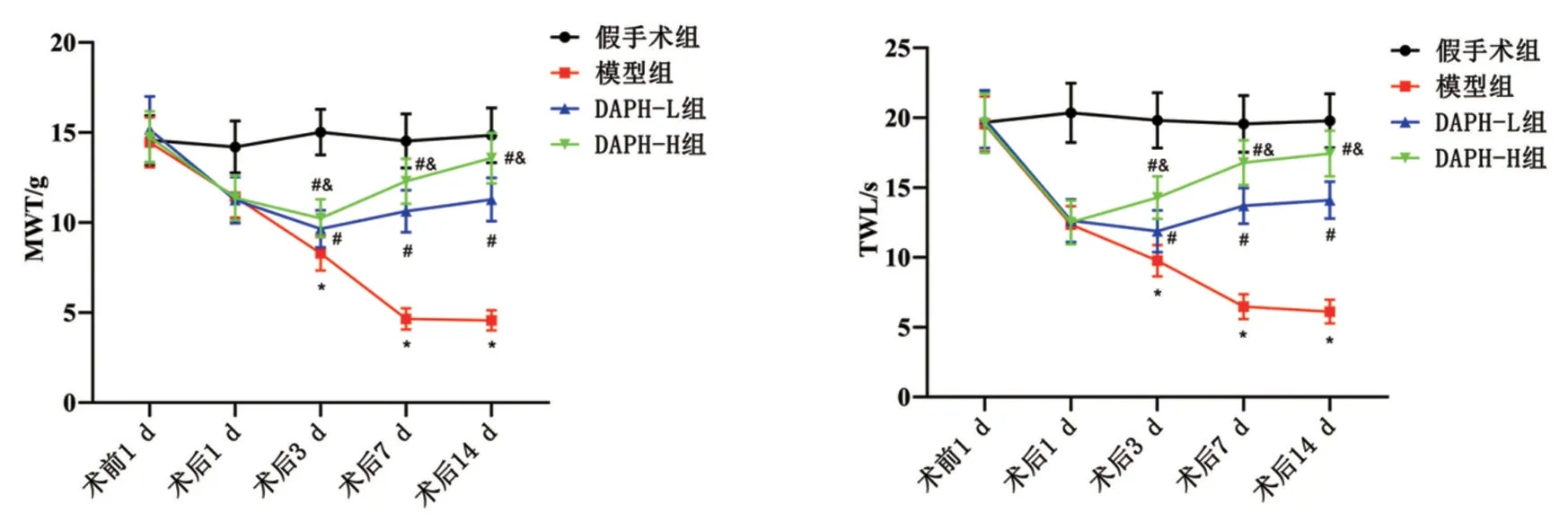
图2 各组大鼠MWT和TWL比较
2.3 各组大鼠脊髓组织中炎症因子水平比较 与假手术组比较,模型组大鼠脊髓组织中TNF-α、IL-1β 和IL-6 水平升高(P<0.05);与模型组比较,DAPH-L 组和DAPH-H 组大鼠脊髓组织中TNF-α、IL-1β和IL-6水平降低,且DAPH-H组低于DAPH-L组(均P<0.05),见表1。
表1 各组大鼠脊髓组织中炎症因子水平比较pg/mL,
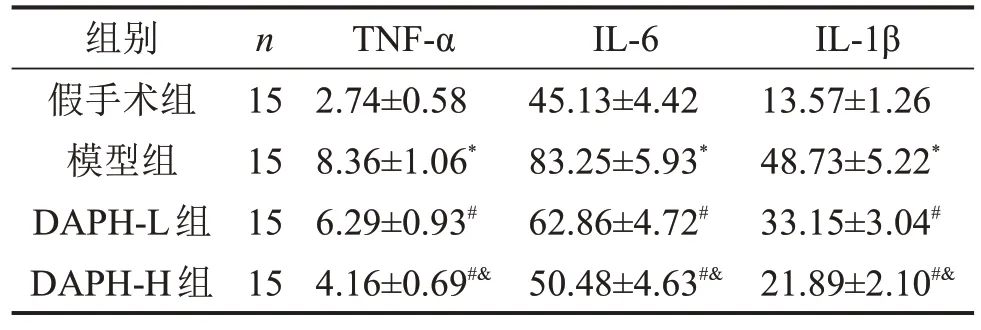
表1 各组大鼠脊髓组织中炎症因子水平比较pg/mL,
与假手术组比较,*P<0.05;与模型组比较,#P<0.05;与DAPH-L组比较,&P<0.05。
2.4 各组大鼠脊髓组织中GFAP 和Iba-1 表达水平比较 与假手术组比较,模型组大鼠脊髓组织中GFAP 和Iba-1 荧光强度增强,GFAP 和Iba-1 表达水平升高(P<0.05);与模型组比较,DAPH-L 组和DAPH-H组大鼠脊髓组织中GFAP和Iba-1荧光强度减弱,GFAP和Iba-1表达水平降低,且DAPH-H组低于DAPH-L组(均P<0.05),见图3。

图3 免疫荧光染色检测大鼠脊髓组织中GFAP和Iba-1表达(×200)
2.5 各组大鼠DRG 中TXNIP、NLRP3、ASC 和Caspase-1 蛋白表达比较 与假手术组比较,模型组大鼠DRG中TXNIP、NLRP3、ASC和Caspase-1蛋白表达水平升高(P<0.05);与模型组比较,DAPH-L 组和DAPH-H 组大鼠DRG 中TXNIP、NLRP3、ASC 和Caspase-1 蛋白表达水平降低,且DAPH-H 组低于DAPH-L组(均P<0.05),见图4。
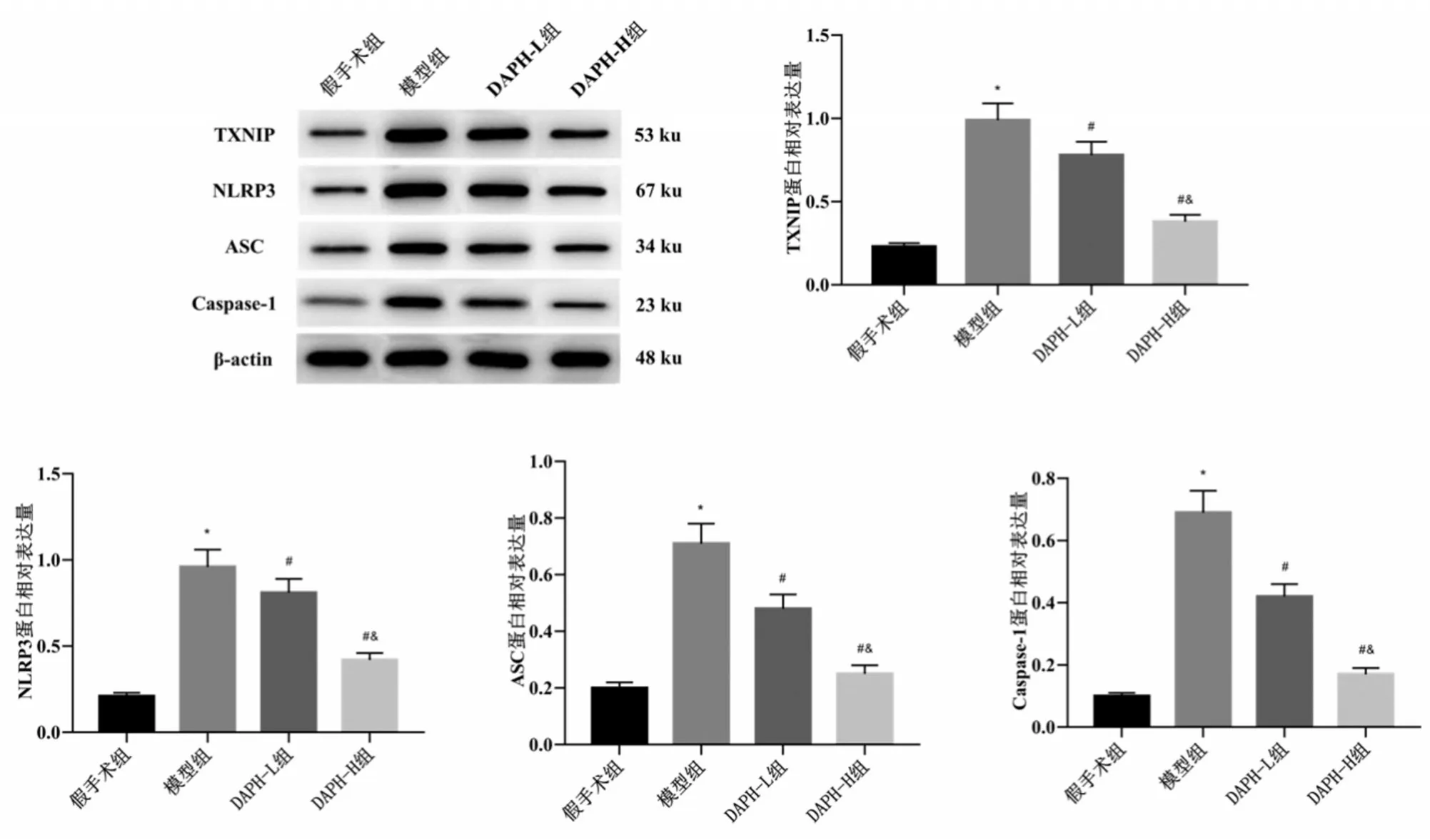
图4 各组大鼠DRG中TXNIP、NLRP3、ASC和Caspase-1蛋白表达比较
3 讨论
DAPH 是一种天然香豆素衍生物,在心血管疾病、炎症性疾病的治疗中有着良好的效果[12]。Qi等[13]研究发现,DAPH 可通过调节MAPK 信号通路和HSP70 表达保护氧化应激诱导的神经元凋亡。Zhi等[14]报道,DAPH通过激活海马神经元Nrf2/HO-1信号通路保护海马神经元免受氧气葡萄糖剥夺诱导的损伤。DAPH 可通过抑制炎症反应、单胺氧化酶A 介导的神经递质损耗和氧化应激减轻利血平所致小鼠纤维肌痛[15]。DAPH 还可通过调控Nrf2/HO-1/NF-κB 信号通路抑制脊髓胶质细胞活化,从而减轻弗氏完全佐剂诱导的炎性疼痛[16]。NP 属于慢性炎症性疼痛。本研究中,CCI诱导的NP大鼠术后出现明显的机械超敏反应和热超敏反应,经DAPH干预后,NP大鼠机械超敏反应和热超敏反应明显减轻,且DAPH 高剂量改善大鼠疼痛效果显著优于DAPH低剂量。证实DAPH能够有效改善NP,且其作用效果与药物剂量相关。
周围神经损伤激活小胶质细胞和星形胶质细胞,导致神经营养因子如脑源性神经营养因子(BDNF)和促炎细胞因子如TNF-α、IL-1β、IL-6等释放增多,从而启动病理疼痛过程[17-18]。Iba-1 是小胶质细胞活化的特定标志物,GFAP 是星形胶质细胞活化的生物标志物,抑制Iba-1和GFAP表达可有效抑制小胶质细胞和星形胶质细胞激活。CCI可引起脊髓背角小胶质细胞和星形胶质细胞活化,促进Iba-1 和GFAP 过度表达,抑制脊髓背角中Iba-1 和GFAP 的过度表达可缓解CCI 诱导的NP[19]。TNF-α在促进神经性疼痛的发展中发挥着重要作用,在周围神经损伤诱导的神经性疼痛模型中,DRG和脊髓背角中TNF-α表达上调,阻断TNF-α信号可减轻硼替佐米诱导的神经性疼痛[20]。IL-1β 是疼痛信号转导的重要因子,其由活化的巨噬细胞以原蛋白的形式表达,经Caspase-1 蛋白水解生成成熟片段。IL-1β 成熟片段能够引起初级感觉神经元的神经纤维敏感,进而引起疼痛超敏。抑制IL-1β 表达可减轻CFA诱导的炎性疼痛[21]。IL-6也与多种病因引起的NP有关。红核中IL-6通过激活JAK/STAT3和ERK信号通路参与神经损伤诱导的NP,并通过诱导TNF-α 和IL-1β 产生维持NP[22]。本研究结果显示,CCI 诱导的NP 大鼠脊髓组织中TNF-α、IL-1β、IL-6水平以及GFAP、Iba-1表达水平均升高,DAPH干预后NP 大鼠脊髓组织中促炎细胞因子及GFAP 和Iba-1 表达水平均明显降低。表明DAPH 能够抑制CCI 诱导的脊髓小胶质细胞和星形胶质细胞激活,并减少大鼠脊髓促炎细胞因子TNF-α、IL-1β、IL-6的产生。
TXNIP广泛表达于多种细胞中,是内源性清除活性氧的蛋白硫氧还蛋白的抑制剂,也是调节能量代谢过程中氧化应激和炎症的重要分子营养传感器,其与脊髓或脑损伤、神经退行性疾病的发生有关[23]。NLRP3 炎性小体在先天免疫和炎症中起着至关重要的作用,NLRP3可通过ASC募集Caspase-1前体,活化Caspase-1,诱导炎症因子表达。NLRP3的激活受多种细胞蛋白或因子的影响。TXNIP 与NLRP3 结合是NLRP3 炎性小体形成和激活所必需的关键信号机制。TXNIP/NLRP3 炎性小体轴已被证实在海马损伤、脑缺血卒中、脊髓损伤等中枢神经系统功能障碍或疾病中发挥重要作用[24-25]。Hu等[26]报道,抑制TXNIP/NLRP3炎性小体轴的激活能够减轻CCI 引起的脊髓背角神经元丢失,从而减轻CCI 诱导的NP。本研究结果显示,CCI 诱导的NP大鼠DRG 中TXNIP 蛋白表达水平升高,TXNIP 通过与NLRP3 形成复合体激活NLRP3 炎性小体,促进ASC 和Caspase-1 蛋白表达,而DAPH 能够显著下调NP 大鼠DRG 中TXNIP、NLRP3、ASC 和Caspase-1 蛋白表达。提示DAPH 改善CCI 诱导的NP,可能与抑制TXNIP/NLRP3炎性小体轴激活有关。
综上所述,DAPH 通过阻断星形胶质细胞和小胶质细胞的活化抑制炎症反应,进而减轻周围神经损伤诱导的NP,其作用机制可能与抑制TXNIP/NLRP3炎性小体轴的活化有关。

