促红细胞生成素对高糖诱导大鼠近端肾小管上皮细胞转分化的影响
张锦华,高 明,朱小静,李立立
(西安市人民医院 西安市第四医院肾脏内科,陕西 西安710004)
肾间质纤维化是糖尿病肾病(Diabetic nephropathy,DN)进展至终末期肾脏病(End-stage renal disease,ESRD)的病理基础[1]。在DN过程中,肾小管上皮细胞因管腔中葡萄糖浓度变化及次级代谢底物传递紊乱等而影响其正常生理功能,打乱细胞因子平衡状态,抑制维持上皮细胞形态的基因表达,表型标志物E钙粘蛋白(E-cadherin)、紧密连接蛋白(ZO-1)等表达减少,表达肌成纤维细胞表型释放,出现间充质标志物如α平滑肌肌动蛋白(α-SMA)、成纤维细胞特异性蛋白(FSP)等表达增加,进而出现上皮细胞转分化成肌成纤维细胞[2-3],即上皮细胞转分化(EMT)。一些损伤因素,如炎症、自身免疫、缺血-再灌注和高血糖等都可诱导成纤维细胞活化,发生EMT。研究证实[4-6],肾小管上皮细胞EMT是可逆的,因此,临床上急需寻找能延缓或抑制EMT的方法,药物治疗就显得尤为重要。
促红细胞生成素(Erythropoietin,EPO)由肾脏分泌,受肾脏皮质和外髓局部组织氧含量调节,通过肾小管上皮细胞促红素受体(EPOR)经血液循环作用于骨髓红系祖细胞,主要作用是促进红细胞增生[7]。在临床上EPO主要作为改善肾性贫血的治疗药物,研究证实其在新生儿及癌症导致的贫血治疗方面也有显著效果[8-10]。研究发现,在各种非造血组织中也广泛分布EPOR,并发挥促血管生成、胚胎组织发育、抗炎保护等作用,因此被公认为一种全身性保护性细胞因子[11-13]。在急性肾损伤(Acute kidney injury,AKI)中EPO作为一种保护因子,研究最多的即为其抗氧化应激(Oxidative stress,OS)、抗炎抗凋亡作用[14-15]。然而,在慢性肾脏疾病如DN时,EPO是否在抑制OS、预防肾小球硬化、肾间质纤维化等方面的研究尚少。本研究将通过体外细胞实验,明确EPOR表达情况,进一步研究EPO对高糖诱导的近端肾小管上皮细胞OS和EMT的影响,探讨EPO在DN肾脏保护中的作用机制。
1 材料与方法
1.1 细胞及主要试剂 NRK52E细胞购自上海研域生物科技有限公司;EPO由沈阳三生制药生产;甘露醇购自广西南宁化学制药公司;DEME/F12完全培养基购自上海中乔新舟生物科技公司;胎牛血清(FBS)购自美国 Gibco公司;胰蛋白酶消化液(0.25%)购自武汉百浩天生物科技有限公司;青霉素-链霉素双抗(100×)溶液购自美国赛默飞公司;活性氧ROS含量分析试剂盒购自上海研一生物科技有限公司;兔抗小鼠E-cadherin、α-SMA和EPOR抗体,兔抗小鼠GADPH抗体均购自于美国 Abcam公司;辣根过氧化物酶标记山羊抗兔IgG二抗购自上海碧云天生物技术有限公司;GAPDH引物购自上海爱丁堡生物科技发展有限公司;反转录试剂盒、Real-time RT-PCR试剂盒均购自大连TaKaRa公司。
1.2 实验方法
1.2.1 细胞培养与分组:将NRK52E细胞用含10% FBS和100×双抗的DMEM/F12完全培养基进行培养,适宜条件下培养至指数期,经胰蛋白酶消化后计数,随机分为五组,分别为正常对照组(NC组)、甘露醇对照组(OC组)、高葡萄糖浓度组(HG组)、HG+EPO 50 U/ml组(E1组)以及HG+EPO 100 U/ml组(E2组)。除NC组不做任何处理外,OC组在培养基中加入19.5 mmol/L甘露醇,排除渗透造成的影响,其余三组培养在25 mmol/L高糖环境中,且E1、E2组按要求添加相应浓度的EPO,共培养48 h后,进行后续实验。
1.2.2 活性氧试剂盒检测ROS水平:采用活性氧ROS分析试剂盒(2’7’-二氢二氯荧光素二乙酸酯DCFH-DA荧光探针)检测活性氧水平。将五组NRK52E细胞(指数期)接种于96孔培养板中,48 h后吸去培养液,滴加浓度为10 mmol/L的DCFH-DA液,充分覆盖细胞,37 ℃培养箱避光孵育20 min,吸去DCFH-DA液,用PBS液洗涤3次,收集各组上清液,参照活性氧检测试剂盒说明书检测各组NRK52E细胞内的活性氧水平。
1.2.3 RT-PCR:采用RT-PCR检测E-cadherin、α-SMA和EPOR mRNA相对表达水平,按照RNA抽提试剂盒实验步骤提取各组细胞的总RNA,用反转录试剂盒合成cDNA,以cDNA为模板进行RT-PCR。扩增程序为:95 ℃ 30 s、95 ℃ 5 s、58 ℃ 40 s,共40个循环,65 ℃~95 ℃溶解曲线,以GAPDH为内参测定目的基因的表达,引物序列见表1。

表1 RT-PCR引物序列
1.2.4 Western blot:采用Western blot检测E-cadherin、α-SMA和EPOR蛋白表达,提取各组NRK52E细胞总蛋白,BCA法蛋白定量,加入缓冲液,蛋白变性后进行SDS-PDGE电泳。PVDF膜,5%脱脂奶粉封闭2 h,分别加入E-cadherin抗体(1∶6000)、α-SMA 抗体(1∶1500)、EPOR抗体(1∶2000)以及GADPH(1∶2000),4 ℃孵育过夜,TBST洗膜后加入辣根过氧化物酶(HRP)标记的二抗(1∶4000),振荡孵育2 h,洗膜后用增强的化学发光法检测。以GADPH 为内参,计算各组细胞中E-cadherin、α-SMA和EPOR蛋白相对表达水平。

2 结 果
2.1 高糖条件下NRK52E细胞EPOR的表达变化 与NC组比较,OC组EPOR mRNA无统计学差异(P>0.05);HG组EPOR mRNA表达增加(P<0.05),见图1A。与NC组比较,OC组EPOR蛋白无明显变化(P>0.05),HG组EPOR蛋白表达增加(P<0.05),见图1B、C。结果说明,高糖可刺激NRK52E细胞EPOR表达增加,相同渗透浓度的甘露醇不影响细胞EPOR表达。
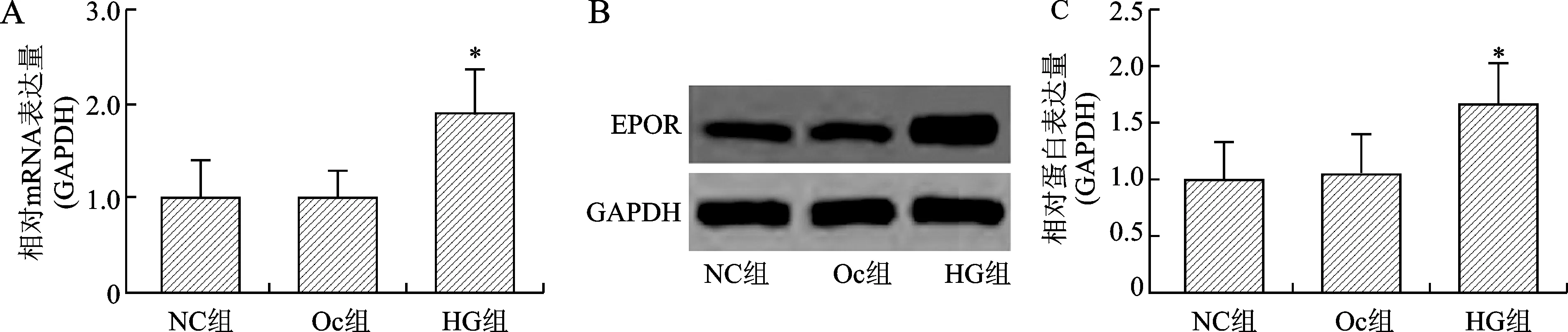
注:与NC组比较,*P<0.05
2.2 EPO对高糖诱导NRK52E细胞转分化的影响 与NC组比较,OC组E-cadherin、α-SMA mRNA无统计学差异(均P>0.05),HG组E-cadherin mRNA表达降低(P<0.05),α-SMA mRNA表达增加(P<0.05);与HG组比较,E1和E2组E-cadherin mRNA表达增加(均P<0.05),α-SMA mRNA表达降低(P<0.05),且E2组mRNA变化程度较E1组更显著,差异具有统计学意义(P<0.05),见图2A。Western blot检测结果显示,与NC组比较,OC组E-cadherin、α-SMA 蛋白无统计学差异(均P>0.05);HG组E-cadherin 蛋白表达降低(P<0.05),α-SMA 蛋白表达增加(P<0.05);与HG组比较,E1和E2组E-cadherin 蛋白表达增加(均P<0.05),α-SMA 蛋白表达降低(P<0.05),且E2组蛋白变化程度较E1组显著,差异具有统计学意义(P<0.05),见图2B、C。结果说明,高糖可诱导NRK52E细胞间充质转分化,EPO可抑制高糖诱导的NRK52E细胞间充质转分化,大剂量EPO干预(E2组)较小剂量EPO干预(E1)抑制转分化效果显著。
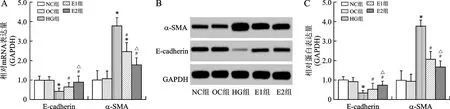
注:与NC组比较,*P<0.05;与HG组比较,#P<0.05;与E1组比较,△P<0.05
2.3 EPO对高糖诱导氧化应激的影响 NC组和OC组ROS水平低,与其他三组比较无统计学差异(均P>0.05);相较于NC组,HG组细胞ROS水平显著增加(P<0.05);相较于HG组,E1和E2组细胞内ROS水平降低,且E2组降低更显著(P<0.05),见表2。
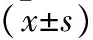
表2 各组细胞内ROS水平
3 讨 论
DN的早期表现为肾肥大、肾小球和肾小管基底膜增厚及其他明显的病理特征。随着疾病的进展,它逐渐演变为肾小管间质纤维化(TIF)、肾小球细胞外基质积聚,TIF是DN进展到ESRD的主要病理基础,而肾小管上皮细胞通过EMT转变为肌成纤维细胞是产生细胞外基质的主要细胞,在TIF进展中发挥重要作用。肾小管上皮细胞EMT过程的抑制和治疗,是降低慢性肾脏疾病的发病率和病死率的重要方法。
EPO是肾小管旁间质细胞合成的具有刺激造血系统的糖蛋白类激素。EPOR为一种跨膜受体,属细胞因子受体超家族,肾脏组织内EPOR广泛表达。研究表明,EPO是体内具有多重器官保护性的细胞因子,在临床治疗中,慢性肾衰竭患者常常采用基因重组技术合成的高纯度人促红素(rhEPO)进行肾性贫血的治疗,起到改善临床指标,优化肾功能等功效[16]。近年来随着对EPO作用机制的深入研究,发现其除了在造血系统发挥重要作用外,在一些非造血系统组织发现存在有EPOR的分布,如神经系统、睾丸间质细胞等,由于EPOR的广泛分布,EPO在这些组织在中亦发挥了非常重要的非造血相关的生理作用。燕鹏等[17]动物实验(大鼠)发现,EPO可降低DN大鼠24 h尿蛋白,具有保护肾脏损伤的作用。陈艳霞等[18]细胞实验发现,rhEPO可能通过抑制RhoA/ROCK信号转导通路从而阻止肾小管上皮转分化,起到肾脏保护作用,在一定范围内随rhEPO水平增加保护作用亦明显增强。
EMT转变过程由多种转录因子和信号通路参与,在EMT过程中,肾小管上皮细胞担任主导作用,E-cadherin由CDH1基因编码,Ca2+依赖性的跨膜糖蛋白,属于Ⅰ型钙黏蛋白,能够维持上皮极性和细胞间结构的完整性,是肾小管上皮保持其特性的标志性蛋白,其减少和丢失是EMT的标志,进而导致纤维化形成,α-SMA是成纤维细胞的特征性标志蛋白,纤维化的特征在于α-SMA表达增加。大量研究证实,氧化应激在肾脏纤维化发展中起重要作用。EPO属于较强的氧自由基清除剂,陈颖东等[19]用EPO治疗缺血再灌注大鼠,发现MDA、SOD、NO改变显著。林才等[20]采用rhEPO治疗新生儿缺氧缺血性脑病,发现治疗后患儿SOD水平均明显升高,MDA水平均显著降低,说明治疗后患者氧自由基清除能力增强,氧化应激得到明显缓解,预后改善。在本研究中发现,高糖诱导NRK52E细胞间充质转分化后,HG组EPOR表达增加,E-cadherin表达降低,α-SMA 蛋白表达增加,细胞ROS水平显著增加,说明高糖环境可以引发肾小管上皮细胞EMT,且NRK52E细胞能够表达EPOR。EPO干预高糖培养的NRK52E细胞发现,EPO抑制高糖引发的EMT,与HG组比较,E1和E2组E-cadherin表达增加,α-SMA表达降低,细胞内ROS水平降低,说明EPO可以减轻高糖导致的氧化应激,对抑制肾小管上皮细胞EMT发挥了一定作用。
综上所述,EPO能够抑制肾小管上皮细胞EMT,能够抑制高糖引发的NRK52E细胞E-cadherin、α-SMA表达异常,缓解高糖诱导的氧化应激,为以后深入探讨EPO在DN中保护作用奠定基础。当然本研究也存在不足之处:①目前尚无EPOR阻断剂类药物,无法用特异性EPOR阻断剂进行EPO发挥小管细胞保护作用的研究;②体外实验不能完全模拟复杂的体内环境,一些小型临床研究和动物实验报道了许多EPO治疗的相关不良反应,特别是大剂量应用EPO的情况下。这些可能的不良反应包括高血压、癫痫发作、血栓形成、高钾血症以及促肿瘤生长等。因此对于EPO的肾脏保护作用还有待于大量的临床试验证实。

