帕金森病病人心血管自主神经功能与脑血管自动调节及UPDRSⅢ评分的相关性
陶 媚,王 晖,张力辉
帕金森病(Parkinson′s disease,PD)是一种主要表现为肌强直、静止性震颤、运动迟缓、姿势不稳等运动症状的神经变性疾病[1]。近年来,相关研究发现,PD不仅累及锥体外系,导致运动障碍,同时认知障碍、自主神经障碍等非运动症状也极其普遍[2]。自主神经障碍临床表现较为多样,包括泌尿、消化、体温、心血管、瞳孔、生殖系统功能中的一或多种障碍。其中,心血管症状的发生是PD病人就医的主要原因之一。过去认为心血管障碍仅于PD晚期出现,但随着疾病研究的深入,发现在未使用药物进行控制治疗的PD早期病人中,心血管症状也较常见,甚至相较于运动症状等出现更早[3]。心血管自主神经障碍发生后,可能导致PD病人出现跌倒、晕厥等,增加心脑血管疾病风险。脑血管自动调节指当脑灌注压发生变化时,大脑维持脑血流量恒定的一种能力[4]。统一帕金森病评定量表Ⅲ(Unified Parkinson Disease Rating Scale Ⅲ,UPDRS Ⅲ)可用来评定PD病人运动症状严重程度。本研究旨在分析PD病人心血管自主神经功能与脑血管自动调节及UPDRS Ⅲ评分的相关性,现报道如下。
1 资料与方法
1.1 临床资料 将我院2019年10月—2021年11月80例PD病人纳入PD组,其中,男44例,女36例;年龄54~79(66.29±5.33)岁;病程0.5~6.0(2.13±0.66)年;起病侧别:左侧39例,右侧41例;Hoehn-Yahr分期:1期12例,2期22例,2.5期23例,3期23例。纳入标准:①符合中华医学会神经病学分会PD诊断标准[5];②于本院接受治疗;③家属对病人信息了解较全面,可配合研究。排除标准:①反复脑卒中病史;②PD叠加综合征,如多进行性核上性麻痹、系统萎缩等;③继发性帕金森综合征;④合并精神疾病、严重痴呆;⑤合并严重器质疾病;⑥近期使用镇静催眠药物、抗心律失常药物、抗癫痫药物等;⑦脑深部电刺激手术史。另选取同期进行健康体检的志愿者20名作为对照组,其中,男11名,女9名;年龄55~79(66.55±5.41)岁。PD组与对照组性别、年龄等临床资料比较差异均无统计学意义(P>0.05)。本研究经医院伦理委员会批准,研究对象及家属知情同意。
1.2 方法
1.2.1 动态血压监测及血压变异性(BPV)分析 记录研究对象血压变化,昼间(06:00~22:00)每30 min测量1次,夜间(22:00至次日06:00)每60 min测量1次,有效测量值>80%为合格。根据各时段血压标准差(SD)作为长时BPV,包括24 h收缩压标准差(24 hSBPSD)、24 h舒张压标准差(24 hDBPSD)、日间收缩压标准差(dSBPSD)、日间舒张压标准差(dDBPSD)、夜间收缩压标准差(nSBPSD)、夜间舒张压标准差(nDBPSD)。
1.2.2 动态心电图(ECG)监测及心率变异性(HRV)分析 所有研究对象采用同步12导联动态ECG检查心率,分析HRV的时域和频域。时域:24 h内窦性R-R间期标准差(SDNN)、全部相邻窦性R-R间期差值均方根值(RMSSD);频域:高频(HF)、低频(LF) 。
1.2.3 脑血管自动调节评估 08:00~10:00测量卧位、立位血压,于经颅多普勒超声检查前30 min测量。平卧位休息10 min以上,测量血压(右上臂), Korotkoff 第1音、第5音分别为收缩压(SBP)、舒张压(DBP),连续测定2次取均值。30~60 s内研究对象自主从平卧位向直立位转变,右上臂上抬,保持袖带水平至左心房水平,平均动脉压(MAP)=(SBP+2×DBP)/3。 经颅多普勒超声检查:所有研究对象要求12 h内禁止吸烟、饮酒或咖啡等,2 h前禁食。2 Hz颞窗探测左或右侧大脑中动脉血流速度(深度40~65 mm),调整记录探头置颞窗位置和探头大致角度,记录平卧位大脑中动脉平均血流速度(MCA-Vm-卧)和搏动指数(PI-卧);30~60 s 中,研究对象自主从平卧位向直立位转变,记录直立位时MCA-Vm-立、PI-立,计算△MCA-Vm、△MAP、△PI。
1.2.4 UPDRS Ⅲ评分 UPDRS量表是PD病情严重程度评估量化指标[6],总分199分,分数越高代表病情越重,量表包括4个部分,分别为精神、行为、情绪,日常生活,运动,并发症,本研究主要评定第3部分,运动症状评分4~76分,运动症状部分包括言语、面部表情、强直、静止性震颤、手部运动性或姿势性震颤、手运动、手指拍打试验、腿部灵活性、轮替动作、起立、步态、姿势、姿势稳定性、躯体少动。
2 结 果
2.1 PD组与对照组BPV指标水平比较 两组BPV指标24 hDBPSD、dDBPSD、nDBPSD水平比较差异均无统计学意义(P>0.05);PD组24 hSBPSD、dSBPSD、nSBPSD水平均高于对照组,差异有统计学意义(P<0.05)。详见表1。

表1 PD组与对照组BPV指标水平比较(±s) 单位:mmHg
2.2 PD组与对照组HRV指标水平比较 PD组HRV指标SDNN、RMSSD、HF、LF水平均低于对照组,差异均有统计学意义(P<0.05)。详见表2。

表2 PD组与对照组HRV指标水平比较(±s)
2.3 PD组与对照组脑血管自动调节情况及UPDRS Ⅲ评分比较 PD组脑血管自动调节指标MCA-Vm-卧、MCA-Vm-立、MAP-立水平低于对照组,MAP-卧、PI-卧、PI-立水平高于对照组,由平卧位转为直立位过程中△MCA-Vm、△MAP、△PI大于对照组,差异均有统计学意义(P<0.05)。详见表3。

表3 PD组与对照组脑血管自动调节情况比较(±s)
2.4 PD病人心血管自主神经功能与脑血管自动调节及UPDRS Ⅲ评分的相关性 PD病人脑血管自动调节△MCA-Vm、△MAP水平与心血管自主神经功能BPV指标24 hSBPSD、dSBPSD、nSBPSD呈正相关,与HRV指标SDNN、RMSSD、HF、LF水平呈负相关,UPDRS Ⅲ评分与HRV指标HF、LF水平呈负相关。详见表4。
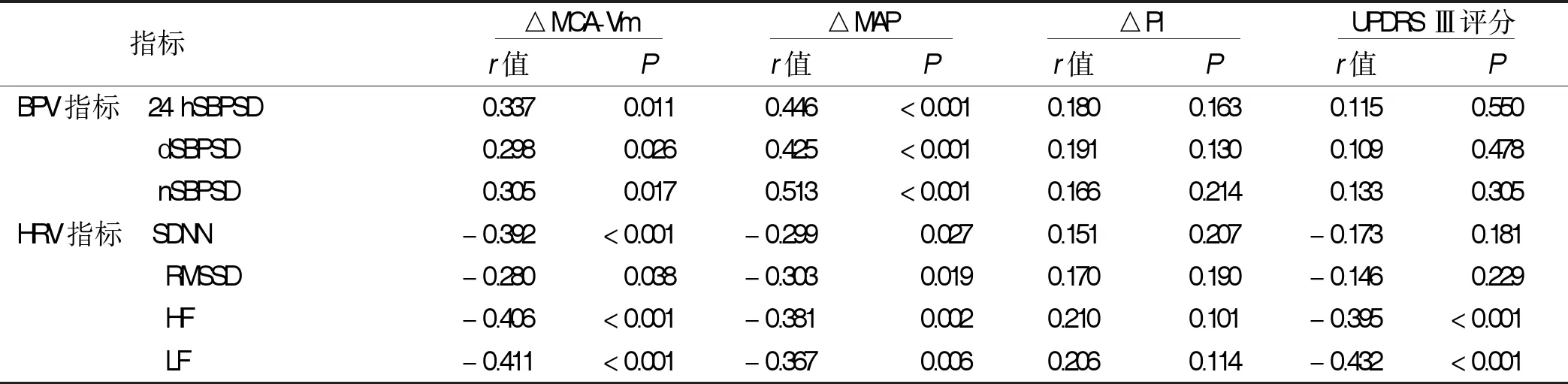
表4 心血管自主神经功能与脑血管自动调节及UPDRS Ⅲ评分的相关性
3 讨 论
研究认为,心血管自主神经障碍机制至少包括心脏去交感神经支配、心脏外去交感神经支配、动脉压力感受性反射障碍3个方面[7]。BPV和HRV为近年来受到临床广泛关注的非侵入性检查方式,BPV指一定时间范围血压波动幅度;HRV则为逐次心跳周期差异,HRV升高表示自主神经调节能力增强,HRV减少代表自主神经系统异常[8-9]。本研究结果显示,BPV指标中,与对照组比较,PD组24 hDBPSD、dDBPSD、nDBPSD水平未出现明显变化,但24 hSBPSD、dSBPSD、nSBPSD水平均升高,表明PD病人BPV增大,且以收缩压变异为主,压力感受器敏感性、内分泌激素、睡眠等均可影响BPV水平,压力反射敏感性减弱BPV增大,睡眠使BPV降低。PD病人动脉压力敏感性衰减、夜间睡眠障碍等使BPV水平增加[10-11]。HRV指标中,SDNN、LF以及RMSSD、HF分别反映了交感神经和迷走神经的活性和张力,PD组SDNN、RMSSD、HF、LF水平均低于对照组,提示神经损害的发生。
有研究显示,健康人保持站立后5 min即出现显著体位性下降,60 s内即出现动脉压降低,而伴有自主神经功能障碍者下降趋势更为明显[12]。也有研究认为,伴自主神经功能障碍者血压降低,脑灌注保持能力受损,搏动指数增高[13]。经颅多普勒超声结合体位改变可有效对脑血管自动调节能力进行评估,本研究分析病人平卧位转为直立位MCA-Vm、MAP、PI变化,结果显示,相较于对照组,PD组△MCA-Vm、△MAP、△PI均处于较高水平,PD组在体位改变时血压反射性调节能力较差。进一步分析△MCA-Vm、△MAP、△PI与心血管自主神经功能的关系,结果显示,△MCA-Vm、△MAP与BPV指标 24 hSBPSD、dSBPSD、nSBPSD水平呈正相关,与HRV指标SDNN、RMSSD、HF、LF水平呈负相关。PD病人外周及中枢血压调节能力减弱,心血管自主神经障碍程度与脑血管自动调节损伤程度相关。
Terrens等[14]研究发现,PD病程、Hoehn-Yahr分期及UPDRS Ⅲ评分与血压变异系数呈正相关,心血管自主神经障碍与PD病程、疾病严重程度有关。本研究中PD病人UPDRS Ⅲ评分与心血管自主神经功能HRV指标HF、LF水平呈负相关,与上述研究结果一致,说明随着PD病人心血管症状加重,运动症状也更加明显。随着心血管症状加重,受累多巴胺能神经元范围增大,对运动功能的影响也增大,运动障碍程度越重,路易小体在黑质中沉积,延髓迷走神经背核等与自主神经功能障碍相关部位路易小体沉积也更多,自主神经症状也越重[15]。
综上所述,PD病人存在心血管自主神经功能障碍,且心血管自主神经功能障碍越严重,病人脑血管自动调节损伤程度越高,自主神经参与脑血管自动调节,同时病人的自主神经功能障碍与运动症状之间存在关联。

