基于Nrf2/ARE信号通路探究人参皂甙Rg3对高糖诱导HMC细胞纤维化及生物活性作用机制*
吴胜斌 曹振东 王应灯 王蕾 蒉纲
(上海交通大学医学院附属第九人民医院 1.肾脏内科;2.中医科,上海 200011)
糖尿病肾病(Diabetic nephropathy,DN)是糖尿病患者最常见并发症之一,数据[1]显示,我国糖尿病患者35%以上会发展为糖尿病肾病。目前,临床上一般采用控制饮食、生活方式及降糖药物等控制患者血糖,以此延缓发展为DN的速度,但并不能从实质上对糖尿病肾病进行治疗[2]。糖尿病患者发展为损伤的机制较为复杂,目前学者们一致认为主要因素为高糖、高血压导致的代谢异常和血流动力学改变[3]。肾小球系膜细胞过度增殖、细胞外基质聚集等是DN早期重要的病理表现,其中肾小球系膜细胞和DN的发展密切相关[4]。近年来研究[5]发现,肾小球系膜细胞会因多种不同因素刺激而造成损伤,例如高糖、超氧化物、炎性因子、血管紧张素Ⅱ等,最终导致患者发展为糖尿病肾病。因此以人肾小球系膜细胞(Human mesangial cells,HMC)为研究对象,寻找合适的药物修复其在特殊情况下导致的损伤具有重要的科研意义。人参皂苷是人参中有效活性成分之一,在抗炎、抗氧化等中发挥多种药理作用[6-7]。有研究证实,人参皂苷Rg3可保护糖尿病大鼠的肾脏,并有效延缓纤维化的发展,在多种肾疾病中均有很好的保护作用[8]。目前DN的发病机制尚未完全阐明,有研究证实氧化应激和炎症反应是DN发展中不可或缺的两个驱动因素。核因子NF-E2相关因子(Nrf2)是转录因子中的一种,介导氧化应激通路,当Nrf2和抗氧化物反应元件(Antioxidant response elements,ARE)进行相互作用时,促进抗氧化蛋白、Ⅱ相解毒酶的表达,同时对体内氧化应激产生的自由基能有效清除,进而对细胞的氧化还原状态进行维持;相反Nrf2的缺失会减少机体内的抗氧化酶,加重细胞中氧化应激的负效应,进而对氧化应激性纤维化疾病进行诱导[9-10]。本研究探讨人参皂苷Rg3对高糖诱导肾小球系膜细胞纤维化、生物活性及Nrf2/ARE信号通路的作用。
1 材料与方法
1.1 实验材料
1.1.1 细胞系 人肾小球系膜细胞购自中国上海科学院。
1.1.2 试剂和仪器 人参皂苷Rg3(山东靶点药物研究有限公司);Nrf2、ARE多克隆抗体(美国Santa Cruz Biotechnology公司);胎牛血清、RPMI-1640培养基(美国Gibco公司);MTT试剂(广州康盛生物科技股份有限公司);MoFlo XDP流式细胞仪(Beckman Coulter公司);150i二氧化碳培养箱(美国Thermo Fisher公司);TDZ4台式低温离心机(湖南赫西仪器装备有限公司);电子分析天平(美国丹佛仪器公司)。
1.2 细胞培养和分组 常规复苏人肾小球系膜细胞,将细胞接种于含10%胎牛血清的DMEM培养基中,于37℃、5%CO2及饱和湿度的孵育箱中培养。细胞贴壁生长,2~3 d传代,当细胞生长达到60%~80%融合状态时,取对数生长期的细胞用于实验。将人肾小球系膜细胞分NC组(用含5.6 mmol/L葡萄糖的培养基培养HMC细胞48 h)、HG组(用含30 mmol/L葡萄糖的培养基培养HMC细胞)、Rg3A组(用含30 mmol/L葡萄糖+10 μmol/L的培养基培养HMC细胞)、Rg3B组(用含30 mmol/L葡萄糖+30 μmol/L的培养基培养HMC细胞)、Rg3C组(用含30 mmol/L葡萄糖+50 μmol/L的培养基培养HMC细胞)。
1.3 MTT法检测细胞增殖 取对数生长的人肾小球系膜细胞,消化后接种于96孔板内,置于常规培养箱中分别配于12、24、48、72 h。将新鲜配制的5 g/L MTT溶液分别加入到空版内,弃掉上清液,将150 μL二甲基亚砜加入到各孔的细胞中,溶解甲瓒。测定酶标仪于490 nm处的吸光度值。
1.4 Transwell侵袭实验检测细胞侵袭能力 将各组细胞置于24孔板内,每组设4个复孔,培养48 h后,将Matrigel基质胶稀释1倍后均匀的铺在Transwell小室的上室微孔膜上,于常规培养箱孵育4 h。收集各组HMC细胞制成单细胞悬液,调整细胞密度为2×105/mL,常规培养箱饥饿培养细胞24 h。在上室中加入不含血清的饥饿培养细胞悬液,同时上室加入0.1%BSA,将500 μL含15%FBS的DMEM培养基加入到Transwell小室的下室中,培养36 h,用棉签将上室上面的非侵袭细胞及基质胶擦拭干净,于4%多聚甲醛室温固定30 min,0.01%伊红染色液37℃染色30 min,悬挂晾干小室并置于载玻片上,倒置显微镜下随机读取10个高倍视野,计算穿模细胞数并取均值。
1.5 流式细胞仪检测细胞凋亡及细胞周期水平 取各组细胞,培养48 h后,用胰蛋白酶消化,PBS溶液洗涤细胞并重悬,用5 μL膜联蛋白V-FITC和10 μL PI于室温环境中染色细胞,15 min后孵育细胞,用流式细胞仪检测细胞。凋亡细胞用膜联蛋白V表达标记,和对照组比较后计算细胞的凋亡率。将各组细胞用冰冷的70%乙醇固定,PBS重悬细胞,将RNA酶加入到细胞中,于37℃环境中孵育细胞,30 min后将细胞置于400 μL PI中,室温培养细胞40 min。用流式细胞仪分析G0、G1、S、M中不同相中的细胞。
1.6 ROS水平检测 采用荧光探针DCFH-DA法检测细胞内ROS水平。取各组细胞,培养48 h后,并悬浮于1 mL终浓度为10 μmol/L的DCFH-DA液中,置于37℃培养箱避光孵育。30 min后离心细胞(1000 r/min,5 min)和PBS洗涤,上流式细胞仪488 nm激发波长、525 nm发射波长检验荧光强度(FI),间接检测ROS含量。
1.7 蛋白质印迹检测细胞中Nrf2/ARE信号通路相关蛋白 Nrf2、HO-1蛋白表达及TGF-β、Ⅳ-C、FN的表达取各组细胞,培养48 h后裂解,离心裂解后的细胞,收集上清液,用BCA法测定上清液中的蛋白浓度。将5×上样缓冲液加入到细胞中,煮沸细胞至变性,保存于-80℃环境中。取5 μL蛋白样品并电泳,待半干时转移到PVDF膜上,脱脂奶粉(5%)封闭1 h,用特异性抗体孵育膜过夜(4℃),用对应的二抗继续孵育2 h。用ECL法检测,并分析蛋白条带灰度值。

2 结果
2.1 各组细胞增殖能力比较 HG组细胞增殖活性较NC组显著增加(P<0.05);与HG组相比,Rg3A组、Rg3B组、Rg3C组细胞增殖活性均显著降低(P<0.05);Rg3C组细胞增殖活性低于Rg3B组,Rg3B组细胞增殖活性低于Rg3A组(P<0.05)。见图1。

图1 细胞增殖能力比较
2.2 各组细胞侵袭能力比较 NC组细胞侵袭数量为(1.10±0.10)个,与NC组相比,HG组细胞侵袭数量[(51.32±5.14)个]显著增加(P<0.05);与HG组相比,Rg3A组(34.67±4.08)个、Rg3B组(19.36±2.94)个、Rg3C组(6.82±1.17)个细胞侵袭数量均逐渐降低(P<0.05);Rg3C组细胞侵袭数量均低于Rg3A组和Rg3B组。见图2。
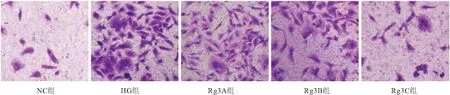
图2 Transwell小室法检测细胞侵袭数量
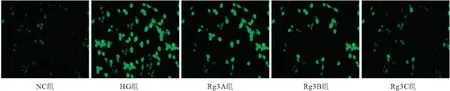
2.3 各组细胞凋亡能力和周期比较 HG组细胞凋亡率较NC组显著降低(P<0.05);与HG组相比,Rg3A组、Rg3B组、Rg3C组细胞凋亡率均显著增加,且呈递增趋势(P<0.05),且Rg3C组细胞凋亡率明显高于Rg3A组和Rg3B组(P<0.05)。HG组细胞G1期明显高于NC组(P<0.05);与HG组相比,Rg3A组、Rg3B组、Rg3C组细胞G1期均显著降低(P<0.05);Rg3C组细胞G1期 表1 各组细胞凋亡能力和周期比较 图3 流式细胞仪检测细胞凋亡 2.4 各组细胞中ROS含量比较 NC组细胞中ROS含量为(1.00±0.11),与NC组相比,HG组细胞中ROS含量(110.23±5.15)显著增加(P<0.05);Rg3A组(72.81±4.06)、Rg3B组(56.27±2.97)、Rg3C组(23.46±1.38)细胞中ROS含量显著低于HG组(P<0.05);与Rg3A组和Rg3B组相比,Rg3C组细胞中ROS含量最低(P<0.05)。见图4。 图4 显微镜下细胞内活性氧荧光强度(DCFH-DA探针染色,200×) 2.5 各组细胞中Nrf2、HO-1蛋白表达及TGF-β、Ⅳ-C、FN表达 与NC组相比,GH组细胞中Nrf2/ARE信号通路相关蛋白Nrf2和HO-1蛋白表达均显著降低(P<0.05);与GH组相比,Rg3A组、Rg3B组、Rg3C组细胞中Nrf2、HO-1蛋白表达均显著增加,且Rg3C组细胞中蛋白表达增加最显著(P<0.05)(见图5A、图5B)。与NC组相比,GH组细胞中TGF-β、Ⅳ-C、FN明显增加(P<0.05);与GH组相比,Rg3A组、Rg3B组、Rg3C组细胞中TGF-β、Ⅳ-C、FN表达均显著降低,且Rg3C组低于Rg3B组低于Rg3A组(P<0.05)。见图5C、图5D。 图5 各组细胞中Nrf2、HO-1蛋白表达及TGF-β、Ⅳ-C、FN表达 糖尿病肾病是糖尿病患者中最严重的一种微血管并发症[11]。系膜细胞是肾小球内固有的活跃功能细胞,其过度增殖是糖尿病肾病中重要的病理特征。有研究发现,高糖可诱导系膜细胞的过度增殖,并对糖尿病肾病的发展有明显的促进作用[12]。有学者们研究发现,高糖诱导的系膜细胞是观察细胞增殖最优的体外模型。因此,本研究采用人肾小球系膜细胞作为实验细胞,同样用高糖诱导系膜细胞发现其发生过度增殖,和前文结果一致。 文献显示,中医可有效治疗糖尿病肾病且疗效确切,虽然部分中药的成为较复杂,但中药在临床上的治疗不仅可以对临床症状进行改善,缓解患者的病情,而且还能对患者的肾脏进行保护。近些年,随着天然药物化学等领域的兴盛,中药在治疗糖尿病肾病的治疗上显现出广阔的应用前景。人参皂苷Rg3主要提取于人参,是其中重要的活性成分之一,在减轻炎症反应、氧自由基和抗氧化等中有很好的疗效[13]。有学者研究发现,DN大鼠的肾脏病理损伤可用过人参皂苷Rg3进行改善,同时对大鼠的血糖、肌酐、24 h蛋白尿具有很好的抑制作用,进而对肾脏进行保护[14]。本研究发现,人参皂苷Rg3能有效调控系膜细胞的生物学活性,提示其对肾小球系膜细胞的过度增殖有很好的抑制作用。冀楷等[15]研究证实,人参皂苷Rg3可有效抑制高糖诱导的系膜细胞增殖,可预防并治疗糖尿病肾病的发生发展,进而发挥肾脏保护作用。TGF-β是高糖以及一些导致肾脏损伤的生化因素的重要递质,介导糖尿病肾病的生物活性等,TGF-β可作为检测肾间质纤维化成为的指标之一[16]。Ⅳ-C是肾小球基底膜胶原中重要成分之一,是基质胶原中最典型的一种,可由多种细胞分泌和合成,例如活化的肾小球系膜细胞、上皮细胞等,因此Ⅳ-C合成和降解平衡出现失调,可导致糖尿病肾病肾小球发生病理性改变。FN是组成细胞外基质的部分之一,正常状态下系膜细胞会产生少量FN,在病理情况下系膜细胞产生FN的含量增多。本研究结果显示,不同浓度的人参皂苷Rg3均可抑制细胞中TGF-β、Ⅳ-C、FN表达。吴胜斌等[17]研究证实,人参皂苷Rg1可通过上调肾间质HGF水平,抑制TGF-β1表达来延缓肾间质纤维化进展,发挥肾组织保护作用。 有学者研究发现,ROS是氧化应激中高活性分子之一,对肾细胞损伤有一定促进作用,且高糖会促进ROS的生成,进而破坏肾小球滤过膜,诱导蛋白尿的发生;大量的ROS会激活细胞内的转导信号,增加ECM蛋白合成,减少其降解,进而对糖尿病肾病起促进作用[18]。Nrf2/ARE为机体内重要的抗氧化信号通路,Nrf2可通过对ARE依赖的第Ⅱ相解毒酶基因和抗氧化基因的转录活性进行调控,如SOD、HO-1等,进而对氧化应激反应进行抑制。有研究[19]证实,Nrf2在组织对抗糖尿病氧化应激损伤中起着重要作用。本研究结果显示,不同浓度的人参皂苷Rg3均可抑制细胞中ROS含量,同时增加细胞中Nrf2和HO-1蛋白表达,提示人参皂苷Rg3能通过抑制ROS含量和调控Nrf2/ARE信号通路的相关蛋白,加强人肾小球系膜细胞的抗氧化能力,进而减轻DN导致的氧化损伤。赵颖丹等[20]研究发现,PM2.5诱导肾小管上皮细胞出现氧化损伤,黄芪甲苷可抑制细胞中氧化应激反应,其机制是通过调控Keap1-Nrf2-ARE信号通路来实现的。 人参皂苷Rg3可抑制高糖诱导的HMC细胞增殖、侵袭,促进HMC细胞凋亡,通过对细胞内Nrf2/ARE信号通路相关蛋白的调控加强系膜细胞的抗氧化能力。


3 讨论
4 结论

