多囊卵巢综合征相关microRNAs的研究进展
张珊,陈欢欢,张磊,崔趁趁,张翠莲*
(1.新乡医学院河南省人民医院,郑州 450003;2.河南省人民医院生殖中心,郑州 450003;3.河南省生殖医学工程国际联合实验室,郑州 450003)
多囊卵巢综合征(PCOS)是育龄期妇女中较常见的生殖内分泌疾病。据统计,全球范围内PCOS的患病率约为5%~10%[1]。PCOS常见特征是雄激素过多、月经紊乱、排卵功能障碍、卵巢多囊样改变,它是一种具有复杂病理特征的异质性综合征疾病,不仅与不孕症有关,还与代谢紊乱密不可分,可伴有胰岛素抵抗(IR)、糖尿病、肥胖和心血管疾病等[2],同时也是子宫内膜癌致病的高危因素[3]。目前已知遗传、环境、生活方式和心理(慢性焦虑和抑郁)等因素参与PCOS的发生发展,但其内在的分子机制尚不清楚[4]。
microRNAs(miRNAs)是一种小的单链非编码RNA,大小在19~25个核苷酸之间,在转录后调节基因表达,可以调节靶基因的转录沉默;一个miRNA可以靶向数百个mRNAs,可同时影响某些特定途径上关联基因的表达[5]。研究表明,miRNAs序列具有高度保守性,有助于调节不同生物体的多种生物学功能,如细胞凋亡、增殖、分化、发育、细胞周期、干细胞维持、代谢和造血等[6]。多项研究发现,其异常表达与多种疾病有关,如癌症[7]、自身免疫性疾病[8]、不孕症[9-10]等。miRNAs在几乎所有细胞中都发挥着关键性作用。研究发现,在人前脂肪细胞和分化的脂肪细胞中都存在不同的miRNA,特定的miRNA参与脂肪细胞的分化、脂肪代谢和胰岛素敏感性[11]。miRNAs在生物合成过程中,可以释放到细胞间隙,所以在血液、尿液、精液、卵泡液[12-15]等多种体液中可被检测。miRNAs不仅在各种体液中表现出显著的稳定性,还可以反映卵母细胞和卵泡壁的分泌及代谢活动[16]。大量研究表明,miRNAs与PCOS的发生发展有着密切的联系。本文将对PCOS相关差异表达miRNAs的研究进展作一综述。
一、miRNAs在PCOS患者血清中的异常表达
miRNAs在各种组织中的异常表达参与多种疾病的发生发展,其中血清中miRNAs的表达水平在同一物种中是相对稳定的[17]。Long等[6]通过对血清样本进行测序,筛选出不同组分间差异表达的miRNAs,经逆转录-定量PCR(qRT-PCR)方法检测出PCOS患者血清中miR-222、miR-146a和miR-30c的表达量显著增多;通过相关性分析显示miR-222与血清胰岛素水平呈正相关,miR-146a与血清睾酮值呈负相关;使用DIANA-mirPath计算工具识别出上述miRNAs靶基因参与转移、细胞周期、凋亡和内分泌通路,如Wnt信号通路、MAPK信号通路、Jak-STAT信号通路等。Nanda等[18]采用qRT-PCR方法检测了血清中miR-24、miR-29a和miR-502-3p的表达情况,与对照组相比,PCOS受试者血清中miR-24水平显著下调,miR-24与体质量指数(BMI)、血糖、黄体生成素(LH)、胰岛素、空腹胰岛素抵抗指数(FIRI)、稳态模型胰岛素抵抗指数(HOMA-IR)、睾酮、甘油三酯(TG)水平及黄体生成素/卵泡刺激素(LH/FSH)比值呈显著负相关,而高密度脂蛋白(HDL)水平与miR-24呈显著正相关,miR-24在PCOS的诊断方面具有重要意义。Lin等[19]研究发现,miR-23a在PCOS患者血清中异常低表达,于cov434细胞内转染miR-23a模拟物及抑制物后,通过流式细胞术检测发现miR-23a过表达可诱导cov434细胞G0/G1期细胞周期阻滞并促进细胞凋亡,这一过程是miR-23a靶向调节FGD4参与完成的;研究还表明,miR-23a诱导cov434细胞CDC42/PAK-1信号通路的激活,此通路参与调节细胞增殖、凋亡和细胞周期,可能在PCOS患者的生理病理过程中具有重要意义。有研究报道了miR-320在PCOS患者血清中低表达,这一表现在PCOS合并IR的患者中更明显,Logistic回归分析显示miRNA -320表达水平与PCOS独立相关[20]。
二、miRNAs在PCOS患者血浆中的异常表达
血浆因其成分的特殊性,作为体外样本时常需要添加抗凝剂,因此限制了其在实验中的应用,但与血清相比,血浆更能代表患者的体内状态[21]。Pourteymour Fard Tabrizi等[22]通过生物信息学分析得出miR-27a、miR-130b和miR-301a与PCOS存在相关性,经qRT-PCR方法验证了PCOS组及对照组患者血浆样本中3种miRNAs的差异表达,并检验其对PCOS发病的敏感性及特异性,指出miR-27a对PCOS的诊断更有价值。近期一项基于全基因组测序结果的研究,分析了PCOS和对照组患者的RAB5B基因的8个位点后,发现rs1045435、rs11550558、rs705700和rs11171718位点的单核苷酸多态性与PCOS风险相关;经qRT-PCR方法检测了两组人群血浆中miR-24及miR-320的表达,其中miR-24在PCOS患者血浆中高表达,而miR-320呈现为低表达,并指出rs1045435可能是miR-24的结合位点,rs11550558、rs705700、rs11171718可能为miR-320的结合位点[23]。
三、miRNA在PCOS患者卵泡液中的异常表达
卵泡液为卵母细胞成长发育提供必需的营养物质及微环境,在生殖功能中发挥着重要作用[24-25]。在一项病例对照研究中经高通量测序分析了PCOS组与对照组卵泡液中miRNAs的表达谱,其中miR-29a-3p、miR-151-3p及miR-518f-3p在PCOS组中低表达,miR-29a-3p通过抑制磷酸酯酶和张力蛋白同源物(PTEN)参与调节细胞生长发育,与PCOS患者卵泡生长和卵泡发育受阻相一致;miR-151-3p与总雄激素和游离雄激素水平显著负相关,并参与多种癌症的发病;研究中有miRNAs表达不一致的情况,推测由PCOS的异质性、使用不同PCOS诊断标准或种族差异等因素引起[26]。近期Butler等[27]在一项前瞻性队列研究中,从卵泡液中检测到176个miRNAs,其中29个miRNAs在PCOS患者和正常对照组中存在显著差异;PCOS患者卵泡液中miR-382-5p与年龄和游离雄激素水平相关,miR-199b-5p与抗苗勒管激素(AMH)水平相关,miR-93-3p与C反应蛋白相关。
四、miRNA在 PCOS患者壁层颗粒细胞中的异常表达
卵母细胞和其周围的颗粒细胞(GCs)是相互依存的,PCOS患者GCs存在增殖减少、凋亡增加、激素分泌紊乱等病理现象,与卵泡发育异常密切相关[28-29]。Fu等[30]研究发现,PCOS患者卵巢皮质和血清中miR-16表达下调,miR-16过表达后通过靶向程序性细胞死亡蛋白4(PDCD4)以促进GCs细胞生长和抑制细胞凋亡;睾酮使miR-16表达下调和PDCD4表达上调,可抑制GCs生长和促进凋亡。Sun等[31]研究发现,PCOS患者GCs中miR-204表达下调,通过miR-204模拟物或抑制物转染KGN细胞来实现miR-204的过表达和表达的敲降,经流式细胞术分析KGN细胞的细胞周期情况,证实了miR-204对KGN细胞G2/M期阻滞和诱导凋亡的重要作用;并且miR-204与翻译控制的肿瘤蛋白(TPT1)直接作用,通过直接靶向和降解KGN细胞中的TPT1来抑制细胞增殖。He等[32]通过qRT-PCR方法检测出PCOS患者GCs中miR-200b表达上调;向KGN细胞内转染miR-200b和miR-200c模拟物以实现过表达,CCK-8结果显示两者表达上调均可抑制KGN细胞增殖;qRT-PCR和蛋白免疫印记检测证实PTEN是KGN细胞中miR-200b和miR-200c的直接靶点;si-PTEN在转染48 h后显著降低了KGN细胞中PTEN mRNA及蛋白的水平,CCK-8结果显示PTEN下调显著抑制KGN细胞的增殖,这为PCOS患者GCs异常增殖提供相关分子证据。
五、miRNA在 PCOS患者卵丘颗粒细胞中的异常表达
Shi等[33]取PCOS及对照组患者成熟卵母细胞后机械剥离收集卵丘颗粒细胞(CCs)样本,通过miRNA微阵列测序技术检测miRNAs的差异表达,筛选出有显著差异的miR-483-5p和miR-486-5p,qRT-PCR方法验证了其在PCOS患者CCs中的低表达,与miRNA芯片检测结果一致;使用生物信息学分析预测靶基因,并行qRT-PCR方法检测,结果显示与对照组相比,SOCS3、SRF、PTEN、FOXO1在PCOS患者CCs中表达上调;miR-483-5p作为编码在IGF2的第二个内含子中的保守序列,故IGF2在PCOS患者CCs中同样表达下调;利用DAVID工具对相关靶基因进行KEGG通路富集分析,最终miR-483被认定在改善IR中起重要作用,miR-486-5p可能通过激活PI3K/Akt信号通路促进CCs的增殖。张慧敏等[34]利用生物信息学方法预测了miR-1270的靶基因,再通过KEGG富集信号通路选定卵巢类固醇激素生成途径上的限速酶细胞色素P450 19A1(CYP19A1)为目标靶基因;收集了PCOS与非PCOS不孕患者的CCs,qRT-PCR方法检测了两者在组间的表达,结果显示miR-1270在PCOS患者CCs中表达量降低,CYP19A1的表达量升高;向KGN细胞内转染miR-1270的模拟物及抑制剂后进行双荧光素酶报告基因检测及蛋白质印迹实验,证实了两者的靶向关系,在KGN细胞培养基中检测到雌二醇(E2)的水平差异。miR-1270对CYP19A1的负性调控影响PCOS患者CCs中E2的生成。
六、miRNA在PCOS患者(血清/血浆/卵泡液)外泌体中的异常表达
研究发现,携带大量生物活性物质(包括调节性RNA)的外泌体可被邻近细胞吸收或进入循环系统,并到达遥远的部位影响受体细胞的生物行为。外泌体传递到受体细胞的mRNA可以被翻译成蛋白质,被认为是细胞-细胞通讯的重要介质[35-36]。王洁等[37]提取了PCOS与非PCOS患者血清中外泌体,经高通量测序技术检测到差异表达miRNAs共有 243 个,其中表达上调有115个、下调128个,对10个差异显著miRNAs进行了qRT-PCR检测,其中miR-378d、miR-378b、miR-4772-3p在PCOS患者血清外泌体中表达上调,miR-5090、miR-3680-3p、miR-6836-5p表达下调;将PCOS患者血清外泌体差异表达miRNAs进行GO富集分析及KEGG功能注释,结果显示这些差异表达miRNAs与类固醇激素的合成有关,可参与调节胰岛素信号受体通路。Jiang等[38]收集了PCOS与对照组患者血浆进行了外泌体miRNA测序分析,根据测序结果选取差异显著的miRNAs,通过GO分析和KEGG通路富集显示差异表达的miRNAs主要富集在轴突导向、丝裂原活化蛋白激酶(MAPK)信号传导、胞吞作用、昼夜节律和癌症等途径;其中miR-20b-5p、miR-106a-5p及 miR-18a-3p表达上调,miR-126-3p和miR-146a-5p表达下调,将这5种miRNAs与PCOS表型进行相关性分析,显示miR-20b-5p、miR-106a-5p和miR-18a-3p的表达与血浆睾酮水平呈负相关,miR-18a-3p与窦卵泡计数(AFC)、AMH浓度、LH水平和LH/FSH比值也呈负相关,而miR-146a-5p和miR-126-3p的表达与AFC和AMH浓度呈正相关。这些差异表达的血浆外泌体miRNAs有助于PCOS的诊断及致病风险性预测。Yuan等[39]使用差速离心法提取了 PCOS与对照组患者卵泡液外泌体,通过测序技术发现25个miRNAs存在组间差异,miRNA谱的改变与IR、细胞生长和增殖、细胞衰老和胰岛素信号通路等相关联;筛选出miR-424-5p作为研究靶标,通过qRT-PCR检测方法发现miR-424-5p均在PCOS患者卵泡液外泌体和原代GCs中低表达,miR-424-5p可促进GCs衰老并抑制细胞增殖,在转染miR-424-5p模拟物的KGN细胞中观察到同样的结果;对miR-424-5p的靶基因进行预测,确定为细胞分裂周期相关4(CDCA4)基因,双荧光素酶报告检测结果表明外泌体miR-424-5p通过阻断CDCA4介导的Rb/E2F1信号,抑制GCs增殖并诱导PCOS细胞衰老。Cui等[40]为了研究PCOS和非PCOS患者的卵泡液、血清中外泌体miRNAs表达谱,通过miRNA探针微阵列技术及测序结果选取异常表达的miRNA进行qRT-PCR验证,发现其中7个miRNAs(miR-15b-5p、miR-34a-5p、miR-3148、miR-3646、 miR-3976、 miR-4271、 miR-4481)在PCOS患者卵泡液中显著高表达,对这些miRNAs的靶基因进行GO分析和KEGG通路富集,显示它们参与MAPK信号通路和卵母细胞减数分裂。Zhang等[41]通过测序及序列技术显示PCOS患者血清外泌体中差异表达miRNAs有54个,使用qRT-PCR方法测量这些miRNAs的表达情况,其中miR-1299和miR-6818-5p表达显著上调,miR-1925p和miR-145-5p表达显著下调;通过GO分析和KEGG通路富集探究这些差异miRNAs靶基因的分子生物学功能及基因通路,发现它们主要参与轴突导向、肿瘤通路和MAPK信号通路等,认为外泌体miRNAs有望成为PCOS临床诊断的新型分子生物标志物。
以上为多种miRNAs在PCOS患者不同体液、组织中的差异表达情况(相关细节总结于表1),这些研究表明,miRNAs在调控细胞增殖与凋亡、激素合成、卵泡发育障碍及卵母细胞功能等方面起着关键性作用。一些miRNAs被证实与PCOS表型相关,对其功能的研究为PCOS的发病机制提供一定的理论基础,可作为新型非侵入性生物标志物。
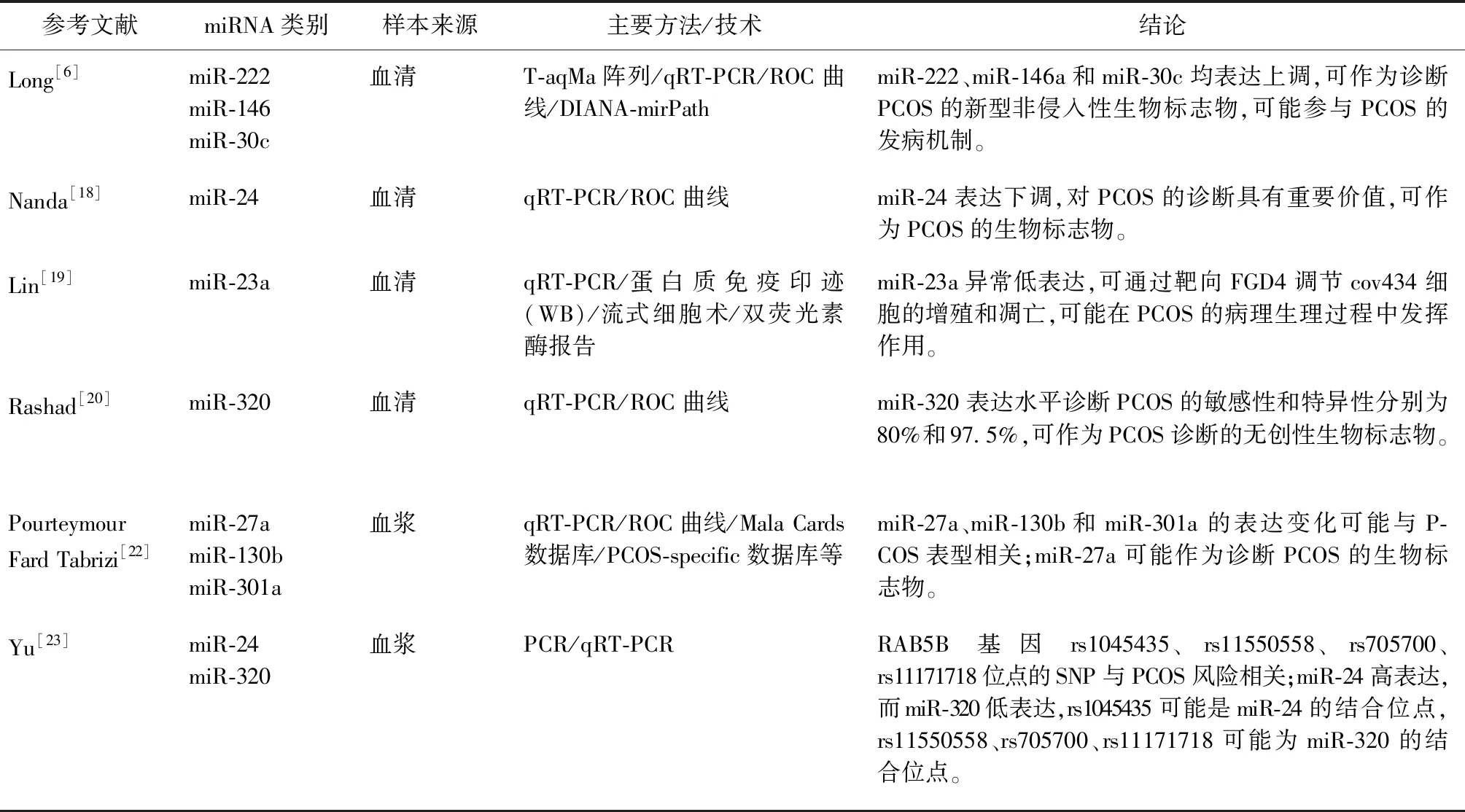
表1 PCOS患者体液/组织中差异表达miRNAs汇总

续表

续表
七、小结与展望
综上所述,miRNAs在血液、卵巢及外泌体中的差异表达对PCOS疾病的诊断、治疗及预后等存在特殊的意义。miRNAs可通过调控靶基因在特定的通路中传递特殊信息来影响PCOS的发生发展,可为PCOS患者卵泡发育异常和生育力低下等的发病机制提供理论基础,有望成为生殖领域诊断性标志物和治疗靶点。未来期望可以通过对某些特定miRNA的检测来达到明确PCOS发病机制、治疗及改善预后等目标,这一过程需要更多更深入的研究来实现。
所有作者均声明不存在利益冲突。

