大麦气孔发育相关基因HvSPCH的克隆及初步功能分析
次尔甲玛,王宏鹏,苟筱颖,佟可心,郭瑞超,王俊斌,曹高燚,包曙光,谢晓东,陈小强
(天津农学院农学与资源环境学院,天津 300384)
大麦()是禾本科作物,一年生,具有耐贫瘠、抗旱、抗寒、耐盐等特点。 其含有多种营养物质,是重要的粮食和饲料作物,还具有药用价值。气孔是植物叶表皮上可以调节的小孔,其大小、密度、模式及开关速度等均可影响植物的光合作用、蒸腾作用、碳循环等生理过程,对调控植物适应环境方面起着非常重要的作用。大麦属于单子叶植物,其成熟的气孔同双子叶植物气孔不同,是由两个哑铃状的保卫细胞及其两侧的两个副卫细胞组成,被称为气孔复合体,呈线性排列(双子叶植物为不规则排列)。
气孔的形成与发育受碱性螺旋-环-螺旋(bHLH)类转录因子的调控,包含SPCH、MUTE和FAMA三种转录因子,其中SPCH转录因子调控部分植物原表皮细胞进入气孔发育系统,发生不对称分裂,使拟分生组织母细胞(meristemoid mother cell,MMC)形成拟分生组织细胞(meristemoid cell,MC);MUTE转录因子调控MC分化为保卫母细胞(guard mother cell,GMC),GMC进行对称分裂;而FAMA转录因子调控GMC分化为气孔的保卫细胞(guard cell,GC),并阻止细胞进一步分裂,终止气孔发育系统。
植物SPCH转录因子的功能丧失会对气孔的间距、密度和位置产生很大的影响,甚至可以改变叶肉的结构。而一些蛋白酶、受体蛋白和负调控因子及光、温等环境因子会抑制SPCH转录因子的表达,影响气孔分裂并最终降低气孔密度。以上对SPCH转录因子的功能研究多集中在双子叶植物拟南芥上,并取得了一些进展。但由于单子叶植物和双子叶植物的气孔在形态、模式、运动和发育过程上存在差异,推测SPCH转录因子在两类植物中的具体功能方面也存在特异性差异。本研究对大麦SPCH转录因子基因()进行克隆,并对其进行生物信息学分析,以期揭示大麦乃至禾本科植物中气孔发育的分子机制。
1 材料与方法
1.1 试验材料
试验材料为大麦品种G1614。大麦种子用75%酒精处理1 min,25%的NaClO处理30 min以及30%的HO避光处理30 min后,置于有湿润滤纸的培养皿中,然后放入生长室(温度24 ℃、湿度70%、光照(光照强度为3 000 lx) 10~14 h)中培养17 h(大麦苗开始生根),再用30% PEG6000进行干旱胁迫处理,取处理4、12和 20 h的大麦苗叶基部,以相应培养时间无干旱胁迫处理的大麦苗叶基部为对照;处理2 d后,取叶基部进行后续研究。
1.2 方 法
1.2.1 大麦苗总RNA的提取及cDNA的合成
将30% PEG6000处理4、12和20 h的大麦苗叶基部剪下,迅速置于液氮中,快速研磨成粉末状,使用Plant Total RNA Isolation Kit试剂盒(生工,上海)提取大麦总RNA,用1%琼脂糖凝胶电泳和紫外凝胶成像仪检测其质量,用核酸分析仪检测其浓度。参照Thermo反转录试剂盒(生工,上海)将RNA反转录成cDNA,于-20 ℃保存,备用。
1.2.2基因的克隆
从NCBI网站(http://www.ncbi.nlm.nih.gov/gorg/gorf.html)下载基因序列(ID: HORVU.MOREX.r2.7HG0587740.1),从NCBI的ORF finder程序(https://www.ncbi.nlm.nih.gov/orffinder/)查找基因的编码区序列,然后在Primer 3 Plus网站(https://www.primer3plus.com/index.html)设计引物ZC-L(5′-ATGGGAGATGCGCTGTGC-3′)和ZC-R(5′-TTATGAGAACGTTTGCTGAATTTCT-3′),由上海生工生物工程股份有限公司合成。以提取的大麦苗cDNA为模板进行PCR扩增,PCR扩增体系为20 μL,包括cDNA模板1 μL,引物ZC-L、ZC-R各1 μL,Prime STAR Max Premin 10 μL,ddHO 7 μL。PCR扩增程序:98 ℃变性10 s,55 ℃退火15 s,72 ℃延伸73 s,30个循环;72 ℃延伸5 min。PCR产物经1.5%的琼脂糖凝胶电泳分离后,利用SanPrep柱式DNA胶回收试剂盒(生工,上海)进行胶回收纯化,然后送上海生工生物工程股份有限公司测序。
1.2.3 HvSPCH蛋白的生物信息学分析
用NCBI的CDD程序(http://www.ncbi.nlm.nih.gov/Structure/cdd/cdd.shtml)分析蛋白的保守结构域。用ProtParam在线软件(http://wbe.expasy.org/protparam/)分析蛋白的理化性质。用TMHMM在线软件(http://www.cbs.dtu.dk/services/TMHMM/)预测蛋白的跨膜结构域,用SignaIP 5.0在线软件(http://www.cbs.dtu.dk/services/SignalP/index.php/)分析蛋白的信号肽。用Netphos 3.1 server(http://www.cbs.dtu.dk/services/NetPhos/)预测蛋白的磷酸化位点。用GlycoMine在线软件(http://glycomine.erc.monash.edu/Lab/GlycoMine/)预测蛋白的糖基化位点。用SOPMA(https://npsa-parbi.ibcp.fr/)和SWISS-modle(http://swissmodle.expasy.org/interactive)分析蛋白的二级结构和三级结构。用Plant-mPloc和post prediction(http://www.csbio.sjtu.edu.cn/bioinf/Cell-PLoc-2/)在线软件进行亚细胞定位分析。利用NCBI的BLAST功能(https://blast.ncbi.nlm.nih.gov/Blast.cgi)下载与HvSPCH蛋白氨基酸相似性较高的同源蛋白序列,用MEGA 7构建系统进化树。
1.2.4 干旱胁迫对基因表达模式的影响
将反转录得到的cDNA(稀释 10 倍)作为模板,进行实时荧光定量PCR反应。用Primer 3 Plus网站设计荧光定量引物(SPCH-F:CCGAAGACTTATTCAGCATCC;SPCH-R:CTCATGCGATATTCCGTCAC)。以大麦为内参基因(引物序列为actin-F:TGGATCGGAGGGTCCATCCT;actin-R:GCACTTCCTGTGGACGATCGCTG),PCR反应体系为20 μL,包括2×UltraSYBR混合液10 μL,上、下游引物各0.4 μL,cDNA模板 2 μL,加水补足至20 μL。反应程序: 95 ℃ 预变性10 min;95 ℃ 变性15 s,60 ℃退火 1 min,40 个循环。PCR反应在ABI 7500 Fast qRT-PCR仪上进行,用2-ΔΔ法计算基因的表达量,3 次生物学重复,用Excel 软件对数据进行方差分析。
2 结果与分析
2.1 大麦幼苗叶基部总RNA的提取结果
提取的总RNA经琼脂糖凝胶电泳检测,结果(图1)显示,电泳条带清晰完整,无弥散条带,且28 S与18 S的亮度比值约为2,表明提取的大麦叶基部总RNA质量较好。经紫外分光光度计检测发现,提取的大麦叶基部总RNA浓度为315 ng·μL,A比值为2,符合试验要求,可用于后续的反转录试验。

图1 大麦叶基部总RNA的电泳图Fig.1 Electrophoresis results of total RNA extracted from the leaf base of barley
2.2 HvSPCH基因的克隆结果
以大麦叶基部总RNA反转录的cDNA为模板,用特异性引物ZC-L/R进行PCR扩增。结果(图2)显示,在大约1 500 bp处出现特异条带,与目的基因长度基本一致。PCR扩增产物经胶回收试剂盒回收纯化,送公司测序后获得一条长度为1 618 bp的序列。通过NCBI的ORF Finder程序对该序列进行分析,结果表明,该序列包含一个1 098 bp的完整开放阅读框,可编码365个氨基酸。此外,在该序列的上游和下游分别含有一段240 bp的5′非翻译区和一段280 bp的3′非翻译区。
2.3 HvSPCH蛋白的生物信息学分析
2.3.1 系统进化发育分析
通过在NCBI上对大麦HvSPCH蛋白和其他物种的SPCH蛋白进行对比,发现大麦HvSPCH蛋白序列与野生二粒小麦()、二穗短柄草()、水稻()的SPCH蛋白序列相似性较高,相似度在86.30%~95.08%之间。用Mega 7.0构建系统进化树,结果(图3)表明,大麦HvSPCH蛋白与小麦、水稻、二穗短柄草的SPCH蛋白亲缘关系较近,而与拟南芥()、高粱()和玉米()的亲缘关系较远。
2.3.2 理化性质及跨膜结构分析
利用Protparam在线软件对大麦HvSPCH蛋白的理化性质进行分析,结果表明,该蛋白的分子式为CHNOS,相对分子质量为90 504.73 Da,等电点(pI)为4.96,半衰期为4.4 h(体外),不稳定指数为50.49。该蛋白中半胱氨酸(34.8%)、甘氨酸(30.5%)、丙氨酸(19.95%)、苏氨酸(14.8%)的含量相对较多,脂肪系数为19.85,亲水性平均系数为1.001。综上结果表明,HvSPCH蛋白属于疏水、不稳定的碱性蛋白质。TMHMM和SignalP 5.0软件分析结果表明,HvSPCH蛋白不具有跨膜结构域和信号肽。

M:2K PlusⅡDNA Maker;1:HvSPCH基因的扩增产物。
2.3.3 保守结构域、亚细胞定位及磷酸化和糖基化位点预测
利用NCBI的CDD程序对大麦HvSPCH蛋白的保守结构域进行分析,发现该蛋白含有bHLH结构域,属于bHLH家族成员(图4)。利用Plant-mPloc进行亚细胞定位,推测大麦HvSPCH蛋白定位于细胞核中。利用Netphos 3.1 server在线软件对潜在磷酸化位点进行分析,发现该蛋白含有27个丝氨酸、12个苏氨酸和1个酪氨酸位点。利用GlycoMine软件对糖基化位点进行预测,发现该蛋白含有7个N-糖基化位点和20个O-糖基化位点。
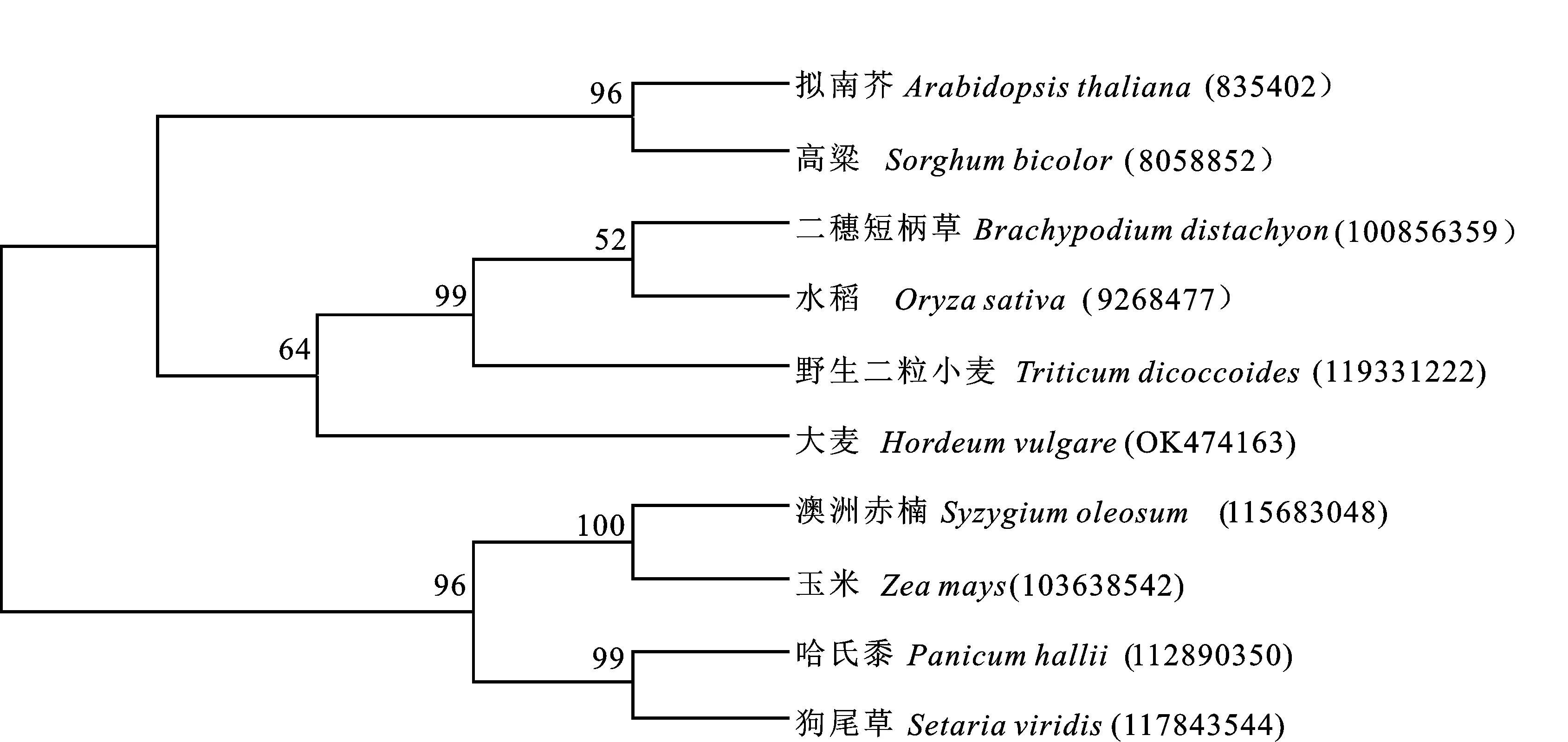
图3 大麦HvSPCH蛋白与其他物种SPCH的系统进化树

图4 HvSPCH蛋白的保守结构域分析
2.3.4 二级和三级结构预测
用SOPMA软件对HvSPCH蛋白的二级结构进行预测,发现该蛋白主要由α-螺旋、延长链、β-转角和无规则卷曲四种结构组成,其所占比例分别为35.62%、8.77%、2.47%和53.13%。用SWISS-model对HvSPCH蛋白的三级结构进行预测,发现HvSPCH蛋白的三维结构具有αβα模式,即典型的螺旋-环-螺旋(HLH)结构(图5)。

图5 HvSPCH蛋白的三级结构预测
2.4 干旱胁迫处理下HvSPCH基因的表达模式
qRT-PCR结果(图6)表明,对照处理中基因的表达量在各处理时间均较低,而且表达量几乎一致。在干旱处理条件下基因的表达量随处理时间的持续呈先升后降的变化趋势,在处理12 h时表达量最高,但在处理20 h时表达量又恢复至对照水平。基因的表达量在干旱处理4 h和12 h显著高于对照,在干旱处理20 h时与对照无显著差异。
3 讨 论
气孔是整个植物发挥功能所需的基本动态结构,可促进叶片内部和外部环境之间的气体交换,有助于调节温度和平衡光合需求,防止水分流失和保证CO的动态平衡。
气孔细胞系的启动和增殖由基因控制,基因在叶片中的表达量随着叶片发育年龄的增加而降低,且在成熟的叶片中不存在。在双子叶植物拟南芥的气孔发育中,SPCH转录因子在bHLH类三个转录因子(SPCH、MUTE和FAMA)中最先表达,可控制MMC向MC的转变。而拟南芥缺失突变体的表皮是锯齿状的,气孔完全缺失,但在胚胎和根中基因的缺失不影响MMC的不对称分裂,因此,推测基因可特异性调控气孔的发育机制。在单子叶植物中,基因也可通过调控表皮细胞的不对称分裂来启动气孔发育途径,但是根据单子叶植物和双子叶植物气孔在发育过程和形态分布上存在差异,推测基因在两类植物中的具体功能也存在 差异。

*表示干旱处理和对照处理之间HvSPCH基因的表达量差异达显著水平(P<0.05)。
为进一步了解SPCH转录因子在禾本科植物中的功能,本研究克隆了大麦基因并进行生物信息学分析,并对其在干旱胁迫条件下的表达模式进行了研究。生物信息学分析表明,HvSPCH蛋白属于bHLH转录因子家族成员,与气孔初始发育相关。蛋白质三维结构预测表明其具有αβα模式,即典型的HLH结构。系统进化分析表明,大麦HvSPCH蛋白与水稻、小麦、二穗短柄草等禾本科植物的SPCH蛋白同源性较高,亲缘关系较近。
本研究结果还表明,HvSPCH蛋白共有40个磷酸化位点。前人研究表明,拟南芥SPCH蛋白的稳定性和功能与其磷酸化状态密切相关,SPCH蛋白被线粒体活化蛋白激酶(MAPK)、糖原合成酶3激酶(GSK3)和细胞周期蛋白依赖性激酶(CDK)靶向磷酸化,导致SPCH蛋白降解,气孔分裂减少,从而降低气孔数目,说明SPCH蛋白的活性和稳定性是通过多种激酶响应各种信号的磷酸化来调控的。此外,N-糖基化在不同层次和不同位点同时参与调控气孔发育。本研究中HvSPCH蛋白有27个糖基化位点,其中N-糖基化位点7个,O-糖基化位点20个。Macalister等研究发现,拟南芥中缺失N-糖基化关键酶后,bHLH类三个转录因子(SPCH、MUTE和FAMA)的表达量都显著提高,且叶片气孔密度增加,气孔开放程度增大,但随着植物的生长,气孔密度有所下降,并且有异常气孔簇出现,然而其具体机制尚不清楚。当植物受到干旱胁迫时,气孔密度增加,气孔开度减小,部分气孔迅速关闭,从而减少蒸腾作用,最终响应干旱胁迫。本研究对干旱胁迫处理下大麦基因的表达模式进行分析,结果表明,干旱处理 4 h和12 h时,基因的表达量显著提高,说明其有可能通过增加气孔密度来参与大麦的干旱响应过程,这为了解SPCH转录因子在单子叶植物的功能奠定了基础。后续笔者将继续深入研究SPCH转录因子调控的上、下游基因,以进一步深入阐明气孔基因的具体功能和调控机制,为大麦甚至单子叶植物分子育种奠定 基础。

