铁死亡与慢性胃炎和胃癌的研究进展
孙倚天,李国熊
孙倚天,李国熊,杭州师范大学附属医院消化内科 浙江省杭州市310015
0 引言
铁死亡(Ferroptosis)是一种调节性细胞死亡(regulated cell death,RCD)形式,受到细胞内多种诱导因子和抑制因子的调控,其特征是细胞磷脂质成分通过铁依赖机制的过氧化.目前的研究揭示了铁死亡在部分肿瘤中的抗癌机制,了解铁死亡的发生发展并探索其在慢性胃炎和胃癌疾病中的作用有助于临床上开发新的疾病治疗手段.
1 铁死亡背景回顾
1.1 铁死亡的发生与调节 传统的细胞死亡形式有凋亡、自噬、焦亡等,铁死亡最早于2012年由Dixon等发现,它被定义为一种铁依赖的调节性细胞死亡形式;形态学上,发生铁死亡的细胞具有一些坏死特征,伴随线粒体萎缩、膜密度增高、外膜破裂等,而不显示染色质浓缩等凋亡迹象.铁死亡发生在氧化还原背景下,其本质是细胞内的磷脂质过氧化,细胞内的氧化还原水平可以通过NADP/NADPH、GSH/GSSG等电子传递链影响铁死亡.铁死亡发生途径分为酶依赖的酶促脂质过氧化和非酶依赖的芬顿反应(Fenton reactions).酶促脂质过氧化途径由花生四烯酸脂氧合酶(arachidonate lipoxygenase,ALOX)介导,ALOX是一个含铁酶家族,包括ALOX5、ALOX12、ALOX12B、ALOX15、ALOX15B和ALOXE3六种成员;其中,ALOX15是铁死亡通路的关键调控因子,它可以促进游离多不饱和脂肪酸的氧化.芬顿反应由亚铁离子(Fe)和过氧化氢催化产生,并继续通过其下游的一系列反应诱导磷脂质成分过氧化.两种途径最终产生的磷脂氢过氧化物(phospholipid hydroperoxides,PLOOH)对细胞具有致命性损伤,导致细胞死亡.与此同时,细胞内也存在多种抵抗PLOOH损伤的机制.谷胱甘肽(glutathione,GSH)依赖的脂质过氧化修复系统是机体抗氧化的重要防线之一,谷胱甘肽过氧化物酶4(gluthione peroxidase 4,GPX4)以GSH为底物,直接催化内源性PLOOH转化为无害的脂质醇,因而成为铁死亡的负调控因子之一.细胞内GSH的积累依赖于溶质载体家族7成员11(solute carrier family 7 member 11,SLC7A11)的调节,它是胱氨酸/谷氨酸转运体xCT的重要组成成分,因此,SLC7A11同样具有抑制铁死亡的作用.在此,笔者总结了部分铁死亡的诱导因子和抑制因子(图1).
图1 铁死亡通路调节因子.A: 诱导因子;B: 抑制因子.
1.2 潜在的肿瘤治疗靶点 铁死亡自被发现以来,就因其潜在的抗肿瘤作用而引起人们的广泛关注.健康的机体必须保持氧化还原稳态,这对于防止DNA、蛋白质和脂质等生物分子的过氧化损伤至关重要.一方面,与正常细胞相比,癌细胞表现出复杂的代谢适应策略,包括阻断凋亡和非凋亡等细胞死亡途径,使其即使在氧化应激条件下也能存活;另一方面,为满足自身生长需要,癌细胞内具有较高的游离铁水平,使其对铁死亡具有一定的敏感性.迄今为止,已有相当数量的研究表明,肝癌、胰腺癌、卵巢癌、前列腺癌和弥漫性大B细胞淋巴瘤等恶性肿瘤对铁死亡诱导剂具有敏感性;一些经典的抗肿瘤药物(如索拉非尼、阿帕替尼)和天然活性药物(如青蒿素类化合物)也被证实能够通过诱导铁死亡而发挥抗癌作用.作为一种消除抗凋亡癌细胞的新途径,铁死亡有望被应用于更多的肿瘤治疗领域.
2 铁死亡与慢性胃炎
慢性炎症参与许多疾病的发生和发展,是一个复杂的病理过程,其涉及到ALOX调节的花生四烯酸代谢途径,在此过程中,氧化应激对炎症的形成至关重要.例如,幽门螺杆菌(,)的部分致病机制是其造成了机体活性氧的增加,Rahmani等证实了将抗氧化剂辅酶Q10(coenzyme Q10,CoQ10)与三联疗法联合应用有助于改善感染相关的胃粘膜炎症.事实上,氧化应激是胃炎的特征性病理改变之一.与消化道其他区域相比,抗氧化成分GSH在胃粘膜中具有更高的表达水平,从而保护黏膜抵御胃酸损伤.Amanda等发现,胃炎组织中缺乏GPX家族的表达,而NADPH氧化酶、白介素等过氧化损伤标记物则表达显著.我们先前的总结揭示了铁死亡与炎症之间可能存在的联系,即铁死亡能够通过释放炎性因子、损伤相关分子模式(damage associated molecular patterns,DAMPs)等免疫原性促进炎症反应,部分铁死亡抑制剂有助于控制炎症性疾病.因此,有理由推测当细胞内氧化应激达到一定水平并诱导铁死亡时,可能在一定程度上促进慢性胃炎的病理过程.此外,慢性炎症是癌变和肿瘤进展的重要环境因素,炎症微环境(包括氧化应激、高水平炎性介质、免疫因子浸润、屏障完整性降低等)能够推动上皮细胞转化并加速肿瘤进展,炎-癌转化这一概念已被普遍接受.临床和流行病学证据表明,约有15%-20%的恶性肿瘤是由慢性炎症引起,临床上常见反流性食管炎-Barrett食管-食管腺癌、慢性萎缩性胃炎-不典型增生-胃癌、炎症性肠病-结肠癌以及病毒性肝炎-肝硬化-肝癌等疾病演变过程.炎-癌转化过程涉及到的ROS积累、DNA甲基化、炎性因子释放、多种信号通路交叉等与铁死亡之间具有复杂而紧密的联系,能否通过调节铁死亡通路干预炎-癌转化进程也成为富有意义的研究方向.
3 铁死亡与胃癌
胃癌(gastric cancer,GC)是消化系统常见的恶性肿瘤之一,位列全球第三位癌症死亡原因.在我国,每年约有40万例GC新发病例,占世界总发病例数的42%,形势十分严峻.GC早期症状隐匿且缺乏特异性,相当一部分患者确诊时已处于进展期,尽管辅助化疗、靶向治疗、免疫治疗等手段为患者提供了更多选择,但手术治疗仍为GC唯一可能的治愈手段和一线疗法.近年来随着内镜技术的发展,EMR、ESD等内镜下手术治疗展现出一定的优势,但GC患者的整体预后状况仍不乐观,其复发率高,死亡率高,治愈率低.因此,寻找有助于GC诊断和靶向治疗的生物标记物尤为重要.
3.1 胃癌中的铁死亡逃逸机制
3.1.1 GPX4高表达: GPX4是铁死亡的重要抑制因子,也是各种疾病模型中常用的抗氧化标记物.GPX4在乳腺癌、肺癌、口腔鳞状细胞癌、脑胶质瘤和弥漫性大B细胞淋巴瘤中均有较高表达,且其高表达与非小细胞肺癌的放疗抵抗密切相关.GPX4还可以保持胰腺癌和肺腺癌的干细胞特性,促进肿瘤增殖、侵袭和转移.一项针对消化系统肿瘤的研究表明,与非肿瘤组织相比,GPX等抗氧化酶在肿瘤组织中的水平显著较高.在原发性GC中,GPX4-MPND融合基因可促进肿瘤的生长和进展;Wang等对GC中GPX4表达情况进行的数据分析提示,GPX4在GC组织中的转录水平明显较高,且高水平的GPX4 mRNA与患者的不良预后相关.
3.1.2 ALOX15抑制: 肿瘤相关成纤维细胞(cancerassociated fibroblasts,CAFs)是肿瘤微环境中的重要成分,在多种肿瘤中具有致瘤作用.上文提到ALOX15是铁死亡的诱导因子,近来Zhang等发现GC中CAFs分泌的外泌体miR-522通过靶向ALOX15抑制了GC细胞的铁死亡,进而促进肿瘤生长,并降低了GC对顺铂和紫杉醇化疗的敏感性;此外,在结直肠癌中,ALOX15可作为一种抑癌基因表达,这些提示我们ALOX15在GC中或许具有类似作用,但仍需进一步实验验证.
3.1.3 PLIN2过表达: 脂肪酸代谢异常与多种肿瘤的发生相关,超重人群的GC高患病率也提示着GC发生与脂质积累的相关性.脂肪分化相关蛋白(perilipin 2,PLIN2)是一种与细胞内脂滴代谢相关的蛋白,它可以促进细胞脂肪分化,为细胞生长提供能量.作为一种促癌基因,PLIN2在促进GC细胞增殖和抑制其凋亡方面具有显著作用.目前的观点是PLIN2通过PRDM11和IPO7等基因参与了GC细胞铁死亡途径的调控,其过度表达导致细胞内相对缺氧的环境,进而抑制铁死亡并促进GC的进展.
3.1.4 SCD1高表达: 硬脂酰辅酶A去饱和酶1(stearoyl-CoA desaturase 1,SCD1)是细胞脂肪酸转化过程中的关键酶.作为GC中的癌基因之一,SCD1基因在GC组织中高表达,能够增强GC细胞的增殖和迁移能力.研究表明,GC中的SCD1可以提高铁死亡抑制因子GPX4和SLC7A11的表达水平,抑制SCD1可显著促进铁死亡并抑制GC细胞的生长,这从铁死亡的角度揭示了癌基因SCD1的作用机制.
3.1.5 CDO1低表达: 半胱氨酸双加氧酶1(cysteine dioxygenase 1,CDO1)能够催化半胱氨酸氧化,其编码基因是一种新发现的抑癌基因.Hao等发现,CDO1通过限制半胱氨酸合成GSH而影响铁死亡过程,CDO1在GC细胞中的低表达可能导致GC细胞上调GPX4水平从而抑制铁死亡.目前,我国已开展围绕CDO1的铁死亡相关GC药物的技术专利研究,为探索靶向铁死亡的GC治疗提供了一定的思路.
事实上,除了上文列出的几种基因外,GC中铁死亡的调节还涉及到核因子E2相关因子2(nuclear factor erythroid 2-related factor 2,NRF2)、极光激酶A(aurora kinase A,AURKA)等因子(图2).总结以上不难发现,无论是抗氧化酶类的过表达,亦或是促脂质过氧化酶类的低表达,都产生了同一种影响: 即铁死亡的抑制,这种铁死亡“逃逸”或在一定程度上有利于癌细胞的增殖或转移.这也提示我们包括GPX4、ALOX15和PLIN2等在内的铁死亡调控因子或许可以作为潜在的分子标记物,用于GC的诊断和治疗靶点的研发.
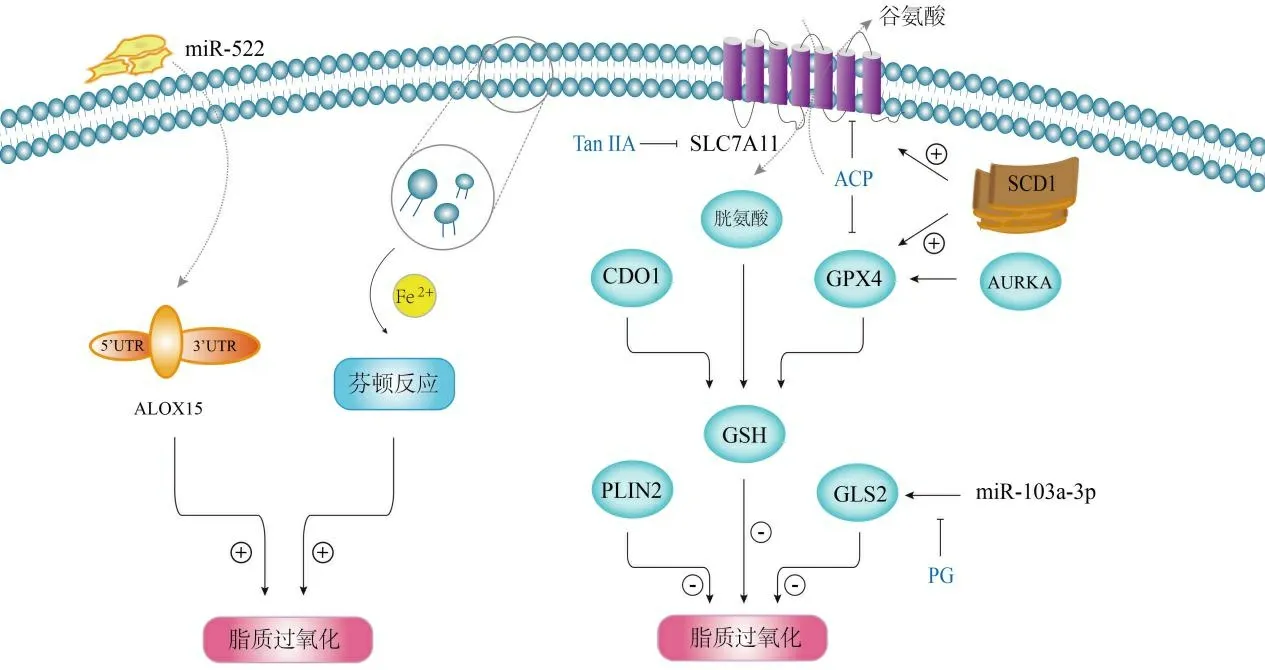
图2 胃癌铁死亡逃逸的相关机制.ACP: 藤梨根;ALOX15: 花生四烯酸脂氧合酶15;AURKA: 极光激酶A;CDO1: 半胱氨酸双加氧酶1;GLS2: 谷氨酰胺酶2;GPX4: 谷胱甘肽过氧化物酶4;GSH: 谷胱甘肽;PG: Physion 8-0-β-葡萄糖苷;PLIN2:脂肪分化相关蛋白;SCD1: 硬脂酰辅酶A去饱和酶1;SLC7A11: 溶质载体家族7成员11;TanⅡA: 丹参酮ⅡA.
3.2 靶向铁死亡的药物 铁死亡抵抗被认为是促进肿瘤耐药性的重要分子机制之一.Physion 8-0-β-葡萄糖苷(physcion 8-0-β-glucop yranoside,PG)是一种天然活性成分,在抑制多种癌症的增殖和转移中起着重要作用,如黑色素瘤、乳腺癌、肝癌、肾癌和胶质母细胞瘤等.Niu等发现,在GC中,PG通过下调miR-103a-3p对谷氨酰胺酶2(glutamine synthase 2,GLS2)表达的抑制作用进而诱导细胞铁死亡,发挥抗肿瘤作用.一些具有抗GC作用的中草药成分也被发现其作用途径与铁死亡相关.丹参酮ⅡA(tanshinone ⅡA,Tan ⅡA)是来自中药丹参的提取物,临床上常用于治疗心血管疾病;它还在肝癌细胞、胃癌细胞、结肠癌细胞和肺癌细胞等人类癌细胞中展示出抗肿瘤活性.最近,Guan等发现铁死亡是Tan ⅡA在GC中发挥抗肿瘤作用的途径之一,在BGC-823和NCI-H87细胞中,Tan ⅡA促进了脂质过氧化,下调SLC7A11的表达进而诱导铁死亡并抑制GC的增殖;铁死亡抑制剂Fer-1可减弱其抗癌作用.藤梨根(actinidia chinensis planch,ACP)是一种知名中药,已被批准作为抗肿瘤药物应用于白血病、肺癌、GC、结肠癌和肝癌等多种疾病的辅助治疗.除了促进癌细胞凋亡外,Gao等发现,在ACP处理的HGC-27细胞中,GPX4和SLC7A11的表达受到明显抑制,最终加速细胞铁死亡的发生.这些都提示我们靶向铁死亡可能是治疗GC的一种新手段.有趣的是,不同组织学类型的GC细胞对靶向铁死亡的药物可能具有不同的敏感性,GC间充质干细胞相较于肠型GC细胞对铁死亡更加敏感.一方面,这可能是由于前者含有更多与铁死亡相关的脂质;另一方面,这与肠型GC细胞中NRF2依赖的抗氧化途径和SLC40A1活性增加有关.
4 总结与展望
作为一种新的细胞死亡形式,铁死亡被发现至今仅十年,虽然目前已在多种类型的肿瘤中证实了铁死亡的存在,但有关铁死亡与慢性胃炎和GC的研究尚不多见.围绕氧化还原背景,我们探讨了部分铁死亡靶点在GC中的表达,GC中的铁死亡“逃逸”或是促进细胞增殖及肿瘤耐药性的一种可能机制,作用于铁死亡通路的抗肿瘤药物也为GC的治疗提供了新的策略.但目前的研究多来自于理论分析或实验模型,铁死亡的促炎作用是否适用于慢性胃炎、能否通过调节铁死亡通路干预胃炎-胃癌的转化过程等问题仍有待进一步研究,如何将靶向铁死亡治疗胃肠道疾病的理念转变为临床实践应用是未来富有前景的研究方向.

