动物药水牛角基础与应用研究进展
汤佳瑶,武文星,朱悦,郭盛,赵明,2,曹鹏,2,刘睿,2,段金廒,2
(1.南京中医药大学/江苏省中药资源产业化过程协同创新中心/中药资源产业化与方剂创新药物国家地方联合工程研究中心/国家中医药管理局中药资源循环利用重点研究室,江苏 南京 210023;2.动物类中药与功能肽国际合作联合实验室,江苏 南京 210023)
角类动物药为传统中药的重要组成部分,它指特定动物的角及其加工品,属于皮肤衍化物的组织,由角质细胞组成[1]。角类动物药可分为表皮角和角质角,表皮角如犀牛角,由表皮角质层所产生的毛状角质纤维组成;角质角又分两种,由真皮形成的骨质芯与表皮形成角质鞘构成的为洞角,如水牛角、牦牛角、羚羊角;已骨化的角为骨角,如鹿角和麋鹿角[2]。2020年版《中国药典》收载3种角类中药,包括鹿角、羚羊角和水牛角,其中水牛角为牛科动物水牛BubalusbubalisLinnaeus的角,具有清热凉血,解毒,定惊的功效,主要用治温病高热,神昏谵语,发斑发疹,吐血衄血,惊风,癫狂等疾病[3]。水牛角始载于《名医别录》:“疗时气寒热头痛”[4],其作为传统动物药,在中医临床已有上千年应用历史,其功能主治及临床用途广为人知。
水牛角及其浓缩粉作为犀角代用资源广泛应用于中医临床与中药制药行业[5-8],取得了良好的社会与经济效益。40多年来,中医药科技工作者围绕水牛角功效物质基础、生物效应机制、质量控制等方面开展系列研究,取得了阶段性进展与成效[9-11]。在此基础上,本文进一步梳理与挖掘水牛角资源价值,从水牛角本草记载、物质基础、质量评价、药理药效评价进行综述,结合团队前期研究进展,提出水牛角基础与应用研究方向,并以水牛角为示范,建立科学、系统角类动物药科学研究模式与评价体系,助力中药资源产业可持续发展,进一步提升角类动物药的经济效益与社会效益。
1 药用记载与历史沿革
1.1 基原记载
古籍中对于水牛角的原动物基原鲜有记载,大多认为水牛角即水牛的双角。在现代文献中,《中华本草》记录:“水牛四肢较短,蹄较大。皮厚无汗腺,毛粗而短,体前部较密,后背及胸腹较疏。体色大多灰黑色,但亦有黄褐色或白色的。全国大部分地区均饲养,以南方水稻地区较多”[12]。2020年版《中国药典》记录:“水牛角为牛科动物水牛BubalusbubalisLinnaeus的角”[3]。
水牛为一种草食反刍家畜,头向前伸,额部突起,眼大稍突出,口方大,鼻孔大,鼻镜宽呈黑色(白水牛为肉色)。水牛角角基近方形,向左右平伸、呈新月形或弧形;水牛全身被毛为深灰色或浅灰色,随年龄增长,毛色逐渐由浅灰色变成深灰色或暗灰色。大型水牛体质量平均在600 kg以上,体高在135 cm以上;小型水牛体质量平均在500 kg以下,体高平均在126 cm以下。水牛主供役用,挽力强,行步稳重,特别适宜于水田耕作。中国水牛属沼泽型水牛,大多数分布于东南和西南,以在淮河以南的水稻产区最多。
水牛分为河流型水牛和沼泽型水牛两种类型,河流型水牛包括印度摩拉水牛、巴基斯坦尼里-拉菲水牛和地中海水牛,主要分布在印度、巴基斯坦和地中海沿岸国家和地区;沼泽型水牛包括中国水牛、越南水牛、菲律宾水牛,主要分布在中国和东南亚国家。其中,中国水牛有24个品种,水牛资源较为丰富多样[13]。江苏地区水牛以海子水牛和山区水牛为主,由于江苏北部沿海群众对生长在海边草滩上的牛群都冠以“海子”二字而得名“海子水牛”。海子水牛为亚洲野生水牛人工驯化后的变种,2006年起,“海子水牛”被农业部列入国家级畜禽遗传资源保护名录。海子水牛体型硕健,背部平直,额宽而突,背宽胸深,肌肉丰满,四肢强健,前肢直立,后肢呈适度弧形,蹄圆而色黑,质地致密,深色牛角、蹄色黑亮。海子水牛的角型大多向后成环抱形,环抱角有大、中、小之分。最大的环抱角左右两角弯曲处的最大距离约1 m;也有两角向左右成直线平伸,角长60 cm左右;角尖向后略弯,因左右两角在一条直线上,形似扁担,而被称为“扁担角”。山区水牛体型中等,被毛也多为石板青色。头部适中,眼大有神,角大向后上方平弯。颈粗壮较短,前躯髻甲高长,背腰宽平,胸宽,腹大而不下垂,尻部倾斜,尾根低而粗,尾长不过飞节。四肢粗壮,蹄小质坚。
1.2 药性及功效记载
水牛角药用始载于《名医别录》,列为中品,“可疗时气寒热头痛”[4]。《新修本草》和《证类本草》延用《名医别录》的说法[14-15]。《日华子本草》记载:“煎,治热毒风并壮热”[16]。《圣济总录》记载:“牛角烧灰,酒服方寸匕,日五服”,可治石淋,破血[17]。《太平圣惠方》记载:“牛角、羊角(烧灰)等分,猪脂调涂”可治赤秃发落[18]。《本草纲目》对水牛角的药性进行了说明,其:“苦,寒,无毒;水牛者燔之,治淋、破血”[19]。《陆川本草》云:“辛、咸,寒。凉血解毒,止衄。治热病昏迷,麻痘斑疹,吐血,衄血,血热,溺赤”[20]。《晶珠本草》记载其“清热、利水、治下落水肿”[21]。《四川中药志》概括其功效主治为“治风热头痛,喉头红肿,小儿惊风及吐血”[22]。《全国中草药汇编》载其“清热镇惊,凉血止血。主治热病惊厥,高热,神昏,谵语,吐血,衄血,斑疹,血小板减少性紫癜,精神分裂症,小儿夏季热”[23]。综合历代本草记载,水牛角其药性可归纳为苦、寒,镑片水煎入药用治温热病、惊风、斑疹等疾病,而牛角烧灰后,其功效主治有所改变,主要用于治疗赤秃发落和淋证、破血,不同的炮制方法,水牛角的功效有所不同,其原因可能与水牛角烧灰之后物质成分改变有关,但未见深入研究,其机制尚待阐明。历代本草著作对水牛角的性味功效主治记载见表1。

表1 历代本草著作对水牛角的性味功效记载
1.3 中医药典籍中水牛角方剂的应用
依据水牛角的性味归经及功效,中医临床常以单方或复方应用。以“水牛角”为关键词查询南京中医药大学中药方剂文献数据库、2020年版《中国药典》和药智网,共得到历代方书记载含水牛角方剂23首。对水牛角方剂进行统计梳理,发现水牛角成方后多水煎,以汤剂服用,或者研成细粉入丸剂,23个古籍记载方剂中有10个方剂以汤剂服用,4个方剂以丸剂服用。根据主治病症分布对水牛角方药进行统计,结果如表2,水牛角方剂主要用于治疗温热病、神昏谵语、斑疹、咽喉肿痛、目昏、小儿惊厥、中风等疾病。
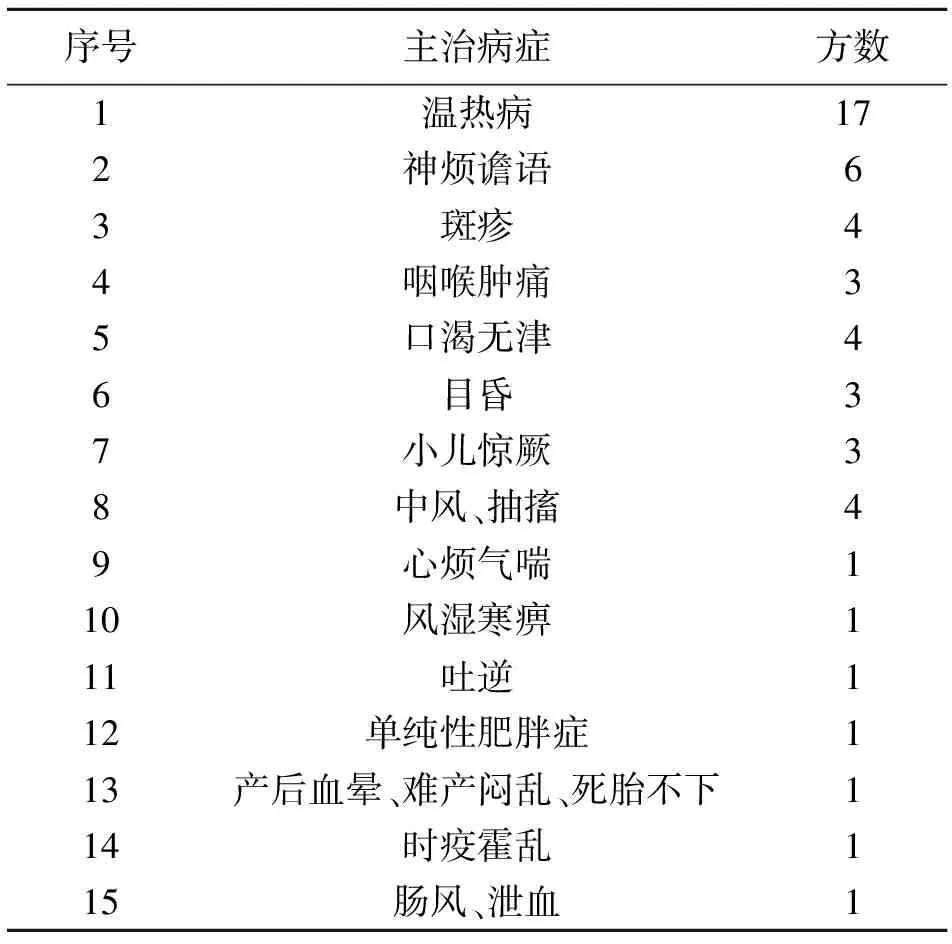
表2 水牛角方药主治病证分布
2 水牛角物质基础研究
水牛角主要含有蛋白质类、肽类、氨基酸类、含硫类、核苷类、无机元素类等化合物。
2.1 蛋白质类
水牛角含有丰富的蛋白质类成分,是构成水牛角致密结构的主要成分,更是水牛角的重要功效物质。课题组前期研究通过反复抽提蛋白质类成分,将水牛角细粉制备获得可溶性蛋白与不溶性蛋白两部分,基于Shotgun蛋白质鉴定技术[24],从可溶性蛋白部分中鉴定了46个蛋白质,其中角蛋白17个,占比37.0%;不溶蛋白部分鉴定了72个蛋白质,其中角蛋白16个,占比22.2%。合并两部分鉴定信息,从水牛角中共鉴定了90个蛋白质类成分,基于蛋白质的鉴定覆盖率、多肽数量,多肽匹配图谱(PSM)等信息比较归类,水牛角中角蛋白(Keratins)、角蛋白相关蛋白(Keratin associated protein)、连接蛋白(Junction plakoglobin)、桥粒蛋白(Desmoplakin)等结构蛋白占主导数量。在此基础上,课题组进一步通过iTRAQ同位素标记定量蛋白质组学的方法,对不同角类动物药中共性蛋白质的相对含量进行比较分析,结果表明,尽管水牛角抽提液的蛋白质总量显著低于犀角、广角的抽提液,但水牛角与犀角、广角的蛋白质类成分组成、相对含量比例接近。主成分分析(PCA)表明水牛角中角蛋白、角蛋白相关蛋白、桥粒芯蛋白(Desmoglein)、桥粒糖蛋白(Desmocollin)、连接蛋白、桥粒蛋白等主成分与犀角、广角最接近。此外,水牛角中2种蛋白质交联酶Transglutaminase 1(TGM1)与Protein-glutamine gamma-glutamyltransferase E(TGM3)的水平与犀角、广角接近,TGM3参与催化角蛋白的N-(γ-谷氨酰)赖氨酸交联形成等肽键,将细胞质内蛋白质相互连接,而TGM1可交联细胞周边的蛋白质。上述研究表明水牛角在蛋白质种类、结构组成方面与犀角、广角接近,为水牛角作为犀角类效资源使用提供了依据。
2.2 肽类
水牛角传统用法常以煎煮单用或入方剂使用,经过煎煮后,蛋白质类成分经非特异性降解释放一些可溶性肽类成分。近年来随着现代仪器与技术手段的发展进步,围绕水牛角肽类成分的分离、纯化、鉴定等方面开展了进一步研究。
课题组前期通过凝胶、离子交换、反相色谱多维色谱结合从水牛角提取液中分离纯化获得3个活性肽,氨基酸序列分别为QYDQGV、YEDCTDCGN、AADNANGLFPPN,对过氧化氢诱导的脑微血管内皮细胞损伤具有显著的保护作用[25]。活性导向下的多维色谱联用分离活性肽类成分是经典的肽类分离、分析方法,但效率较低。课题组进一步采用多肽组学的方法,从水牛角活性部位中鉴定了824个肽段信息,进一步通过肽序列热图分析,发现水牛角活性部位的肽段来源于KRT14、KRT34、KRT86等主要角蛋白的特定序列,提示我们水牛角活性多肽可能为一类具有相同或相似氨基酸序列信息的物质[26]。
角蛋白是构成水牛角的主要蛋白质类成分,角蛋白稳定的结构与其二硫键(-S-S-)的形成密切相关,而水牛角在特定条件下,如高温煎煮、体内生物酶等作用下,其角蛋白发生非特异性降解,甚至可能发生-S-S-断裂形成游离巯基(-SH)。-SH作为一种活泼基团,在多种生物过程和疾病中起到重要作用,近年来受到广泛关注[27],如-SH经酶催化转化为硫化氢(H2S),H2S作为重要的内源性气体信号因子在维持内皮功能稳定等方面起到重要作用,王春雪等[28]通过荧光衍生法测定水牛角-SH含量为18.3~38.3 μmol·g-1,含有-SH的肽类成分可能为水牛角重要物质基础,如水牛角提取液分离得到的活性肽YEDCTDCGN,即含有2个-SH。为此,课题组制备了核壳型Fe3O4@PDA@Au纳米材料对水牛角中含-SH肽类成分进行富集、鉴定与表征,结果水牛角含-SH部位(富集液)中共检测到2 254个肽类成分,其中含-SH肽类成分709个,水牛角含-SH部位的活性评价表明,相较于水牛角提取液,其抗氧化、抗炎活性均显著提升。如此表明,活性肽类是水牛角重要功效物质,其中含-SH肽类成分是其抗炎、抗氧化关键物质基础[25,29]。
2.3 氨基酸类
水牛角中的蛋白质与肽类经水解后得到多种氨基酸,氨基酸作为蛋白质的基本单位,对于维持正常生理功能和机体代谢过程具有重要意义。课题组前期研究对水牛角18种水解氨基酸进行了测定,其中谷氨酸含量最高,为12.59%,其次分别为精氨酸(10.00%)、亮氨酸(8.50%)、半胱氨酸(8.35%)、酪氨酸(8.05%)、天冬氨酸(6.95%)、丝氨酸(6.90%)、甘氨酸(6.76%)等,水牛角中8中必需氨基酸含量为36.95%[30]。此外,牛磺酸作为一种结构简单的含硫氨基酸,是调节机体正常生理活动的活性物质,采用OPA柱前衍生法,测得水牛角中牛磺酸的含量为8.46 μg·g-1[31]。
2.4 核苷类
核苷类是具有广泛生理活性的一类水溶性成分。课题组前期通过UPLC-Q-TOF/MS分析水牛角水提液活性部位(MW<1 000 kDa)中含有尿苷、次黄嘌呤、鸟苷和腺苷核4种苷类成分[24]。采用亲水作用色谱-超高效液相色谱-三重四极杆质谱法(HLIIC-UPLC-QQQ-MS)测定了9个批次水牛角样品14个核苷和含氮碱基类成分的含量,结果表明水牛角总核苷含量范围为123.36~233.22 μg·g-1,其中黄嘌呤和鸟嘌呤占比较大[32]。因此,水牛角的核苷类成分含量可以为水牛角质量控制和真伪鉴别提供参考。
2.5 无机元素类
无机元素是生物体的构成元素,其参与多种生理过程,具有重要的生物功能。
王斐[30]通过微波消解制备水牛角样品,测定水牛角中的35种无机元素,结果表明硫、钙、锌、磷、钾、钠、铁等为水牛角主要元素,其中硫元素含量最为丰富,达28.10 mg·g-1。
3 水牛角质量评价研究
3.1 药材鉴定
3.1.1 性状鉴定和显微鉴定 水牛角形状弯曲呈弧形,根部方形或略呈三角形,中空,一侧表面有多数平行的凹纹,角端尖锐。色黑褐,质坚硬,剖面纹细而不显,气腥。一般多用其角尖部。水牛角的基础为额骨的角突,角突腔与额窦相通,幼牛的角突内腔有若干不完整的中隔,随着年龄的增长,中隔逐渐为骨嵴所替。角突之外有骨膜和真皮层,最外部为角壳,真皮实角质发生部位。角的基部有丰富的血管和神经分布,是供应角生长所需营养的源泉。当水牛角处于营养好的时期,其角生长较好,角壳较厚。反之,则角生长较慢,角壳较薄。由于生理与环境等因素的影响,如怀孕、哺乳、饲草因四季变化而营养成分不同,使得水牛的角上形成了一圈圈的沟和脊,呈轮状构造,称之为“角轮”[33]。水牛角性状外观参见图1。
水牛角粉末为灰褐色,不规则形碎块淡灰白色、淡灰黄色或灰褐色,纵断面可见细长梭形纹理或有纵长裂缝。布有微细灰棕色色素颗粒;横断面梭形纹理平行排列,呈弧状弯曲,似波峰样,有众多黄棕色色素颗粒。有的碎块表面较平整,色素颗粒及裂缝均少[3]。水牛角切片直接显微观察,切面呈水波纹样。水牛角粉为不规则碎块淡灰白色或灰黄色。纵断面观可见细长梭形纹理,有纵长裂缝,布有微细灰棕色色素颗粒;横断面观梭形纹理平行排列,并弧状弯曲似波峰样,有众多黄棕色色素颗粒。有的碎块表面较平整,色素颗粒及裂隙较小,难于察见[3]。
尽管薄层法[34]、红外法[35]、高效液相法[36]、毛细管等电聚焦法[37]等已应用于水牛角的鉴别及区分其他角类,但是由于专属性不强,或检测灵敏度不高,不能行之有效地用于水牛角鉴别。近年来DNA条形码、蛋白质、多肽检测的技术手段应用于水牛角专属性鉴别,并取得了较好的效果。
3.1.2 DNA条形码鉴定 刘旭朝[38]以COⅠ序列为DNA条形码,取水牛角及其易混品的原动物和市售药材样品155份,从中获得93条水牛角及其易混伪品的原动物COⅠ序列,经核验后均已纳入中药材DNA条形码鉴定系统数据库,建立基于DNA条形码技术的水牛角及其易混伪品鉴定方法。
3.1.3 特征肽鉴定 课题组前期基于多肽组与数学集合分析的方法,发现4条水牛角特征肽:通过nanoLC-Orbitrap-MS质谱分析12批水牛角、6批山羊角、3批猪蹄甲和2批牦牛角经胰蛋白酶酶切后的全部肽段信息,结合数学集合理论分析,从水牛角肽组中排除非水牛角的肽类,进一步通过BLAST比对,确定4个水牛角特征肽,序列分别为GPSLAGSASSVR、GGVTCGGLTYSTTAGR、ICEGVGPVDIAVSSSR、LVNELTEFAK,采用UPLC-QQQ-MS的多反应监测(MRM)模式,对4个特征肽的离子对进行优化,并对不同角类样品进行检测,验证4个特征肽的专属性,结果表明4个特征肽在水牛角与牦牛角中均可检测到,而在山羊角、猪蹄甲中未见响应,表明可用于区分水牛角与山羊角、猪蹄甲[39]。后续基于数学集合与Label free定量多肽组学分析筛选,确定3条牛角特征肽段,序列分别为:AIGCGFGSSGGSSSTIK(特征肽1)、TCGFSTVGSGFGSR(特征肽2)及SDLEAEVESLK(特征肽3),3个特征肽在水牛角、黄牛角及牦牛角中相对含量不同,根据3个特征肽存在方式可进行判别:水牛角样品可检出特征肽1与3,黄牛角可检出特征肽1与2,牦牛角可检出特征肽2与3[40],这一策略为近缘物种动物药鉴别区分提供思路与方法。
3.2 质量评价
为有效控制水牛角的质量,按照药典规定方法,侯惠婵等[41]测定水牛角中含氮量,发现12批水牛角浓缩粉与角尖、角桩间氮总量差距较小,平均值为15.9%;课题组前期测定了10批水牛角浓缩粉样品中水分、总灰分、酸不溶灰分、浸出物和牛磺酸含量,结果表明10批水牛角浓缩粉水分为1.8%~13.8%,总灰分为1.0%~6.0%,酸不溶性灰分为0.2%~2.2%,水溶性浸出物含量为3.2%~6.9%,牛磺酸含量为2.9~61.5 μg·g-1[42]。另外,现代研究通过高效液相法检测水牛角中氨基酸含量,以此控制水牛角质量。裴玉等[43]采用Prevail C18柱,以磷酸二氢钠缓冲液、甲醇、乙腈为流动相,建立了OPA-FMOC试剂联用柱前衍生氨基酸的高效液相色谱分析方法,能够同时测定水牛角药材中18种常见氨基酸含量。刘博譞等[44]采用异硫氰酸苯酯(PITC)柱前衍生化法建立水牛角浓缩粉氨基酸成分含量分析方法和总氨基酸HPLC特征图谱,能够同时测定6种氨基酸成分含量,得到14个氨基酸类特征峰。尽管科研工作者采用了多种方法对水牛角的质量进行评价与控制,但目前质控体系仍有待深入与完善,为药材与原料、中药制药行业质量控制提供灵敏度高、专属性强的方法体系。
4 水牛角生物效应评价研究
水牛角具清热解毒、凉血定惊之功效,现代药理研究主要围绕水牛角解热、镇静、促凝血等药理活性展开。中医临床常用水牛角及其方剂治疗热证,疗效确切,近10年来,水牛角生物效应研究主要以解热效应评价为主。
4.1 解热作用
发热模型按发热机制的不同,可以分为两大类:感染性发热和非感染性发热。课题组前期研究选择两种整体动物发热模型研究水牛角水提液解热效应,结果表明水牛角对感染性发热(酵母致热)与非感染性发热(脱脂牛奶致热)动物均有显著的解热作用,2种发热模型均与PGE2水平升高有关[45-46]。进一步研究发现水牛角显著降低酵母致热大鼠体温的同时,亦可显著降低发热大鼠血浆中IL-1β、IL-6、TNF-α、PGE2等炎症因子水平[47]。
基于UPLC-Q-TOF-MS和多变量统计分析方法检测水牛角提取物对解热相关的所有生物标志物干预情况,结果表明,水牛角可调节包括甘油磷脂、花生四烯酸(Arachidonic acid)、氨基酸、鞘脂和嘌呤代谢等生物标志物,水牛角解热作用与干预花生四烯酸代谢通路与氧化应激通路相关[48]。
在炎症发生过程中,脑微血管内皮细胞受到IL-1β或TNF-α等炎症因子刺激后释放PGE2类物质,从而影响中枢体温调定点进而引起体温上升。课题组前期研究发现,水牛角提取液可下调脑微血管内皮细胞炎症应激下释放的PGE2水平,且水牛角对过氧化氢(H2O2)诱导微血管内皮细胞氧化损伤也具有保护作用,可抑制乳酸脱氢酶(LDH)的释放,提高超氧化物歧化酶(SOD)和过氧化氢酶(CAT)的活性[47]。
此外,水牛角水提液<3 kDa部位可显著降低发热大鼠体温,显著降低发热大鼠血浆IL-1β、TNF-α、PGE2与cAMP水平[24],有报道含-SH的化合物具有一定的解热作用,如α-硫辛酸和N-乙酰基-L-半胱氨酸能够通过抑制NMDA受体依赖羟基自由基通路降低自由基产生来缓解发热[49-50]。而水牛角肽类分析结果表明,His、Pro、Cys、Tyr、Trp、Phe、Met等氨基酸的出现频次较高,Cys为含-SH氨基酸,且作为良好的质子供体,Cys可参与氧化还原反应对抗氧化应激,亦具有发挥解热、抗炎作用的潜力。此外,-SH及活性硫簇(Reactive sulfur species,RSS),如HS·、H2Sn、H2S等可降低脑内视前区PGE2、cAMP、cGMP等的释放,从而缓解炎性,-SH作为关键RSS类物质与解热作用密切相关[51-52]。因此,水牛角解热作用确切,与其干预炎症发生过程、氧化应激发生过程密切相关。
4.2 镇静作用
研究表明,水牛角具有较好的镇静作用,可显著减少小鼠自发活动次数,可协同戊巴比妥钠延长小鼠睡眠时间[10]。李宝国等[53-54]研究给予小鼠以水牛角不同相对分子质量的酶解液,发现水牛角能延长戊巴比妥钠致小鼠睡眠的时间,其中相对分子质量<3 kD和10~30 kD的酶解液有明显的镇静作用。
4.3 止血作用
通过小鼠断尾模型和玻管凝集试验测定水牛角的凝血时效,发现水牛角止血作用起效快,止血作用持续6 h左右。其中,相对分子质量>30 kD酶解液有明显的止血作用。此外,在体外血小板聚集试验结果发现水牛角水解物具有血小板激活作用,但作用强度较弱,水牛角的止血作用可能与激活血小板有关[54-57]。
水牛角药理作用以解热、镇静、止血作用为主,作为一种活泼基团,-SH水平及正常机体血浆中-SH与-S-S-的比例(-SH/-S-S-)稳态平衡与多种疾病相关,病理状态下机体的-SH/-S-S-水平会发生不同程度的上调或下调[58]。机体在发热、炎症、惊厥等状态下,-SH/-S-S-水平会发生不同程度改变。例如,在惊厥动物模型中,血浆-SH的水平显著降低,而-S-S-的水平显著升高[59];有研究表明,GSH、N-乙酰半胱氨酸(NAC)等含-SH化合物可降低LPS诱导的发热大鼠体温,并降低脑内视前区PGE2、cAMP、cGMP等的释放,从而缓解炎性发热[60-61],-SH、H2S等关键RSS与发热、炎症等密切相关;另有研究表明,-SH/-S-S-的平衡与凝血酶功能、血液凝固有关,-SH/-S-S-的交换可能是诸多凝血因子活性的限速步骤,也可能是凝血级联的整合和控制的基础[62]。根据文献报道及课题组前期研究结果,水牛角中含-SH类化合物与其清热、镇静、止血等药理作用紧密相关。
5 水牛角作为犀角代用资源的应用历史
犀角为哺乳纲奇蹄目犀科动物印度犀RhinocerosunicornisLinnaeus、爪哇犀RhinocerossondaicusDesmarest、苏门犀RhinocerossumatrensisFischer的角;广角为黑犀RhinocerosbicornisLinnaeus或白犀RhinocerossimusCottoni的角。犀(广)角具有清热定惊、凉血解毒等功效,可用治热盛火炽、壮热不退、神昏谵语、惊厥抽搐等症,《神农本草经》始载道:“味苦寒”“治百毒,虫疰,邪鬼,瘴气,杀钩吻,鸩羽,蛇毒,除邪,不迷惑,魇寐,久服轻身”[63]。1963年版《中国药典》记载犀角“味苦、酸、咸,性寒”“具有清热,凉血,解毒之功效;主治伤寒时疫,热入营分,惊狂,发黄,班疹,神昏谵语,血热妄行,吐血,衄血,下血,热毒疮肿”[64],临床疗效显著,但犀角多依赖进口,价格昂贵,且资源匮乏,应用于临床治疗受到一定限制。1970年,犀牛被CITES列入濒危物种,受到国家保护;1993年5月29日,国务院发布《关于禁止犀牛角和虎骨贸易的通知》,明令禁止交易和使用犀角产品。此外,加之赛加羚羊的数目骤减,犀角、羚羊角在临床使用受到极大限制。珍稀角类药材临床使用的必要性与现有法令禁止使用的矛盾加剧,因此越来越多的研究人员开展寻找珍稀角类动物药材替代资源的研究。
20世纪70年代,为寻找犀、广角替代资源,国家行业部门对多种角类进行了比较性研究与评价,结果认为水牛角具有相似和确切的功效,且资源丰富、取材广泛、价格低廉,有效地缓解了中医临床对于犀、广角的依赖性与法律禁止使用犀、广角的矛盾。而后1977年版《中国药典》收载了“水牛角浓缩粉”,即以水牛角管状部分磅片、水煎、取煎液浓缩后加入经微粉化的角尖粉混合制粒所得,并广泛代用犀、广角用作医药工业和临床调剂,取得了良好疗效。据统计,现制药行业和临床上使用的现代水牛角处方制剂共计172种,包括浓缩水牛角颗粒、紫雪胶囊、安宫牛黄丸等,在临床上主要用治高热、神昏谵语、惊风抽搐、小儿热急惊风、头晕目眩、高血压等疾病。
目前中医临床及中药制药行业以水牛角或水牛角浓缩粉替代犀角应用于方剂及中成药,如:清营汤、犀角汤、犀角地黄汤等均以水牛角替代犀角使用,这些方剂在清热解毒、定惊凉血等方面均取得了较好的功效。3 871例临床资料分析表明,水牛角替代犀角治疗乙脑、小儿夏季热、急性扁桃体炎等高热病证的效果明显[65]。药理学研究表明水牛角与犀角在解热、止血、镇静等方面具有相似的药理作用。犀角水煎液与水牛角浓缩粉水煎液均能明显降低大肠埃希菌内毒素所致小鼠死亡率;缩短DIC模型大鼠凝血活酶时间、凝血酶原时间、凝血酶时间,升高血小板数;能协同戊巴比妥钠延长小鼠睡眠时间,二者均具有抗炎、止血、镇静的作用[10]。在松节油致大鼠发热模型中,2.5 g·mL-1犀牛角和水牛角的水提物均表现出显著的解热作用[55]。但是在实际临床应用中,水牛角替代犀角入药时,往往需要加大剂量,其功效才能与犀角相当。例如,水牛角代用犀角使用的比例(犀角∶水牛角),在清营汤中为3∶10~3∶20或1∶15,在犀角地黄汤中为1∶10~1∶20,在紫雪中为3∶5或4∶15,在苏合香丸中为1∶10,在清瘟败毒饮中为1∶10,在安宫牛黄丸中为1∶20,在至宝丹中为1∶10[23,66-69]。犀角药用历史及水牛角代用现状见图2。
6 水牛角资源利用与前景展望
水牛角为传统角类动物药,在中医临床与中药制药行业应用广泛,历史悠久。然而一直以来水牛角的基础研究薄弱,尽管多年来中医药科研工作者围绕水牛角等角类动物药的物质基础、生物效应、质量控制等方面开展研究,但尚不完善,符合水牛角以及角类动物药资源功效特点、化学物质组分特点的方法体系与开发模式亟待构建。
6.1 深入开展水牛角功效物质基础研究,阐释水牛角功效物质基础与效应机制的科学内涵
前期研究表明,蛋白质、肽类为水牛角重要的功效物质基础,其中丰富的含-SH肽类成分更是关键的功效物质。紧扣水牛角清热、镇静、止血等药理作用,合理运用有机化学、分析化学、材料化学等交叉学科的技术手段,有针对性地富集、表征并制备水牛角含-SH肽类成分,如利用制备高效-SH富集纳米材料,通过亲和层析方法批量制备水牛角含-SH肽类成分,采用高通量液质联用分析手段,结合“蛋白质组-多肽组-修饰组”等多组学联用策略[2,28-29,38],对水牛角功效物质进行全面表征;进一步采用经典药理学、分子生物学、化学生物学、生物信息学等技术方法,合理利用模式生物建立符合水牛角传统功效的动物模型,并从整体动物、细胞、离体器官、分子水平,围绕其解热、镇静、止血作用深入开展效应机制研究,从而系统阐释水牛角功效物质基础与效应机制的科学内涵。
6.2 构建水牛角质量控制和评价体系
2020年版《中国药典》中水牛角项下仅有性状与鉴别项,水牛角浓缩粉项下有性状、检查、浸出物、含量测定,这些方法与指标无法全面评价水牛角药材、中间体、含水牛角成药或配方颗粒等样品的质量,对中药制药过程的质量控制、产品溯源、临床用药安全等方面不能形成全面质控,因而,科学、系统的水牛角质量控制和评价体系亟待构建。在2020年版《中国药典》中,DNA条形码、专属肽检测已应用于多个动物药品种的鉴别,如基于COⅠ序列的DNA条形码可用于区分水牛角及其伪品,课题组前期发现的水牛角特征肽可用于水牛角配方颗粒的检测。2020年版《中国药典》阿胶品种除了以氨基酸为含测指标外,增加了驴源多肽的含量指标,如此可显著提升含量测定指标的专属性,更适合于药材中间体、成药、配方颗粒等产品的质量控制。因此,以特征性肽类成分的含量对药材及其产品的质控模式亦可应用于水牛角及水牛角浓缩粉。此外,采用Q-maker法[83],根据“属性-效应-成分”理论,对水牛角进行“质量标记”,对多个活性成分进行同步测定,这种方法用于药效成分复杂的中药的质量评控更加科学、高效[84-85]。
本文从水牛角的本草记载、物质基础、质量评价、药理药效评价进行梳理与归纳,结合课题组前期在水牛角基础与应用研究,在水牛角清热解毒、凉血定惊的传统功效应用基础上,围绕水牛角功效物质基础与效应机制科学内涵的阐释,水牛角质量控制和评价体系的构建等方面提出设想与展望,以期更好地服务于中药动物药资源产业的提质增效及可持续发展。

