复方丹参注射液对家兔退变腰椎间盘的TNF-α与CTGF的表达影响
徐立国(通讯作者) 杨自兵 徐 杰 孙继峰
( 日照市中心医院 , 山东 日照 276800 )
椎间盘退行性疾病(Degenerative disc disease DDD)在全球范围内仍然是一个普遍的折磨人的疾病,对经济的影响比较大,并且可导致生活质量的下降。背部疼痛与神经功能缺损与椎间盘退变相关。虽然已投入很多的努力来理解DDD的病因与腰痛的发病关系,但进展不是很明显。在上个世纪的大部分时间,传统观点认为腰椎间盘突出症的病因主要是由于年龄、性别、职业、吸烟和暴露于车辆的振动等。最近的研究表明,遗传可能是椎间盘突出症的主要责任原因。自1998年以来,对于与椎间盘退变的几个基因的鉴定表明遗传的影响已被证实。现在许多研究人员一致认为腰椎间盘突出症似乎是类似其他的复杂疾病,其病因有环境和遗传的影响。了解椎间盘退变性疾病的病理生理机制仍然是一个重要的研究重点,因为椎间盘发生的年龄相关性变化与腰痛是紧密联系在一起的,并且与其它相关的神经功能缺损亦有联系。椎间盘为全身最大的无血管结构,数量有限的血管渗透到关节软骨终板的表面区域和外围纤维环的外1/3处。但是没有血管位于髓核细胞中[1]。它必需的营养包括氧气和血糖主要是通过扩散方式到达髓核细胞,因此构成了髓核细胞中的一个低氧状态和环境。另外,在椎间盘退化过程中这种低氧环境可以通过软骨终板通透性的缺失得到加强。在许多疾病过程中,炎症为一个重要的细胞应激伴随着明显的病理学并发症,例如脑缺血、癌症和慢性变性疾病。 TNF-α为一种研究最多的促炎性分子,可以促进软骨聚集蛋白聚糖降解、促进分解代谢和促炎性细胞因子NGF的表达,没有任何恢复。TNF-α为脂肪细胞因子(adipokine)与牛椎间盘极大数量的衰老细胞相联系。因此涉及到变性的椎间盘的无能力通过自己重新植入。令人好奇的是,虽然许多研究已经将研究焦点集中于TNF-α在椎间盘退行性病变中的作用,但Hoyland和其同事建议在退化性椎间盘中TNF-α替换IL-Iβ为基质降解的关键调节子:IL-1在临床上与慢性腰痛相关的椎间盘中呈高度表达,并且对抗IL-Iβ的治疗方法可抑制基质降解,IL-1在退变性人类椎间盘中为上调状态,诱导MMPT、MMP13和ADAMTS(解聚素和金属蛋白酶且伴有凝血酶敏感蛋白图谱)生成,表明了正常椎间盘自我平衡的反常调节。TNF-α阻断剂对基质降解活性不产生作用,表明它在椎间盘退行性病变中的上调与基质降解没有关系,但是附近的神经根刺激具有联系,这在别的实验中得到确认。因此TNF-α可能会促成椎间盘疼痛,在神经内向生长进入椎间盘退行性裂缝发生的案例中。有研究证明,CTGF对于椎间盘细胞的合成代谢具有非常重要的调节作用。有研究证明,转化生长因子β经由Smad3 /AP - 1通路对椎间盘髓核细胞内的结缔组织生长因子的表达水平进行调节,CTGF在退变骨化椎间盘的表达明显高于正常组,但在椎间盘退变中CTGF的作用不是很了解[2]。研究发现椎间盘变性与血管生成相关,结缔组织生长因子与新生血管的形成关系非常密切,研究者在对采集的21个椎间盘样本进行的形态学观察中发现,产生退行性病变的椎间盘中,结缔组织生长因子在病变椎间盘中的表达水平要高于其在正常椎间盘中的表达水平,尤其是在椎间盘样本的新生血管形成区域,因此研究者认为结缔组织生长因子在某种条件下会加速椎间盘的退行性病变的发生速度,椎间盘退行性病变的具体机制猜测可能与相关的新生血管形成具有某种联系。本研究观察复方丹参注射液对大鼠退行性椎间盘病变中TNF-ɑ与CTGF的表达影响。为复方丹参注射液预防和治疗椎间盘退变和腰椎间盘退行性疾病的分子机理提供一个新的理论依据。报告如下。
资料与方法
1 实验动物:健康成年家兔36只,(由潍坊医学院实验动物中心提供),雌雄不拘,体质量范围在2.3-2.8kg。随机分为观察组、模型组、空白组,每组12只。模型组和观察组每只家兔 L3-4, L4-5椎间盘行针刺手术,空白组不进行手术干预。
2 实验仪器:(1)PRIM-R台式高速低温离心机(德国贺利氏仪器公司);(2)H2-881S台式水浴恒温震荡器(太仓市科教器材厂);(3)FA2004电子天平(中国上海天平厂);(4)Eppendorf移液器(德国);(5)BH-2型生物光学显微镜及照相系统(日本OLYMPUS公司);(6)摄像及FR-988生物显微图像分析系统(上海复日科技有限公司);(7)Glanz微波炉(广东顺德加用电器有限公司):(8)KQ5200超声波清洗器(昆山市超声仪器有限公司);(9)YXQG41780-A型高压消毒锅中国(上海医用核子仪器厂);(10)PC721分光光度计(上海棱光技术有限公司);(11)MDF-330型立式超低温冰箱(日本Sanyo公司);(12)YDS-10液氮生物容器(四川亚西机器厂);(13)YL3型回转式切片机(上海仪表厂);(14)XY-86型振动切片机(浙江象山科学精密仪器厂);(15)202-3型干燥箱(上海市实验仪器厂)。
3 手术方法:首先用碘伏对作业区进行消毒,然后无菌手术洞巾覆盖作业区,手术的前外侧入路切口大约为6.0cm-8.0cm的长度(右肋缘下至髂前上棘斜切口),手术刀逐层对皮肤的浅与深筋膜层进行分离,并进行腹外斜肌、腹内斜肌等肌肉的分离,按照家兔肌肉纤维的方向。沿腹内斜肌及腹横肌之间向后分离肌肉及筋膜,分离至与竖脊肌相搭界的筋膜,纵向剪开,为腹膜前间隙。顺着腹膜外间隙剥离,并将肌肉向内侧,对脊柱前的血管、组织等进行钝性分离。钝性分离腹膜外间隙到腰椎横突前外侧,第十二肋定位曝光揭示预穿刺椎间盘对于椎前阶段的血管要进行小心仔细的分离,用直径为1mm的注射器针头穿刺所暴露的椎间盘,针头的穿刺深度大约控制在5mm左右,针头穿刺到达制定深度后时间维持5秒即可拨出穿刺针头。模型组的每个椎间盘只常规穿刺1针。穿刺完成后对家兔进行彻底止血,用碘伏对手术视野进行2次冲洗,随后逐层缝合关闭切口层。观察组行椎间盘内注射复方丹参注射液 ( 正大青春宝药业有限公司 ),每周1次。
4 椎间盘组织样品制备:用锋利的刀片将中性甲醛固定液固定的组织作冠状切片,厚3mm,流水冲洗1小时(以洗去固定液),入上行梯度乙醇脱水(50%、70%、80%、95%、95%Ⅱ、100%、100%Ⅱ)各20-30分钟,二甲苯透明2-3小时,浸蜡2-3小时,常规包埋。组织切片机切片,厚度为5-6μm,每隔100μm连续取3张,相邻切片分为3套。2套分别用于免疫组织化学法测定TNF-ɑ和CTGF的表达,1套用于HE染色。TNF-ɑ和CTGF免疫组织化学染色测定按照说明书步骤严格执行。
5 观察指标:第 4、6、8、12 周时 , 分别处死各组家兔制备椎间盘切片,行组织切片HE染色和免疫组化染色,并对观察组、模型组与空白组的椎间盘组织中的TNF-ɑ和CTGF的阳性表达分别进行定性、定位与半定量检测,并对TNF-ɑ和CTGF的阳性表达率进行分析。
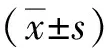
7 结果
7.1 模型组椎间盘镜下组织学观察:第4周镜下观察到外周纤维环的结构较对照组明显紊乱,并且软骨终板细胞的层次分辨不清,组织结构排列较紊乱;第6周镜下观察到椎间盘的髓核区域发生皱缩,外周纤维环发生破裂现象,第8周部分椎间盘的软骨终板产生钙化层,软骨细胞的数量呈减少状态。第12周镜下观察到椎间盘退行性变化非常明显,部分软骨终板的钙化层发生增厚并产生骨化现象,软骨细胞结构非常紊乱,大部分的软骨陷窝呈消失状态,细胞核固缩现象明显,并发生核碎裂、核溶解现象。潮线大部分增厚呈模糊状态,与软骨终板邻近的髓核变性和纤维化。
7.2 免疫组化染色标记:(1)TNF-ɑ表达结果。模型组与空白组比较,TNF-ɑ表达明显增多;观察组与模型组比较,观察组TNF-ɑ表达明显减少,模型组TNF-ɑ随时间延长而表达增多,至第12周略微降低,观察组TNF-ɑ表达呈比较稳定的状态。病理学和统计学结果见表1。(2)CTGF表达的结果。模型组与空白组比较,CTGF表达明显增多;观察组与模型组比较,CTGF表达明显减少,模型组CTGF随时间延长而表达逐渐增多,观察组CTGF表达呈比较稳定的状态。病理学和统计学结果见表2。

表1 椎间盘内 TNF-ɑ 的表达情况

表2 椎间盘内 CTGF的表达情况
讨 论
在人类的椎间盘中发现大量的细胞因子,种类非常多,细胞因子的种类和数量依赖于椎间盘是否健康、退化或脱出。某些重要的研究已经澄清炎症因子可在椎间盘的自我平衡状态中表达或退行性病变中表达。更为重要的是髓核细胞、纤维环细胞、天然椎间盘细胞(native IVD cells)可生成这些介质。值得注意的是在椎间盘脱出(挤出组织、死骨)的患者案例中,椎间盘被其他类型的细胞侵入。例如肿瘤坏死因子-α在已死去的胎儿/幼儿和老年人成人的髓核细胞样本中大量表达。然而肿瘤坏死因子-α在青年人或年轻成人的髓核细胞中很少表达。在低于25岁的年轻成人的纤维环中没有发现肿瘤坏死因子-α的表达,但是在老年人的髓核细胞中显著增多。而且钙依赖性磷脂酶A2(calcium-dependent phospholipase A2 PLA2)为前列腺素E2(prostaglandin E2 PGE2)生成的调节因子,已经在尸体标本和外科标本中被发现,并且中年患者的椎间盘的钙依赖性磷脂酶A2的表达较高,相比于年轻的或年老的受试者,该现象表明钙依赖性磷脂酶A2在维持自我动态平衡方面具有重要的生理学作用[3]。像肿瘤坏死因子-α和钙依赖性磷脂酶A2等许多其他的炎症性关键介质都局限于非退行性人类椎间盘组织。重要的是椎间盘本来的酶的活性被研究,这表明在完整的椎间盘中,IL-1为关键的细胞因子,可介导椎间盘基质变性,IL-1通过测量酶的活性来对抗明胶、胶原Ⅱ型和酪蛋白基质(casein matrices)。而且在具有症状的退变性椎间盘中,MMP-10在mRNA和蛋白水平的表达呈增加状态,与无症状的椎间盘比较,IL-1可能促进基质的降解和伤害感受性的起始。许多已经鉴定的因子并不是在天然的椎间盘中的自发性生成,免疫反应性因子如IL-4、IL-6、IL-12和干扰素-γ在进行外科手术的椎间盘组织中呈中度表达,在脱出的椎间盘样本中表达更高。而在对照组的非退行性椎间盘中却不存在。早期研究在变性的椎间盘样本中检测到IL-1、细胞内粘附因子-1(intracellular adhesion molecule-1 ICAM-1)、淋巴细胞功能相关抗原(lymphocyte function-associated antigen LFA)和成纤维细胞生长因子(fibroblast growth factor)的存在。对于某些免疫反应性因子:IL-4、IL-6、IL-12、干扰素-γ、肿瘤坏死因子-α呈中度表达,但在脱出的退化性椎间盘中更为明显,并且伴有实质性的巨噬细胞浸润。而且病理性椎间盘高度表达IL-17,表明Th17淋巴细胞在脱出椎间盘病变中涉及到,其他的研究已经证明在脱出的椎间盘中有TNF-α、IL-Iβ、IL-6、IL-8、IL-20、PGE2和一氧化氮的高度表达。某些炎症性关键介质已经被证明与人类的椎间盘疼痛相联系。RANTES和IL-Iβ在疼痛性椎间盘组织中表达非常显著,相比于无痛性椎间盘组织,与IL-6和IL-8的表达相反。在神经生长因子(nerve growth factor NGF)中一个非常明显的不同被观察到,神经细丝-68生长相关蛋白(neurofilament -68 growth-associated protein GAP)-43和P物质在被入侵的神经纤维、在内和环绕在非脱出椎间盘的外层中发现,与椎关节强硬的椎间盘相比较[4]。另一项研究评估,在人类髓核细胞中的91种细胞因子和趋化因子相关性基因,表明髓核细胞为IL-6、CCL2、CCL7和CXCL8的来源。某些促炎性细胞因子通常在人类退变性椎间盘中表达水平增加,例如IL-Iβ和TNF-α,可能介导分解代谢反应减少,蛋白聚糖的生成和加强MMP的表达[5]。
虽然某些椎间盘退行性病变与炎症介质有联系,且在体外研究中已经得到鉴定。但是在体内研究中还未完全明确,最近的证据将重点集中于几种分子的作用,研究的主体在大鼠、兔子和猪类动物模型中进行。在椎间盘脱出的大鼠动物模型中,髓核暴露可导致IL-6、TNF-α和TNF-γ水平的增加,其他细胞因子(IL-Iβ、IL-I0、IL-Iα和IL-I2)已经在外科手术中增加,表达水平不再发生改变[6]。在另一项研究中,TNF-α在大鼠椎间盘脱出模型中的表达得到鉴定,TNF-α与根部疼痛相联系。而且大鼠尾部环形切口的模型证明IL-Iβ在损伤后4天呈现短暂性高峰。这个模型以髓核体积减少为特征,环状胶原层破裂、环形成纤维细胞组织化生成为软骨样细胞。然而TNF-α和IL-6的表达没有观察到显著的变化。在家兔的腰椎环形切口模型中,IL-1α和TNF-α基因在全部的椎间盘中没有观察到发生变化,在损伤后的1周或3周内。在相同的模型中,IL-1β、转化生长因子和诱导性一氧化氮合酶在第3周后基因表达增加,但是在第6-12周表达水平下降,在24周形成第2个高峰,很可能显示出长期的促炎性作用[7]。在家兔的椎间盘脱出模型中,TNF-α、IL-1β和MCP-1。MCP-1被描述为一个有能力的巨噬细胞化趋化因子被进行研究分析:TNF-α和IL-1β通过免疫组织化学技术在1天后被检测到,随后为MCP-1,损伤后3天检测到。浸润细胞主要为巨噬细胞在3天后也被观察到。有趣的是,猪腰椎环形切口模型的IL-8表达水平的显著增加,并且观察到伴随着IL-1表达水平的下降,在椎间盘进行椎间盘进行椎间盘切除后的第12周,同时没有在椎间盘形态、蛋白聚糖含量以及在IL-6和TNF-α的表达水平方面观察到差异性,未处理组和损伤组的椎间盘之间[8]。然而IL-1和IL-8具有促炎症特性,研究者建议椎间盘切除手术有可能刺激椎间盘修复反应的开始,鉴于IL-8作为同化类激素药的表达水平增加,当分解代谢性的IL-1细胞因子表达水平降低时。
在椎间盘的骨生成方面,CTGF功能已经被研究的非常广泛。最近研究已经说明,CTGF在多种骨骼组织中显示出实质性功能,其在成骨细胞、破骨细胞以及椎间盘和颅缝生长之间中的作用被研究的比较集中。软骨:软骨成骨的形成是一个动态过程,间质细胞聚集分化导致生长平板软骨细胞的形成,生长平板软骨细胞在生长方面是以不同区域分布的,包括缓慢增殖储备群体和快速增殖柱状群体。伴随着有丝分裂后肥大前区域和最后末端分化肥大区域。肥大软骨细胞产生基质随后促进血管侵入和成骨细胞迁移导致软骨模板与骨的更换[9]。 CTGF不在间充质聚集区域进行表达,但是在生长板形成的早期阶段可以检测到。CTGF在增殖性软骨细胞中以低水平表达,在肥大软骨细胞中呈高水平表达。在生长板软骨细胞的表达已经确定其在CTGF促进中利用TCF/LEF功能域性通过经典Wnt通路进行调节。这项发现解释了CTGF在肥大软骨细胞中的高水平表达的原因。在生长板包含有高浓度的稳定性β-连接蛋白(β-catenin)。 CTGF剔除小鼠在出生高死亡率,并伴随着严重性软骨发育不全。CCN-/-软骨细胞显示出增殖和存活比率的降低,包括Ⅱ型胶原和聚集蛋白(主要的胶原和蛋白聚糖)[10]。
本研究表明,椎间盘内注射复方丹参注射液能够有效抑制炎性因子TNF-α和结缔组织生长因子CTGF的表达,对椎间盘退行性病变的进展起到延缓作用。

