走马胎三萜皂苷合成相关基因表达分析
雷宇阳, 李 霁, 赵丽云, 罗 鸣, 陈红锋*
( 1. 中国科学院华南植物园, 中国科学院植物资源保护与可持续利用重点实验室, 广州 510650; 2. 中国科学院大学, 北京 100049; 3. 广东省应用植物重点实验室, 广州 510650 )
走马胎()在APGⅢ系统中隶属于报春花科紫金牛属植物,其作为民族药应用已久,最早见之于《陆川本草》及《岭南采药录》,记录了其治疗风湿骨痛、跌打损伤及止痛等功效,是黎族、瑶族等少数民族的常用药材,有祛风补血、活血散瘀、消肿止痛的效用(周泽建,2017)。现代科学研究确认了走马胎的药用价值,报道了其药效成分主要为三萜类、甾醇类、酚类、醌类等次生代谢物(戴卫波等,2017);走马胎全株组织均有三萜皂苷的存在(魏蓉等,2015)。穆丽华等(2011)、Mu等(2013)在走马胎中提取了7种三萜皂苷类化合物,其中有1种是首次从紫金牛属植物体内获得,并且发现其对6类肿瘤细胞株有一定程度的抑制作用。迄今为止,有关走马胎药用成分的调控过程及相关分子基础的研究尚未见有报道。
三萜皂苷种类多、结构复杂,母核的结构修饰以及调控包含了许多步骤,涉及多种不同的酶促反应,至今仍存在许多不明之处。由于走马胎遗传背景的长期缺失,功能基因组方面研究进展缓慢,限制了走马胎三萜皂苷合成分子基础研究的深入,目前其药效成分的调控途径尚不清晰。实时荧光定量PCR技术相比传统PCR反应具有准确定量以及不易交叉污染的优点,自1992年Higuchi提出以来,广泛运用于研究基因表达以及克隆新基因的重要技术等领域(樊庆鲁和肖国樱,2010)。
在植物中,皂苷是一类种类多样的次生代谢物,其功能是抵御微生物、病菌和其他虫害(Papadopoulou et al., 1999)。因此,植物的根往往含有更多的此类次生代谢物,相比其他组织,根所处的土壤环境复杂,土壤-根系-微生物三者相互作用,需要抵御病虫害的侵蚀从而刺激相关防御基因高表达导致次生代谢的生成(Ji et al., 2015;Rasmann et al., 2011)。同时,植物的防御反应是通过与环境相互作用刺激信号转导来诱导的,而信号转导通常是由植物激素来完成的。在植物激素中,茉莉酸甲酯(methyl jasmonate, MeJA)和水杨酸(salicylic acid, SA)是参与防御相关信号转导的内源植物激素,特别是次级代谢产物的产生(Wang et al., 2015)。当利用SA和MeJA进行外源性应用时,它们已被证明可诱导三萜皂苷生物合成相关基因的上调(常越等,2016)。
本研究以走马胎为材料,通过比较根、叶不同组织部位及SA、MeJA激素处理后的三萜皂苷含量的变化,并利用qRT-PCR技术分析了三萜皂苷合成通路上相关基因表达差异。尝试从分子水平阐释走马胎三萜皂苷合成通路关键基因变化,为后续相应的功能基因的验证以及合成生物学研究提供参考,从而在分子水平上更好推动走马胎这种珍贵的民族药的保护和开发利用。
1 材料与方法
1.1 材料
供试材料为统一播种生长2 a的盆栽走马胎植株,来源于中国科学院华南植物园岭南中药材保护品种种质资源圃,走马胎幼苗的种子均产自广东省南雄市。经中国科学院华南植物园植物科学研究中心陈红锋研究员鉴定为报春花科紫金牛属植物走马胎()。
1.2 栽培处理
选取生长状况相似的走马胎苗分为3个实验组:水杨酸处理组、茉莉酸甲酯处理组以及对照组,每组各3株作为3次生物学重复。SA与MeJA浓度皆为1 mmol·L,喷施叶面至有液滴滴下,每天8:00、12:00、18:00各处理1次,共处理7 d。对照组在相同的时间里进行蒸馏水喷施处理。经过7 d栽培处理之后,对3个组分别进行统一采样,叶片采样剔除叶脉部分,根部采样只选取须根部分,把采集到的材料用液氮速冻后保存于-80 ℃冰箱中。
1.3 三萜皂苷含量测定
总三萜皂苷含量测定参考徐睿庸(2007)的方法并加以改进。精密移取0.116 mg·mL的齐墩果酸标准液1、2、3、4、5 mL蒸干溶剂后,加0.2 mL现配的5%香草醛-冰醋酸溶液和0.8 mL高氯酸溶液。在80 ℃水浴中反应15 min,冰浴冷却后,各加5 mL乙酸乙酯,在550 nm处测定吸光度,以质量浓度(mg·mL)对吸光度值()进行线性回归,得到标准曲线。
采集各组走马胎鲜叶和鲜根,冲去泥沙,挑选并除去杂质,尽量避免水浸。放至烘箱,50 ℃恒温烘干到恒重,取出后移至粉碎机,打碎后即得粗粉。取粗粉约0.2 g,精密称定,加入50%乙醇50 mL,室温下超声波提取30 min(功率为240 W),过滤,滤渣与锥形瓶用50%乙醇20 mL分数次洗涤,合并滤液和洗液于250 mL茄形瓶中,减压回收溶剂至无醇味(约15 mL)。定量转移至分液漏斗中,加入等体积水饱和石油醚(约25 mL)萃取3次,每次振摇2 min,静置使分层,弃去石油醚层,水层定量转移至50 mL容量瓶中,用乙醇稀释至刻度。精密移取走马胎叶提取液0.5 mL以及根提取液1.0 mL于20 mL具塞试管中,空气吹干,精确加入0.2 mL现配的5%香草醛-冰醋酸及0.8 mL高氯酸,涡旋混匀,80 ℃水浴10 min,紧接着进行5 min冷却,之后加入5 mL乙酸乙酯,混匀,测定其在550 nm下的吸光度。
三萜皂苷含量(mg·g)=()/。
式中:为根据吸光度以及标准曲线算出的三萜皂苷质量浓度(mg·mL);为提取液体积;为样品粉末质量。
1.4 RNA的提取及cDNA文库的合成
走马胎的根部和叶部总RNA提取按照EastepSuper总RNA提取试剂盒(LS1040,Promega)建议的流程进行操作,并根据实验的效果进行适当优化,延长金属浴裂解样品时间以提高提取质量。在提取后使用1.0%(/)的琼脂糖凝胶电泳,NanoPhotometer分光光度计和Agilent 2100生物分析仪评估总RNA的质量、纯度和完整性。反转录RNA采用Go Scrip Reverse Transcription Mix,Oligo(dT)(A2790,Promega)反应体系,按照制造商建议的流程进行反转录合成cDNA。
1.5 荧光定量PCR分析
根据本课题组前期对走马胎转录组测序的结果(Lei et al., 2022),以目前研究已鉴定与三萜皂苷合成各个环节相关的蛋白为对象,进行BLASTP比对,获得走马胎三萜皂苷合成所涉及到的一系列基因,分别编码的是2个5-二磷酸月桂酸脱羧酶(5-diphosphomevalonate decarboxylase,PMD,MVA途径)、1个4-羟基-3 -甲基丁-2 -烯基二磷酸合成酶(4-hydroxy-3-methylbut-2-enoyl diphosphate synthase,HDS,MEP途径)、1个鲨烯合酶(squalene synthase,SS)、2个鲨烯单加氧酶(squalene monooxygenase,SM)、5个细胞色素P450(cytochrome P450,CYP450)家族蛋白以及4个尿苷二磷酸葡萄糖醛酸基转移酶(UDP-glucuronyltransferase,UGT)家族蛋白,并以走马胎肌动蛋白基因-为此次实验的内参基因。将以上基因通过NCBI ORFfinder工具进行开放读码框(open reading frame, ORF)预测,利用BLASTP确定编码区序列(coding sequence, CDS),根据各个基因的CDS序列通过NCBI Primer-BLAST进行引物设计。
利用普通PCR来检验引物的特异性以及cDNA文库的可用性。PCR的程序:95 ℃变性 5 min;95 ℃ 1 min,55 ℃ 1 min,72 ℃ 1 min,30个循环;72 ℃延伸 5 min。qRT-PCR的程序:95 ℃预变性 30 s;循环反应95 ℃ 10 s;60 ℃ 30 s,40个循环;熔解曲线95 ℃ 15 s;60 ℃ 60 s;95 ℃ 15 s。PCR扩增在Eppendorf Mastercycler X50h上进行,qRT-PCR反应在罗氏 LightCycler 480 qRT-PCR仪上进行。
1.6 数据分析
采用Microsoft Excel 2016软件进行数据整理,用IBM SPSS 22软件对数据进行单因素方差分析。所有数据均为3次生物学重复以及3次技术重复的平均值。

表 1 走马胎三萜皂苷合成相关基因引物序列Table1 Primer sequences of enzyme genes related to A. gigantifolia triterpene saponins synthesis
2 结果与分析
2.1 SA和MeJA处理对走马胎根、叶中三萜皂苷含量的影响
将前期分组培养的走马胎利用分光光度法进行总三萜皂苷的含量的测定(图1)。由图1 可知,3个处理组(CK、SA、MeJA)根部组织的三萜皂苷含量分别为0.56、0.53、0.52 mg·g,相应的叶部组织三萜皂苷含量分别为0.31、0.25、0.25 mg·g。这表明在各个处理组内,走马胎根部组织的三萜皂苷含量皆远高于叶部组织的,证实了组织之间三萜皂苷的含量存在差异。通过组间比较发现,无论是叶部组织还是根部组织,2个处理组相比于CK组三萜皂苷含量皆显著降低(<0.05)。

柱上不同字母代表差异显著(P<0.05)。Different letters above column indicate significant differences (P<0.05).图 1 各组别走马胎不同部位三萜皂苷的含量Fig. 1 Content of triterpenoid saponins in different tissues of different A. gigantifolia groups
2.2 三萜皂苷合成相关基因在走马胎根和叶中的表达差异
为了解在不同组织部位之间,三萜皂苷合成相关基因的具体表达情况,通过qRT-PCR分析的方法对CK组的叶与根中15个基因的表达情况进行了比较。实验前对走马胎根部组织与叶部组织的总RNA质量进行了评估,RNA完整值(RIN)表明RNA降解程度较轻,/值与/值皆在2.0左右。这说明RNA受到较小的蛋白污染以及碳水化合物污染(表2)。根部组织各基因相对于叶部组织的相对表达量如图2所示,在根部组织中,15个三萜皂苷合成相关基因皆有不同程度的上调。将三萜皂苷含量较低的叶部组织各基因表达量设为1,这15个基因在根中的相对表达量分别为1(241.3)、2(2 460.0)、(1 834.4)、1(488.1)、2(78.5)、(4 708.7)、1(4 475.3)、2(135.4)、3(524.4)、4(485.9)、5(69.6)、1(2 242.8)、2(126.6)、3(36.0)、4(8.6)。走马胎根部组织三萜皂苷合成相关基因的表达情况与三萜皂苷在不同组织中的含量差异趋势保持一致。
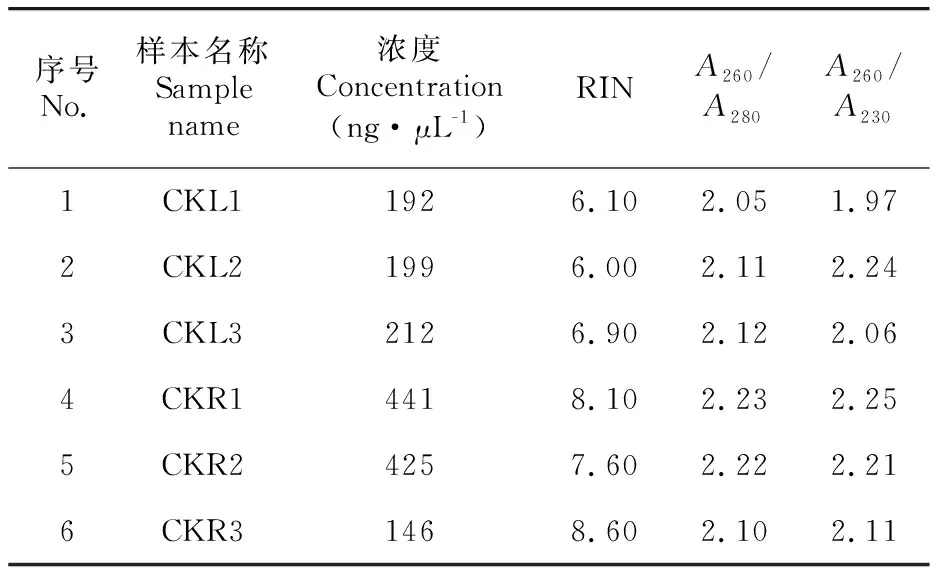
表 2 走马胎根与叶总RNA质量检测结果Table 2 Total RNA quality test results of A. gigantifolia roots and leaves

叶中各基因的表达量设为1,数据为根相对叶的表达量。Expression level of each gene in the leaf is set to 1, and the data in the figure are the expression levels of the root relative to the leaf.图 2 不同组织间三萜皂苷合成相关基因的表达分析Fig. 2 Expression analysis of genes related to triterpenoid saponin synthesis in different tissues
2.3 SA和MeJA处理对走马胎三萜皂苷合成相关基因表达的影响
SA和MeJA作为植物激素以及信号传导小分子,可以诱导植物进行防御反应从而产生次生代谢物。本研究在对走马胎进行SA以及MeJA外源喷施处理之后,将3组植株的叶作为材料进行基因表达量的比较。由表3可知,RNA提取结果质量良好。在上游合成步骤中,2个处理组与对照组相比,由异戊二烯单元到合成2,3-环氧鲨烯过程中所涉及到的基因,除SA组别的1以外,其他基因(如1,2以及2等)皆有不同程度的上调;而在下游合成步骤中,由2,3-环氧鲨烯到最终合成三萜皂苷的母核的结构修饰以及糖基化的这2个过程所涉及到的P450家族以及UGT家族,除SA组别的3以外,其他的都呈现下调的趋势(图3)。

表 3 两种激素处理后走马胎叶总RNA质量检测结果Table 3 Total RNA quality test results of A. gigantifolia leaves treated with two hormones

CK组中各基因的表达量设为1,数据为SA、MeJA组各基因相对CK组的表达量。柱上不同字母代表差异显著(P<0.05)。Expression level of each gene in the CK group is set to 1, and the data in the figure are the expression levels of each gene in the SA and MeJA groups relative to the CK group. Different letters above column indicate significant differences (P<0.05).图 3 植物激素处理后三萜皂苷合成相关基因的表达分析Fig. 3 Expression analysis of triterpenoid saponins synthesis-related genes after plant hormone treatment
3 讨论与结论
本研究利用qRT-PCR技术发现,走马胎的根部组织相对于叶部组织,三萜皂苷合成相关基因皆有不同程度的上调。这代表植物自主调控时在不同组织中三萜皂苷合成相关基因存在不同的表达模式,从而导致在走马胎根部组织内三萜皂苷的含量显著高于叶部组织。Baetz等(2014)研究表明,植物的根可能是最后的三萜皂苷的生物合成和储存器官。在药用植物人参中,CYP450家族在根茎中表达较多,而UGTs在根中表达较多。这2个器官可能分别是三萜皂苷生物合成的中间位点和最终位点(Han et al., 2012; Rai et al., 2016),而在走马胎的根中也出现了类似的表达模式。总的来说,植物根系经常积累高含量的次生代谢产物,如三萜皂苷。这可能是由于土壤环境的复杂性,根在土壤被迫密切接触有害微生物和害虫,因此需要进行一系列防御反应从而合成次生代谢物(苏文华等,2005)。
水杨酸(SA)与茉莉酸甲酯(MeJA)皆是一种植物内源激素以及信号传递分子,在植物抗环境胁迫中的信号传导作用受到广泛关注。前人在对SA、MeJA进行外源应用时发现,这些信号分子能够激发相关防御基因的表达,诱导植物次生代谢物的生物合成(常越等,2016;曹伍林等,2015)。本研究发现,相比于对照组,对走马胎进行外源SA和MeJA激素喷施处理后的总三萜皂苷含量会下降。这与积雪草()(Mangas et al., 2006)以及黑种草()(Elyasi et al., 2016)的研究结果有所不同。进一步进行本研究表明,2个处理组相比于对照组,三萜皂苷合成前期萜类化合物通用步骤相关基因上调,后期特异化修饰的相关基因下调。这可能代表SA和MeJA等信号传递分子虽然能刺激走马胎进行防御反应从而提高萜类化合物含量,但无法使修饰合成三萜皂苷的P450家族以及UGT家族进行高表达从而精确地对走马胎三萜皂苷的含量进行提升。
对不同组织间以及不同激素处理间基因表达模式的差异进行分析,合成途径上游的基因皆上调,而下游基因表达模式的不同造成了三萜皂苷含量变化的差异。由此推断,三萜皂苷含量的提高最有可能是与P450家族以及UGT家族相关基因的表达密切相关,走马胎三萜皂苷的合成可能更多地与下游特异化修饰的酶相关。对三萜皂苷合成路径进行分析发现,两种表达模式产生差异的节点是上下游合成途径的分界点鲨烯,考虑到鲨烯为三萜皂苷和甾醇共同的前体物质,可能跟代谢流分流相关,外源激素的喷施处理可能更多地刺激走马胎的代谢流流向植物甾醇方向参与维持细胞膜的稳定性。虽然有学者试图通过过表达鲨烯合酶基因以提高人参皂苷和柴胡皂苷的含量,但没有达到预期效果,更多地增加了植物甾醇的含量,这与本研究中走马胎外源激素处理后的表达模式类似(Lee et al., 2004;Kim et al., 2011)。
综上所述,不同组织中的特异性积累以及植物信号分子的诱导都会导致走马胎三萜皂苷含量的变化。这些差异与三萜皂苷合成相关基因的表达密切相关。通过植物信号分子诱导虽然能使萜类化合物合成上游相关基因进行高表达,但对某一特定目标产物如三萜皂苷可能达不到预期效果,在实际生产中需要精确对参与修饰三萜皂苷的P450家族以及UGT家族进行调控。此外,在根部三萜皂苷的高积累以及整个合成步骤相关基因的高表达表明,三萜皂苷的产生可能是在转录水平上受到调控的。因此,对于实际应用生产,除了引入多种生物合成酶基因外,转录因子工程改造可能是一种修饰生物合成途径的有前途的方法。

