冰灯玉露愈伤组织诱导再生体系及组培苗形态建成研究
杨玉珍,张耀武
(南阳农业职业学院植物组织培养中心,河南南阳 473000)
冰灯玉露为百合科十二卷属中软叶类多肉植物,原产于南非,植株低矮,叶片呈莲座状紧凑排列,叶色碧绿,叶片顶端具晶莹剔透的透明窗,“窗”大而透亮,具有较高的观赏价值,故名为“玉露”,是百合科具有代表性的花卉品种,具有良好的市场前景,受到园艺工作者和花卉爱好者的青睐。近年来,我国和日本园艺工作者将从海外引进的玉露品种通过筛选,选择特征明显的优秀良种,再经过不同品种间相互授粉、育苗、选种的过程培育出冰灯玉露、紫肌玉露等精品玉露,为保证这些精品玉露的优良性状,通常采用叶插和底座繁殖等无性繁殖方式,这些繁殖方法易损害母本,然而玉露本身生长速度慢,繁殖系数小,繁殖速度极慢,难以满足市场需求,导致其价格居高不下。近年来,采用组培快繁技术对多肉植物进行繁殖的研究较多,而由于常规育种一些新的性状很难通过杂交的方法获得,通过组织培养诱导愈伤组织建立遗传转化体系进行诱变育种、体细胞杂交、转基因技术等种质变异研究,是培育新品种的重要途径,因此, 获得胚性愈伤组织是种质创新育种的关键。
通过组织培养技术繁殖的商品苗,在外观形态上与分株或播种繁殖苗存在明显差异,其中组培苗基部叶片细长畸形,观赏效果差,将这些叶片去除后导致植株整体形态不完整,从而失去观赏价值。这是由于瓶中移栽出的组培苗叶片细长,厚度不足,整体植株细弱,生长势不强,有些组培苗不生根,即使生根也很细弱,且容易烂掉,导致组培苗需要数月乃至更长时间的驯化硬化阶段,新生叶才能恢复其正常的品种特征,呈现出观赏特征,这种情况不仅增加了培养时间,提高了生产成本,还影响了商品价值,从而使这一技术的应用受限。然而,探索在组培增殖阶段和壮苗阶段克服这项技术难题,目前在该领域鲜见报道。笔者以冰灯玉露叶片作为外植体,诱导产生松散的胚性愈伤组织,进行离体再生,研究不同激素组合、培养方式对诱导松散型愈伤组织、诱导不定芽建立再生体系及建成促进正常形态的影响,建立一套完整的组织培养植株再生体系,旨在为冰灯玉露遗传变异、转基因育种及快速繁育优良新种质提供技术支持。
1 材料与方法
供试材料为冰灯玉露。
外植体的选取和预处理。将冰灯玉露基部成熟叶片摘下,用洗涤剂溶液浸泡5 min左右,用软毛刷仔细清洗,用自来水冲洗1 h。
外植体的灭菌与初代培养。在超净工作台上,将预处理的外植体叶片用75%乙醇溶液灭菌10 s,然后将0.1% HgC1溶液倒入烧杯中灭菌14 min ,再用无菌水冲洗5遍后,将叶片接种在不同初代培养基上。选取MS培养基为基本培养基,3%蔗糖,0.5%琼脂,pH 5.6。以6-BA、2,4-D和NAA 3种激素的较低水平进行组合试验,每处理10瓶。接种25 d后观察愈伤组织诱导情况。培养条件:光照强度2 500 lx,光照时间12 h,温度(23±1) ℃。
不定芽诱导培养。愈伤组织培养一段时间后,自叶片基部切下转入不定芽诱导培养基中,选取6-BA和NAA进行不同浓度的组合配比试验,以MS培养基为基本培养基。每处理20瓶,20 d后观察不定芽诱导情况,筛选最佳增殖培养基。不定芽增殖到一定数量后,转入丛生芽增殖培养基。
丛生芽增殖培养。当丛生芽长到1.5~2.5 cm,具3~4片叶时自底部切下,转入生根增殖培养基上进行继代增殖,每瓶接种5株小苗。选择1/2MS为基本培养基,以不同浓度的NAA和NAA进行增殖培养试验,附加0.3%活性炭,接种30 d后调查幼苗生长情况。
不同激素对冰灯玉露形态建成的影响。经过增殖培养获得的冰灯玉露组培苗在移栽前形态与自然生长苗存在较大差异。为了在移栽前对组培苗进行形态重建,将组培苗转移至含有不同激素的培养基上进行培养,以获得生长外形与自然状态下一致的幼苗。每瓶加入50 mL培养基,每处理20瓶,每瓶接种2个再生苗。培养条件:25 ℃,24 h连续光照,光照强度2 000 lx。接种后每天观察再生苗的生长情况,经过约40 d培养,观察再生苗在不同培养基上的形态变化情况。
不同光照强度对冰灯玉露形态建成的影响。冰灯玉露形态重建苗在炼苗移栽阶段温度和光照都会影响其性状,通常在温室温度保持在20~28 ℃时进行炼苗移栽,这时光照强度对组培苗的形态影响较大。先带瓶置于加盖遮阳网的大棚中不开盖进行过渡炼苗,7 d后逐步开盖,清洗培养基,栽植到蛭石、小石子、草炭土、粗沙混合培养土上,防止强光照射。
对比炼苗阶段不同光照强度对提高形态重建率的影响,采用4 000、3 000、2 500、2 000、1 500 lx的光照强度对冰灯玉露小苗进行炼苗硬化。
2 结果与分析
外植体叶片在愈伤组织诱导培养基上培养25 d后,观察统计愈伤组织生长情况,结果见表1。由表1可知,使用低浓度6-BA和NAA组合愈伤组织诱导率低,愈伤组织较硬,不利于下一阶段不定芽的诱导;添加2,4-D后诱导率较高,2,4-D浓度≥0.8 mg/L时,更有利于疏松愈伤组织的诱导,浓度越高,愈伤组织越疏松,颜色越淡,甚至出现玻璃化现象。通过图1对比分析发现,添加低浓度6-BA有利于愈伤组织的形成,但浓度为1.0 mg/L时有部分不定芽萌出。综合分析可知,冰灯玉露愈伤组织最佳诱导培养基为MS+6-BA 0.5 mg/L+2,4-D 0.8 mg/L+NAA 1.0 mg/L,愈伤组织分割后继续培养能增殖出大量疏松的愈伤组织,是后期遗传转化研究和离体再生植株的最佳材料。
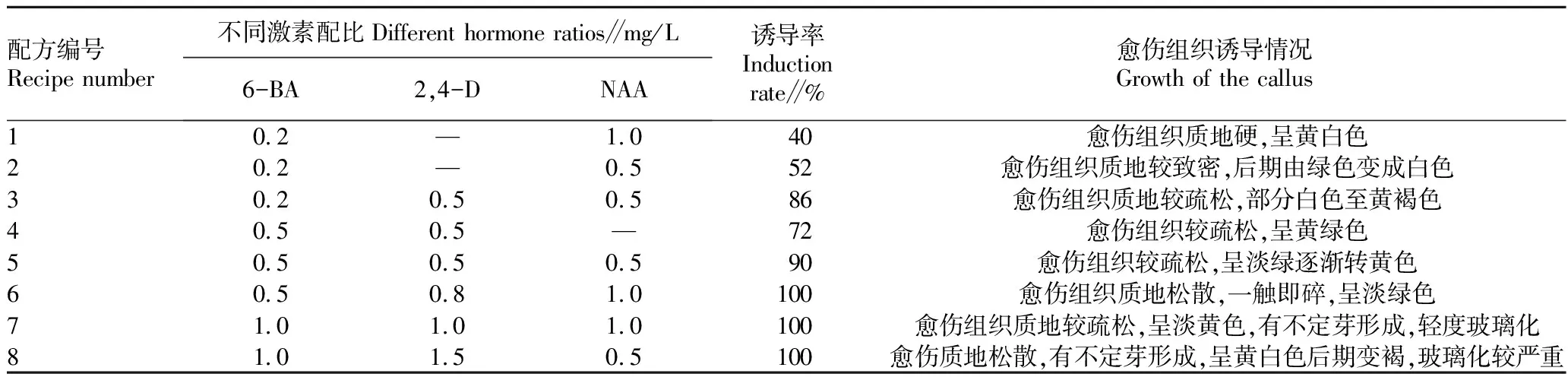
表1 愈伤组织诱导培养基激素配比
将诱导出的松散愈伤组织转移到不同浓度组合的不定芽诱导培养基中,接种后20 d调查丛生芽诱导生长情况,结果见表2。由表2可知,6-BA浓度在1.0 mg/L以下对不定芽的诱导作用不明显,添加IBA后对不定芽诱导也没有明显的促进作用,低浓度6-BA和较高浓度的NAA配比对丛生芽诱导生长有利,较高浓度的6-BA导致丛生芽分化率过高,细弱畸形,失去观赏性。从图2可以看出,配方6的生长情况最好,当6-BA浓度为0.6 mg/L,NAA为1.0 mg/L时,较有利于不定芽的分化,芽增殖倍数较高,苗健壮,叶色浓绿。因此,不定芽诱导最佳激素配比为配方6的6-BA 0.6 mg/L +NAA 1.0 mg/L。丛生芽在诱导培养基中生长25 d左右,将丛生芽切分后转入新鲜的增殖培养基中培养。继续移入附加6-BA 0.6 mg/L +NAA 1.0 mg/L的培养基中进行增殖培养,增殖倍数达4.7,每25 d左右继代1次。
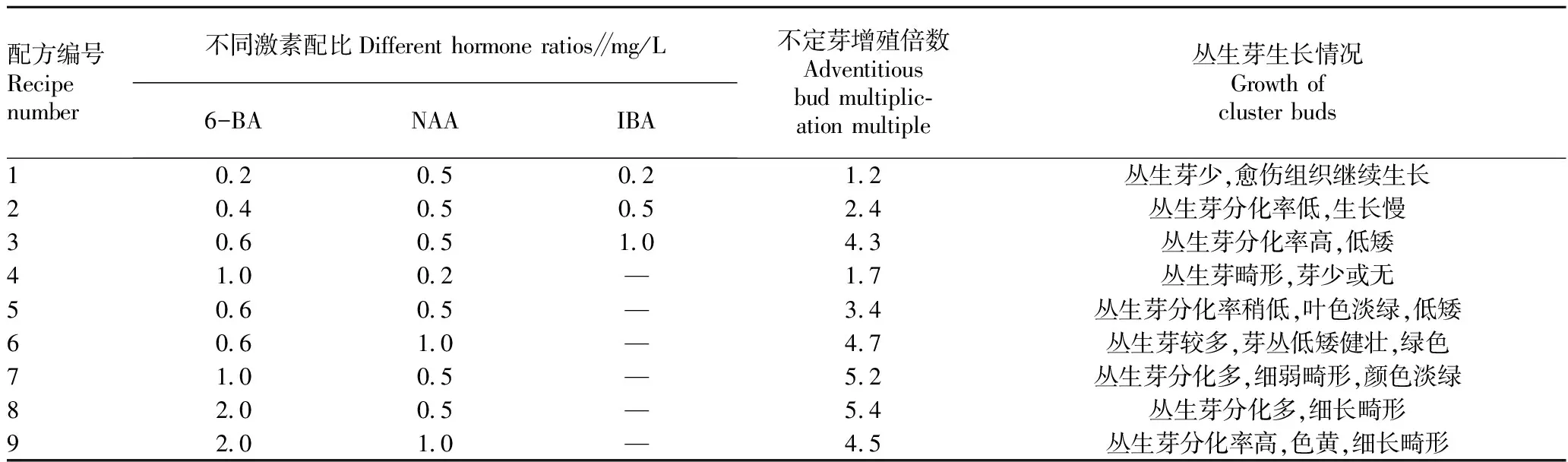
表2 不同激素配比对诱导不定芽的影响

注:A为配方1叶片基部长出少量愈伤组织;B为配方3叶片基部长出较大愈伤组织;C为配方4叶片基部长出淡绿色愈伤组织; D为配方8愈伤组织分割后继续培养有不定芽萌出,出现玻璃化现象;E为配方2愈伤组织颜色发黄、质地硬; F为配方4淡绿色愈伤组织分割后继续生长 Note:A is formula 1, a small amount of callus grows from the leaf base; B is formula 3, the leaf base grows large callus;C is formula 4, with pale green callus on the leaf base; D is formula 8,after the callus was divided and continued to be cultured, adventitious buds sprouted and vitrification occurred; E is formula 2, callus color is yellowish and hard;F is formula 4, the light green callus continued to grow after segmentation图1 成熟叶片诱导愈伤组织比较Fig.1 Comparison of callus induction from mature leaves

注:A为配方1诱导丛生芽生长情况; B为配方2丛生芽诱导生长情况;C~E为配方4~6丛生芽生长情况;F~H分别为配方7、6、8增殖阶段苗25 d生长情况; I为配方6增殖阶段苗40 d生长情况 Note: A is the growth of induced cluster buds in formula 1; B is the induced growth of cluster buds in formula 2; C-E are the growth of cluster buds in formula 4-6; F-H are the 25 days growth of seedlings in the proliferation stage of formula 7, 6 and 8,respectively; I is the 40 day growth of the multiplication stage seedlings in formula 6图2 不同激素配比丛生芽生长情况Fig.2 Growth of cluster buds with different hormone ratios
在前期不定芽诱导阶段控制增殖苗增速与培养时间,培养时间过长,增殖过多,密集苗后期形态受影响,因此培养时间掌握在25~40 d全部转接完毕,然后单株分栽到形态建成壮苗阶段培养基中,每瓶接种2株,个别大苗每瓶单株接种。每瓶培养基50 mL左右,以1/2MS培养基添加不同浓度和比例的NAA与IBA进行幼苗生根试验,结果见表3。由表3可知,添加不同浓度、不同比例的NAA与IBA对冰灯玉露幼苗形态建成、生根壮苗具有显著影响,单独添加一种激素如NAA或IBA时,冰灯玉露组培苗基本是形态不正常苗,这种苗的叶片较自然条件下细长,向上生长,植株过高,且形状与自然状态下的苗不同,叶片分布不规则,叶片上端具有观赏价值的“窗”不明显。该研究早期多批次试栽组培苗,移栽后需要很长时间的硬化阶段,重建自然形态,而且组培苗肥大的肉质根,导致植株生长缓慢,移栽时肥大根易脱落。组合后的生长素以IBA 1.0 mg/L+NAA 0.2 mg/L为最佳,利于组培苗的形态重建,叶片圆钝,排列整齐(图3),外观上与自然条件下一致。

表3 生长素种类和浓度对组培苗形态建成的影响

注: A~D为配方1、2、4、5的形态重建苗生长情况; E为配方6 形态重建苗生长情况; F为配方6形态重建苗从瓶中取出的生长情况 Note:A-D are to the growth of morphological reconstruction seedlings of formula 1, 2,4 and 5; E is the growth of morphological reconstruction seedlings in formula 6; F is the growth of the morphological reconstruction seedlings of formula 6 taken out of the bottle图3 不同激素组合组培苗形态建成情况Fig. 3 Morphogenesis of different hormone combinations
从图4可以看出,在不同光照强度条件下,组培苗在生长速度与形态上出现较大变化,炼苗过程中光照过强或过弱都会出现畸形苗。在光照强度为4 000 lx时叶片易失水,边缘皱缩,在光照强度为2 500 lx时效果最好,组培苗叶色正常,形态饱满,炼苗20 d后组培苗达到自然状态。光照强度2 500 lx 以下时,形态开始变薄变长,向高处生长,观赏价值低。因此,在炼苗硬化阶段,需要根据天气和遮阳网材料及时测定光照强度,调整措施,保证观赏性状最佳。
3 结论
该试验研究了不同激素配比对冰灯玉露愈伤组织诱导、不定芽诱导、增殖比率和单株形态重建和炼苗硬化阶段光照强度的影响,形成了一套完整的繁育体系,获得了与自然条件下形态一致的组培苗,结果表明:不定芽诱导增殖和单株形态建成阶段的激素配比决定了冰灯玉露组培苗硬化移栽前的植株形态,光照环境是造成组培苗炼苗畸形的主要因素。冰灯玉露愈伤组织诱导最佳培养基为MS+6-BA 0.5 mg/L+2,4-D 0.8 mg/L+NAA 1.0 mg/L,愈伤组织最佳分化不定芽培养基为MS+6-BA 0.6 mg/L+ NAA 1.0 mg/L,分化时间短且不定芽增殖倍数较高,为4.7;采用1/2MS+ IBA 1.0 mg/L+NAA 0.2 mg/L为形态建成壮苗生根培养基,可以获得生长形态正常(与品种特性相一致)的组培苗,按照该方案系统培养,冰灯玉露组培苗移栽到20~28 ℃温室环境下时,选择在光照强度为2 500 lx时,能够在短期内恢复其自然生长莲座状的特性,叶片肥厚圆钝,窗体透亮。

注:A~E分别为4 000、3 000、2 500、2 000、1 500 lx光照条件下组培苗生长情况 Note: A-E are the growth of tissue culture seedlings under 4 000,3 000,2 500,2 000,1 500 lx light,respectively图4 不同光照强度对炼苗的影响Fig.4 Effects of different light intensity on seedling refining

