张掖地区肉牛源腔隙莫拉菌的分离鉴定及生物学特性研究
王兴珍,张学虎,童建伟,孙鉴弘,姬宏伟*
(1.甘肃省张掖市甘州区畜牧兽医工作站,甘肃张掖 734000;2.甘肃省张掖市动物卫生监督所,甘肃张掖 734000;3.甘肃省张掖市甘州区平山湖蒙古族乡畜牧兽医站,甘肃张掖 734000)
近年来,随着我国肉牛养殖业的发展,其养殖量逐渐增多,个别的地区已经形成规模化、集约化的养殖模式。在肉牛养殖过程中,呼吸道疾病成为临床中常见的疾病之一。引起肉牛的呼吸道病原菌有多种,与运输及环境变化等应激因素有关,常常出现混合感染,其感染率和病死率均较高,给肉牛养殖业造成严重的经济损失[1,2]。腔隙莫拉菌(Moraxellalacunata)为革兰氏阴性菌,属于莫拉菌属(Moraxella)的成员。该菌主要寄居在温和动物皮肤、口腔黏膜、上呼吸道等,可以引起多种动物和人的肺炎、结膜炎、脑膜炎及慢性鼻窦炎等一系列的病症,也是引起呼吸道继发性感染的致病菌之一[3-5]。许多研究表明腔莫拉菌从患病的豚鼠、山羊、骆驼及犬等多种哺乳动物体内分离到,且分离得到的部分菌株致病性较强,呈逐年增加趋势,该菌为具有重要的潜在致病性细菌[6-7]。莫拉菌在医学上主要有腔隙莫拉菌、卡他莫拉菌、非液化莫拉菌等8种,引起人类感染的病例报道也呈逐年增多趋势。国内关于肉牛源腔隙莫拉菌的报道较少[8]。本研究对张掖地区肉牛不同养殖场采集患有呼吸道疾病的肉牛鼻腔拭子、肺脏及肝脏等病料组织进行腔隙莫拉菌分离鉴定,并对其进行致病性和耐药性研究,为肉牛腔隙莫拉菌引起的呼吸道疾病的防控提供参考依据。
1 材料与方法
1.1 材料
1.1.1 病料来源 2019年-2020年,从张掖地区肉牛不同养殖场采集患有呼吸道疾病的肉牛的鼻腔拭子、肺脏及肝脏等病料组织127份。
1.1.2 主要试剂 70 mL/L绵羊血平板、胰蛋白胨大豆肉汤(TSB)、胰蛋白胨大豆琼脂(TSA);革兰氏染色液试剂盒,购自北京陆桥生物科技有限公司;革兰氏阴性菌细菌生化鉴定试纸条、药敏纸片购自北京天坛药物生物技术开发公司;胎牛血清,购自四季青有限公司;DNA Marker DL 2000,2×TaqMarker Mix,均购自TaKaRa公司;细菌基因组提取试剂盒,购自北京天根物科技有限公司。
1.1.3 主要仪器 双人超净工作台,博科(BIOBASE)公司产品;全自动细菌生化鉴定系统,法国梅里埃公司产品;多功能PCR仪、凝胶成像仪,ThermoFisher公司产品;恒温培养箱,芜湖华测仪器设备有限公司产品。
1.1.4 实验动物 22 g~25 g昆明系小白鼠,购自甘肃农业大学动物科学院实验动物中心,由本单位动物疾病监测中心饲养。
1.2 方法
1.2.1 细菌分离培养 对患有呼吸道疾病的肉牛的鼻腔拭子、肺脏及肝脏等病料组织经过处理后,无菌条件下接种于70 mL/L绵羊血平板上,37℃培养12 h~24 h,挑取疑似菌落划线于TSA培养基(含50 mL/L胎牛血清),37℃培养12 h~24 h,挑取TSA培养基的单个菌落,接种于TSB(含50 mL/L胎牛血清)中进行震荡纯化培养后,进行革兰氏染色镜检。
1.2.2 细菌生化试验鉴定 参照革兰氏阴性菌细菌生化鉴定试纸条说明书,将分离菌株调整菌液浓度为0.5个麦氏浊度,接种于试条中,37℃培养12 h~24 h后,并观察试验结果。
1.2.3 细菌的PCR鉴定 参考文献[11],根据细菌16S rDNA基因序列设计细菌的通用引物,F:5′-CGCTATTTACCCAGTG-3′,R:5′-CGTTGAACACGAAGA-3′,目的基因1 500 bp,由上海生工生物工程股份有限公司合成。用细菌基因组提取试剂盒制备分离菌株的DNA模板,进行PCR检测,其PCR产物送上海生工生物工程股份有限公司进行基因测序,其测序结果与GenBank中登录序列进行同源性对比,选择代表株构建系统进化树,分离菌株的PCR检测、测序及构建系统发育进化树是由上海生工生物工程股份有限公司完成。判定标准:同源性≥99%,可以定义到种的水平;若同源性在97%~98.9%,可以定义到属的水平;若<97%,则定义为科水平。
1.2.4 人工感染致病性试验 参考文献[7]报道的方法,将分离菌株培养至对数期后菌落计数,调整菌液浓度108CFU/mL,每株菌腹腔注射5只小白鼠,剂量为0.2 mL,对照组接种等量的无菌PBS,接种12 h后观察6 d,记录发病及死亡情况,并进行细菌分离鉴定。
1.2.5 药敏试验 将纯化培养的分离菌株,调整菌液浓度为108CFU/mL,无菌条件下均匀涂布TSA培养基,每种药物3个重复进行药敏试验,取平均值。参照美国临床实验室标准化协会(CLSI)2017推荐的标准K-B纸片法进行和结果判定,统计分离菌株的耐药性。
2 结果
2.1 细菌分离培养
疑似腔隙莫拉菌的菌株在70 mL/L绵羊血平板上生长半透明的、圆形的、湿润的不溶血的单个菌落,且生长良好,在TSA平板上长出边缘整齐的、圆形凸起的乳白色的菌落(图1);革兰氏染色镜检可见分离菌株为两端钝圆的短杆菌,呈现单个或成对排列的细菌(图2)。

图1 分离菌株的菌落形态Fig.1 Colony morphology of isolated strains

图2 分离菌株的形态学观察(1000×)Fig.2 Morphological observation of isolated strains(1000×)
2.2 细菌生化检测结果
分离的菌株均不分解蔗糖、乳糖、鼠李糖、甘露醇、麦芽糖等,氧化酶反应、触酶反应为阳性,V-P试验为阴性,动力试验为阴性,不产硫化氢。与《伯杰菌鉴定手册》中腔隙莫拉菌生化特性基本一致,分离的79株病原菌初步鉴定为腔隙莫拉菌。
2.3 细菌的PCR鉴定结果
对初步鉴定为79株腔隙莫拉菌的分离菌株,用细菌通用引物16S rDNA基因序列进行PCR鉴定,结果显示,分离的79株均扩增出1 500 bp大小的目的基因条带,与预期相符(图3)。分离的菌株测序结果与GenBank中登录的15株腔隙莫拉菌参考株基因序列同源性在97.9%以上,参照判定标准,分离菌株可以判定为莫拉菌。

M.DNA标准DL 2 000;1~8.分离菌株;9.空白对照M.DNA Marker DL 2 000;1-8.Isolated strains;9.Blank control图3 分离菌株的PCR鉴定结果Fig.3 PCR identification results of isolated strains
选出代表菌株构建系统进化树,结果显示,分离菌株(Mor)与腔隙莫拉菌聚为一支,亲缘关系最近,与其他参考菌株位于不同的分支,亲缘关系较远(图4)。
2.4 人工感染致病性试验结果
攻毒组小白鼠在攻毒后的2 d~3 d,出现采食量减少、精神沉郁等不同程度发病状态,个别小白鼠未表现任何症状症状出现急性死亡。剖检死亡的小鼠,见肺脏、肝脏、脾脏等具有不同程度的出血,个别小白鼠出现腹腔积液。从死亡的小白鼠体内再次得到了腔隙莫拉菌,直到试验结束,对照组小鼠健康存活。通过统计,64株分离株能引起小鼠的死亡,为致病性菌株。
2.5 耐药性分析结果
用K-B药敏纸片法对64株致病性腔隙莫拉菌进行药敏试验,并进行耐药性检测。结果由表1可知,分离的64株致病性腔隙莫拉菌对阿莫西林、氨苄西林、庆大霉素、磺胺间甲氧嘧啶、新霉素、红霉素、强力霉素、大观霉素等8种抗生素耐药率较高,耐药率在66.7%~98.4%之间;对头孢噻呋、头孢噻肟、恩诺沙星、环丙沙星、氟苯尼考等6种药物耐药率在7.8%~30.2%之间。

▲:Isolated strains图4 分离菌株的系统发育树Fig.4 Phylogenetic tree of isolated strains
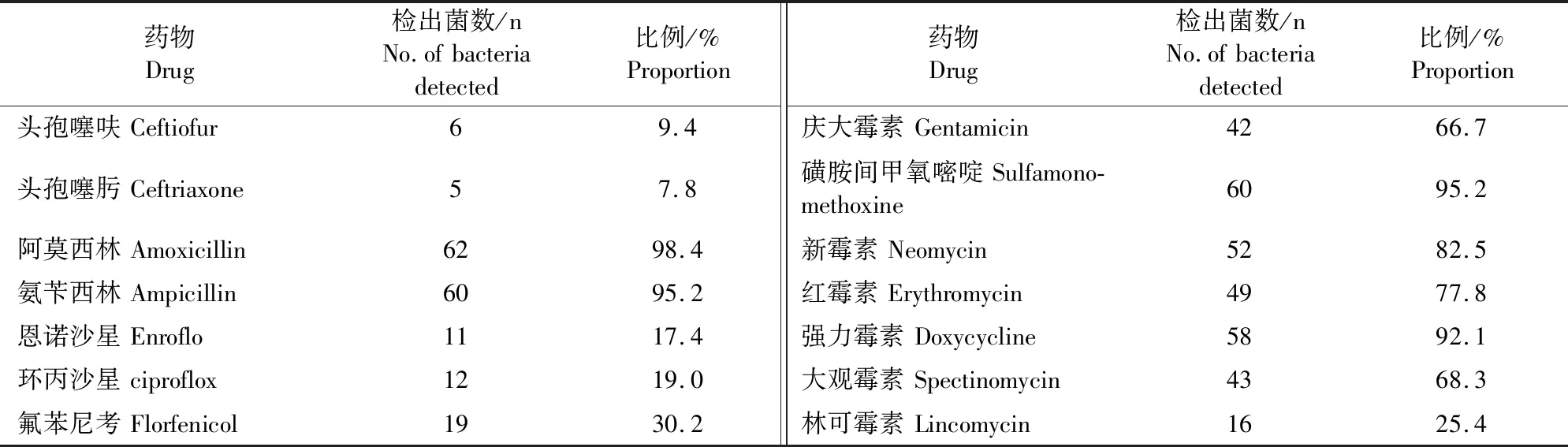
表1 耐药性结果Table 1 Results of drug sensitivity test
由表2可知,临床中分离的64株致病性腔隙莫拉菌呈现多重耐药性,耐14种药物有1株,耐13种药物有3株,耐12种药物有4株,耐11种药物有7株,耐7种药物的有5株,耐6种药物有4种,耐10、9、8种药物的分离菌株最多,分别占分离菌株的23.2%、21.9%和17.2%。
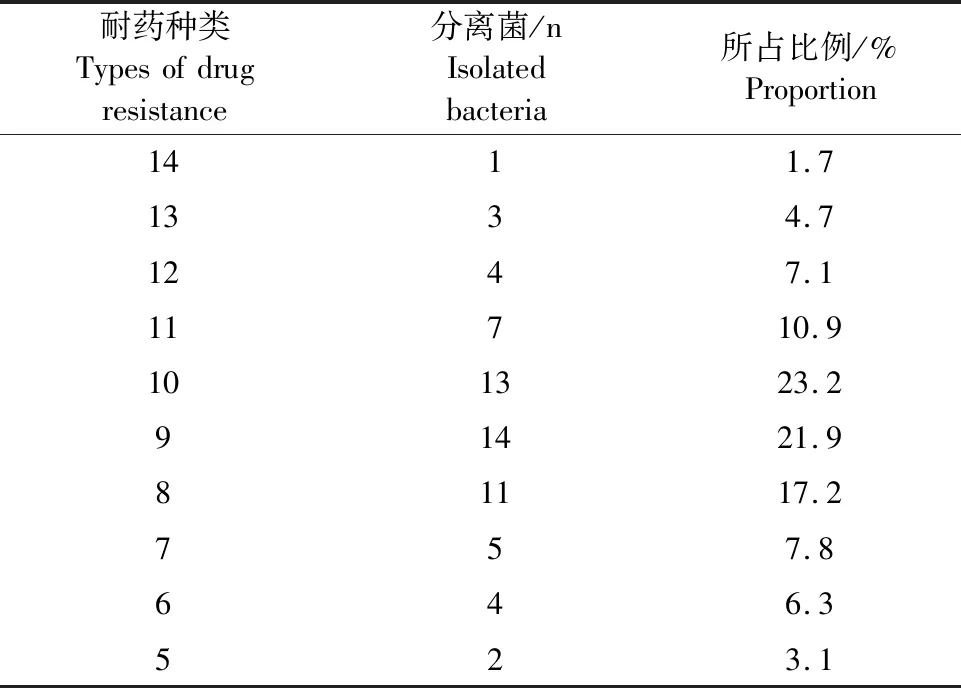
表2 多重耐药性检测结果Table 2 Results of multidrug resistance test
3 讨论
腔隙莫拉菌是人畜共患条件性致病菌之一,该菌是寄居于人类的口腔、上呼吸道、结膜中的正常菌群,尤其在机体抵抗力发生改变时,该菌可以生长、繁殖,引起儿童中耳炎、结膜炎、慢性鼻窦炎及咽炎等一系列的病症,临床中腔隙莫拉菌引起的侵入性感染比较少见[10-11]。根据国外研究报道,腔隙莫拉菌主要引起人败血症、心内膜炎、化脓性关节炎、尿路感染及男泌尿生殖道感染等。从脑脊液中分离到 1 株腔隙莫拉菌,具有致病性。谢林峰等报道从患病婴儿血液中分离到腔隙莫拉菌,近年来腔隙莫拉菌引起人类发病的病例报道逐年增多[12-15]。腔隙莫拉菌对人类危害较大,因此,医护人员和兽医科研工作者应该引起重视[16]。本研究表明,分离得到了79株腔莫拉菌,其中64株能引起小鼠发病,为致病性菌株,该菌对肉牛养殖业的安全生产及人类的健康可能存在潜在的风险。朱利霞等2019年首次从肉牛呼吸道疾病分离得到腔隙莫拉菌,在国内外有关肉牛呼吸综合征源腔隙莫拉菌报道较少,对其流行趋势有待进一步研究。董文龙等研究表明,临床分离的腔隙莫拉菌能跨物种传播,致使人类和山羊感染并引起发病[5]。腔隙莫拉菌对人类和动物均存在潜在的威胁。因此,在兽医临床中应该引起重视,防止该菌在人类和动物之间传播。
临床中动物细菌性疾病主要依靠抗生素治疗,应该根据药敏试验结果和结合动物本身的实际情况合理使用抗生素,提高治疗效果。本研究表明,分离的64株腔隙莫拉菌对临床常用的抗生素产生严重的耐药性。在临床中治疗肉牛腔隙莫拉菌引起呼吸症状时应该选择敏感的药物交替使用,同时注意环境的消毒。与朱丽霞等[7]、董文龙等[10]报道的腔隙莫拉菌耐药性存在一定差异性,可能与地区、感染的宿主(羊)及抗生素的使用有关。本研究可为肉牛源多腔隙莫拉菌引起呼吸道疾病的防控提供参考。

