桂皮醛诱导人宫颈癌Siha细胞凋亡并下调HPV E6/E7蛋白表达
紫若·塔里哈提,曙丽盼·木拉提,张伟怡*,周文婷*
1新疆医科大学药学院;2新疆天然药物活性组分与释药技术重点实验室,乌鲁木齐 830011
宫颈癌是妇女生殖系统中最常见的恶性肿瘤之一,超过99%的宫颈癌患者均伴有高危人乳头瘤病毒(human papillomavirus,HPV)的感染,其中HPV 16和HPV 18作为常见的高危表型[1]。近年来,其发病率明显升高,虽然药物放/化疗和手术治疗对早期宫颈癌有一定疗效,但对中晚期宫颈癌的治疗效果欠佳,且复发率高,副作用明显[2]。E6/E7作为宫颈癌中主要的致癌基因,是上皮细胞发生初始变化的原因,能够促进宿主细胞增殖和病毒扩增[3]。研究表明,HPV E6/E7癌蛋白成为治疗宫颈癌的潜在药物靶点[4]。因此,诱导E6/E7降解的天然化合物可能是抗宫颈癌药物的重要来源。
肉桂作为临床上的常用中药之一,具有“百药之长”的称号[5]。桂皮醛(cinnamaldehyde,CA)作为肉桂挥发油中的主要成分,是一种天然的小分子化合物[6]。研究表明,其具有解热、抗炎及降糖等多种药理活性,同时能够抑制非小细胞肺癌、肝癌、胃癌以及黑色素瘤等多种肿瘤细胞增殖,呈现出一定的抗肿瘤作用[7-11],但其诱导肿瘤细胞凋亡的分子机制尚未完全阐明,关于其抗宫颈癌的作用也少见报道。本研究利用人宫颈癌Siha细胞,检测CA在体外的抑癌效应及作用机制,为抗宫颈癌研究提供进一步的理论基础和实验依据。
1 材料与方法
1.1 主要试剂与仪器
1.1.1 主要试剂
人宫颈癌Siha细胞,购自武汉普诺赛生命科技有限公司。桂皮醛(CA)、紫杉醇(TAX)、顺铂(Pt)以及5-氟尿嘧啶(5-FU)购自上海源叶生物科技有限公司(纯度均≥ 98%)。CCK-8试剂盒(Lot No:BA08198147)、β-Actin、Bax、Bcl-2以及Survivin抗体购自北京bioss生物科技有限公司(纯度均≥ 98%);PAGE凝胶快速制备试剂盒(Lot No:20201230)、Hoechst 33342试剂盒(Lot No:20210623)、Annexin V-FITC/PI细胞凋亡检测试剂盒(Lot No:20210512)以及细胞周期检测试剂盒(Lot No:20201106)均购自北京索莱宝生物科技有限公司;细胞培养级别二甲基亚砜DMSO(Lot No:WXBD0293V)、DMEM高糖培养基(Lot No:2130206)以及胎牛血清FBS均购自美国Gibco公司;HPV E6及HPV E7购自美国Gene Tex公司;化学发光试剂盒(货号:2021601)及PVDF膜(货号:R1MB52546)均购自美国Millipore公司;HPR-goat anti rabbit抗体购自美国CST公司。
1.1.2 主要仪器
细胞培养箱、多功能酶标仪、高速低温离心机以及垂直层流洁净工作台(美国Thermo公司);荧光倒置显微镜(日本Olympus公司);流式细胞仪(美国BD公司);智能成像系统(上海Tanon公司);蛋白电泳设备(美国伯乐公司)。
1.2 方法
1.2.1 细胞培养
Siha细胞采用含10% FBS的不同培养基,37 ℃、5% CO2的细胞培养环境中培养细胞,根据细胞的生长情况约2~3天传代一次。
1.2.2 CCK-8法测定细胞增殖
Siha细胞,以3.0×103个/孔铺于96孔板内培养过夜。实验组分别加入不同浓度的化合物,空白组加入双蒸水(空白对照,药品用DMSO配成母液后,通过双蒸水进行稀释),对照组加入等倍稀释的溶剂DMSO(溶剂对照)。每组设3个复孔,培养72 h后,每孔加入10 μL CCK-8溶液,于37 ℃作用2 h,用酶标仪于450 nm处测定OD值。并按下列公式分别计算不同化合物对多种细胞生长抑制率。
细胞增殖抑制率 =
(OD溶剂对照-OD给药)/OD溶剂对照×100%
运用SPSS软件,根据不同浓度化合物对细胞生长抑制率分别计算出其IC50。
1.2.3 细胞迁移实验
在6孔板背面沿孔直径均匀划横线。Siha细胞以2.0×105个/孔铺于6孔板中培养过夜。用黄色吸头垂直于横线划痕。去培养基,PBS清洗2~3次,加入不含血清的培养基。实验组分别加入不同浓度的CA培养48 h,分别在划痕0 h和48 h后观察并拍照。使用Image J软件进行统计分析。
1.2.4 细胞周期的流式细胞仪检测
Siha细胞,以2.0×105个/孔铺于6孔板中培养过夜。实验组分别加入不同浓度的CA培养24 h。收集细胞样品于流式管中,4 ℃,1 200 r/min离心5 min后,弃上清,加入1 mL PBS重悬后,再次按上述方法重复洗涤,弃上清。加入纯度为95%的冷乙醇,混匀后置于4 ℃固定过夜。取上述固定细胞,4 ℃,1 200 r/min离心5 min后,去除乙醇后用PBS重悬,再次离心,重复此步骤两次。每管分别加入400 μL RNaseA酶,置于37 ℃孵育30 min。随后每管分别加入100 μL的碘化丙啶(propidium iodide,PI)染色液,避光置于4 ℃孵育30 min后,上机进行流式检测。最后采用Modfit软件分析实验结果。
1.2.5 Hoechst 33342荧光染色法鉴定凋亡细胞
Siha细胞以5.0×104/孔铺于共聚焦小皿中培养过夜。实验组分别加入不同浓度的CA培养24 h。弃去培养液,用4%多聚甲醛在4 ℃条件下固定15 min。弃固定液,Hoechst 33342染色液室温条件下染色15 min。使用荧光显微镜观测。
1.2.6 细胞中线粒体膜电位的检测
Siha细胞以3.0×105/孔铺于6孔板中培养过夜。实验组分别加入不同浓度的CA,阳性对照组加入10 μmol/L 解偶联剂(chloro carbonyl cyanide phenyl hydrazone,CCCP,能够携带质子穿透线粒体内膜),培养24 h。加入1 mL JC-1染色工作液,充分混匀,孵育20 min。随后,用1×的JC-1染色缓冲液洗涤2次。再加入2 mL细胞培养液,于共聚焦显微镜下观察。
1.2.7 Western blot检测
Siha细胞以3.0×105/孔铺于6孔板中培养过夜。实验组分别加入不同浓度的CA培养24 h。PBS清洗后,加入高效RIPA细胞裂解液,冰上裂解20 min,12 000 r/min离心15 min。分别收集上清,用BCA试剂盒进行蛋白定量。SDS-PAGE凝胶电泳后,电转移至PVDF膜上,经5%脱脂牛奶封闭后,分别加入按相应比例稀释后的一抗溶液(β-Actin、E6、E7、Bcl-2、Survivin及Bax),4 ℃孵育过夜。经TBST室温清洗3次,每次10 min。随后加入1∶5 000稀释的二抗溶液,室温孵育1 h。经TBST充分清洗后,加入化学发光液进行曝光检测。使用Image J软件进行灰度统计分析。
1.2.8 药物协同指数计算
利用CompuSyn软件,可计算出两种药物之间共同作用的联用指数(combination index,CI)。CI值>1,两种化合物为拮抗;CI值=1,两种化合物为相加;CI值<1,两种化合物具为协同。
1.2.9 数据统计分析
2 实验结果
2.1 CA抑制Siha细胞的增殖和迁移
首先对CA在不同时间、浓度下对Siha细胞的生长抑制作用分别进行检测。结果如图1A所示,CA呈时间、浓度依赖性地抑制Siha细胞的生长,且给药后24、48和72 h的IC50分别为110.96、85.52、47.05 μmol/L,说明CA能够抑制Siha细胞的增殖。
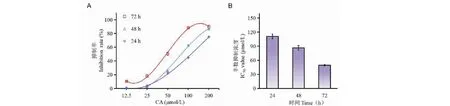
图1 CA对Siha细胞增殖的抑制作用(n = 3)Fig.1 Inhibitory effect of CA on the proliferation in Siha cells (n = 3)
为了进一步验证CA对Siha细胞生长的抑制作用,我们进行了细胞划痕实验。结果如图2所示,与空白对照组(Ctrl)相比,随着CA给药浓度的升高,能够明显抑制Siha细胞的迁移,证实CA能够有效抑制Siha细胞的迁移能力。
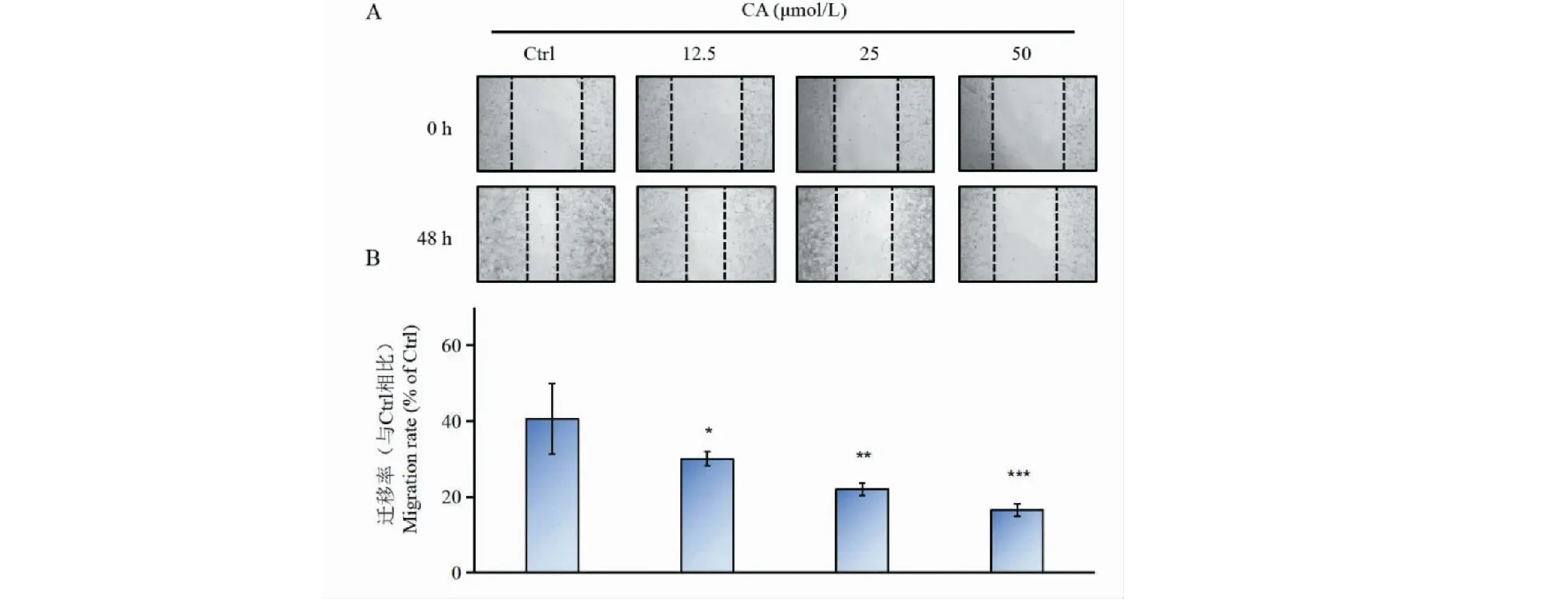
图2 CA对Siha细胞迁移能力的影响(n = 3)Fig.2 Effect of CA on migration in Siha cells (n = 3)注:与Ctrl组比较,*P<0.05,**P<0.01,***P<0.001,下同。Note:Compared with Ctrl group,*P<0.05,**P<0.01,***P<0.001,the same below.
2.2 CA阻滞Siha细胞周期并诱导凋亡
目前常用的细胞周期检测方法为PI染色,由于PI能够嵌入到DNA双链之间,从而被激光激发出红色荧光,随后再通过RNaseA酶孵育去除RNA。我们利用该方法,通过流式细胞术检测CA对Siha细胞周期的影响,结果如图3所示,与空白对照组(Ctrl)相比,随CA浓度的升高,G2/M期的比例从21.62%上升至33.91%,并具有明显的浓度依赖性,说明CA能够阻滞在Siha细胞的G2/M期。
为了分析CA是否能够诱导Siha细胞凋亡,我们首先通过Hoechst 33342染色观察细胞凋亡情况。结果如图4所示,CA处理后,细胞核呈现亮蓝色荧光,且具有浓度依赖性,提示CA诱导Siha细胞凋亡。为了进一步验证该结果,我们进行JC-1染色,通过荧光共聚焦显微镜观察CA作用于Siha细胞后线粒体膜电位的变化情况。结果如图5所示,与阳性对照组相比,随CA浓度的升高,剂量组绿色荧光显著增强,说明CA破坏了线粒体跨膜电位,诱导Siha细胞凋亡。
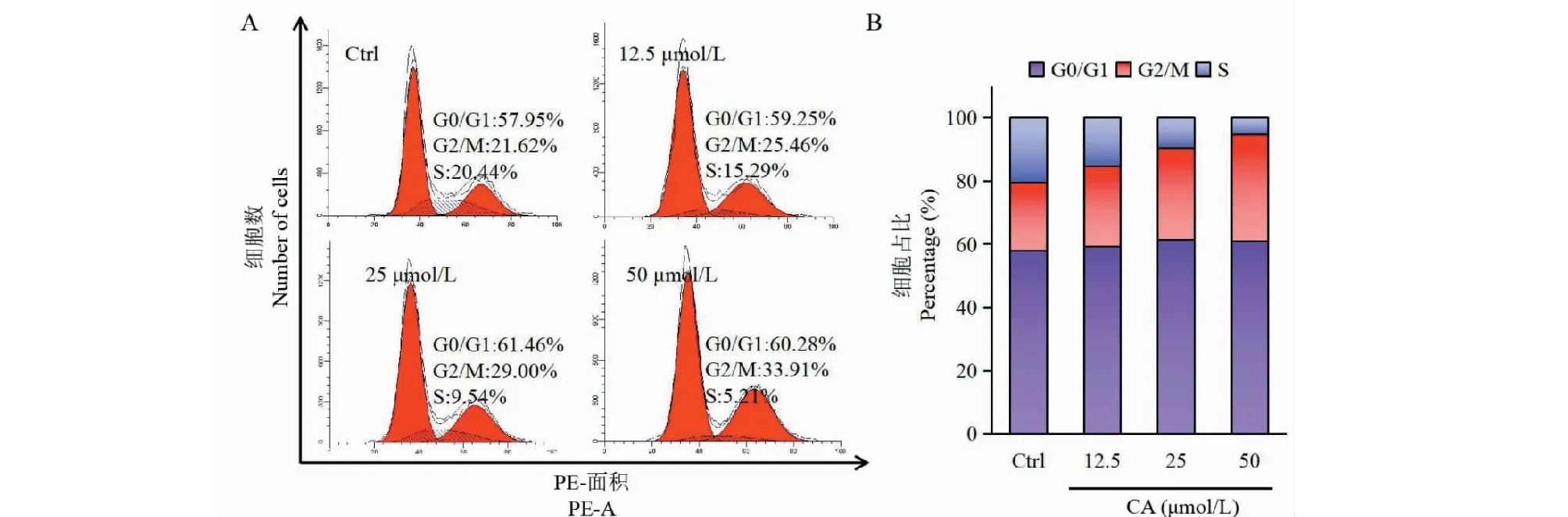
图3 CA对Siha细胞周期的影响Fig.3 Effect of CA on cell cycle in Siha cells

图4 CA对Siha细胞核染色质的形态学变化影响(标尺:50 μm)Fig.4 Effect of CA on the morphology of nuclear chromatin in Siha cells(scale:50 μm).
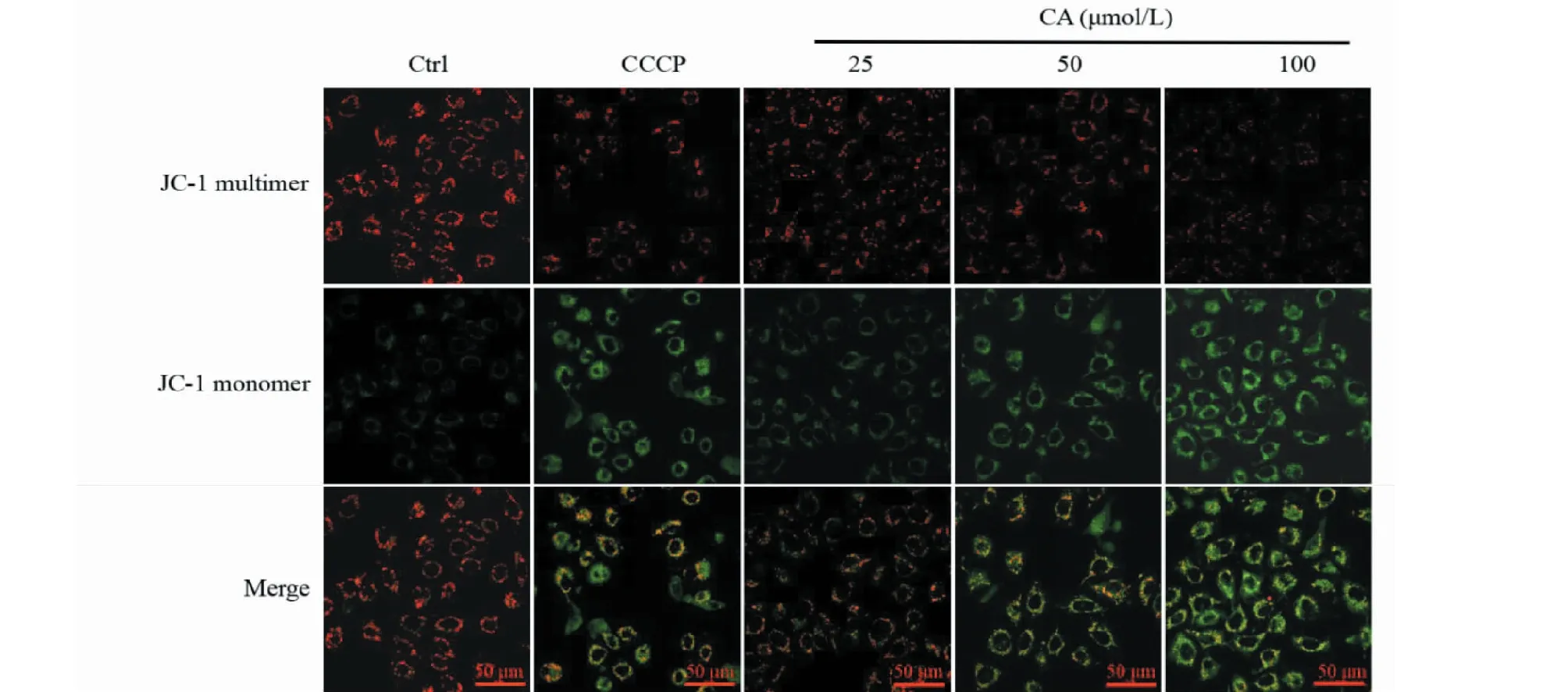
图5 CA对Siha细胞中线粒体跨膜电位的影响(标尺:50 μm)Fig.5 Effect of CA on mitochondrial membrane potential in Siha cells (scale:50 μm)
此外,进一步通过Western blot法检测了CA对Siha细胞中凋亡相关蛋白的影响。结果如图6所示,通过灰度统计分析可以看出,抗凋亡蛋白Bcl-2、Survivin的表达减少,促凋亡蛋白Bax的表达增多。以上结果均进一步证明了CA可以诱导Siha细胞发生凋亡。
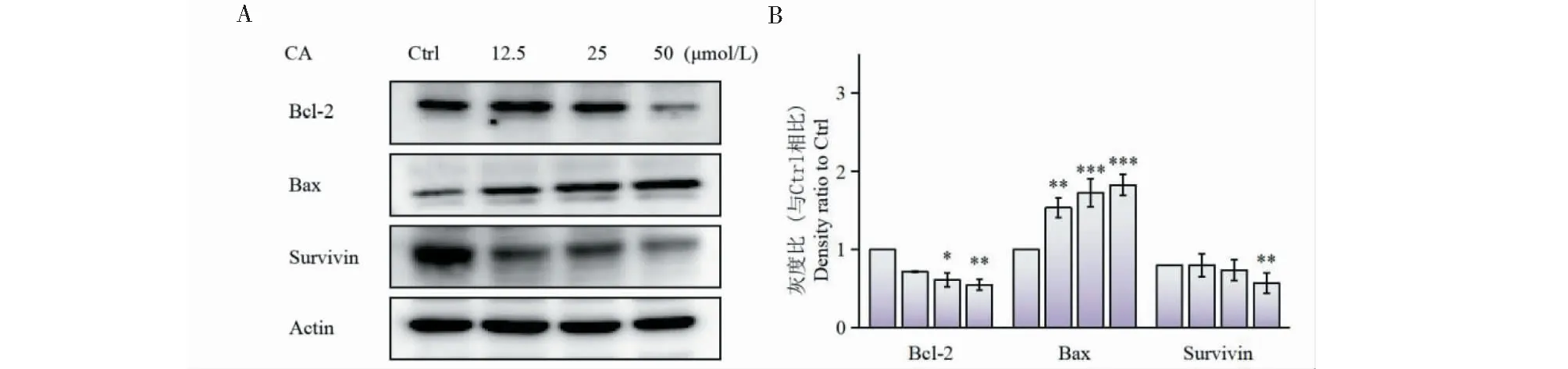
图6 CA对Siha细胞凋亡的影响(n = 3)Fig.6 Effect of CA on apoptosis in Siha cells (n = 3)
2.3 CA通过蛋白酶体途径抑制Siha细胞中HPV E6/E7的表达
考虑到HPV E6/E7在伴有HPV感染的癌细胞(如Siha)的生存中起着关键作用,我们进一步探究了CA对Siha细胞中E6/E7蛋白表达的影响。结果显示,CA显著降低了Siha细胞中E6/E7的表达水平,并呈现一定的浓度依赖性(见图7)。

图7 CA对Siha细胞中HPV E6/E7的影响(n = 3)Fig.7 Effect of CA on HPVE6/E7 in Siha cells (n = 3)
随后,进一步探究CA抑制E6/E7表达的作用机制。预先加入一种蛋白酶体抑制剂MG132处理1 h,再加入CA共同作用6 h后检测,结果如图8所示,当MG132与CA共同作用后,E6/E7表达明显增加,表明CA通过蛋白酶体途径抑制E6/E7表达。
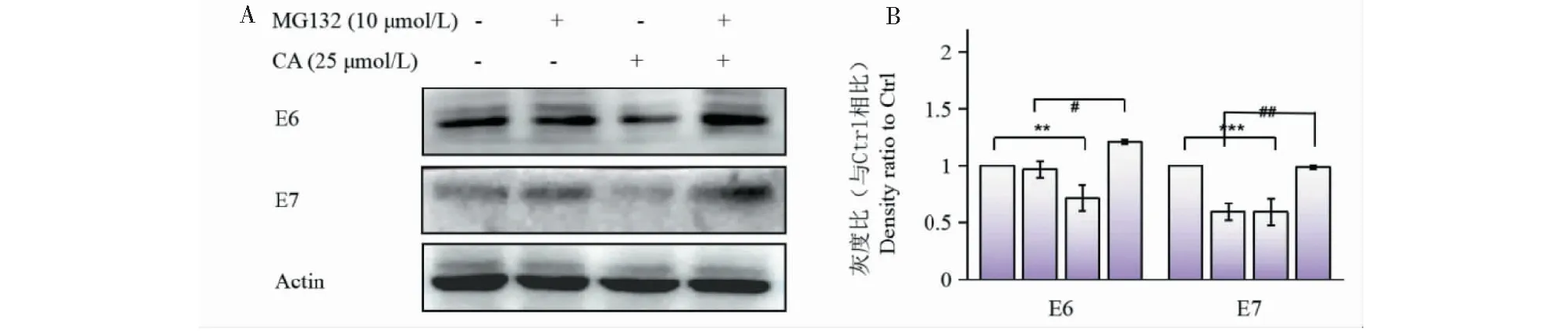
图8 蛋白酶体抑制剂MG132对CA抑制Siha细胞中HPV E6/E7表达的影响(n = 3)Fig.8 Effect of proteasome inhibitor MG132 on the inhibition of CA on HPV E6/E7 expression in Siha cells (n = 3)注:与Ctrl组比较,**P<0.01,***P<0.001;与MG132 10 μmol/L组比较,#P<0.05;##P<0.01。Note:Compared with Ctrl group,**P<0.01,***P<0.001;Compared with MG132 10 μmol/L group,#P<0.05;##P<0.01.
2.4 CA与不同宫颈癌化疗药物联用后具有协同效果
TAX、Pt以及5-FU均为治疗宫颈癌的常用化疗药物,为了检测CA是否能与这三种化疗药物产生协同效果,我们分别检测了TAX、Pt、5-FU这三种药物在Siha细胞中的抑制作用,并计算其IC50值。
首先对其单独在Siha细胞中的活性进行检测。结果如图9A、9B、9C所示,给药72 h后,其中TAX的IC50为16 μmol/L,Pt的IC50为36 μmol/L,5-FU的IC50为31 μmol/L。为了进一步检测其与CA联合在Siha细胞中是否有协同效果,我们根据其亚致死浓度,设定联合给药的浓度,并分别与CA进行联合给药考察抑制效果。通过计算IC50值发现,与单独给药组相比,TAX/Pt/5-FU分别与不同浓度的CA联用后抑制作用明显增强,且具有一定的浓度依赖性(图9D、9E、9F)。随后,将上述结果分别投入到联合指数计算软件中进行计算,发现TAX/Pt/5-FU与CA在一定浓度范围内均具有协同效果(图9G、9H、9I,协同指数见表1)。
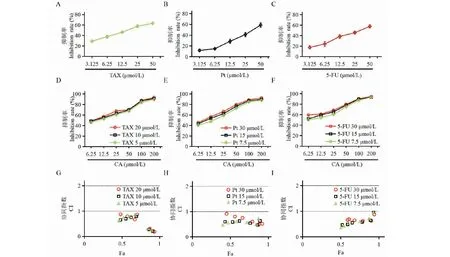
图9 三种宫颈癌化疗药物对Siha细胞的抗肿瘤效果及与CA的协同效果Fig.9 Anti-tumor effect of three cervical cancer chemotherapy drugs and synergistic effect with CA in Siha cells
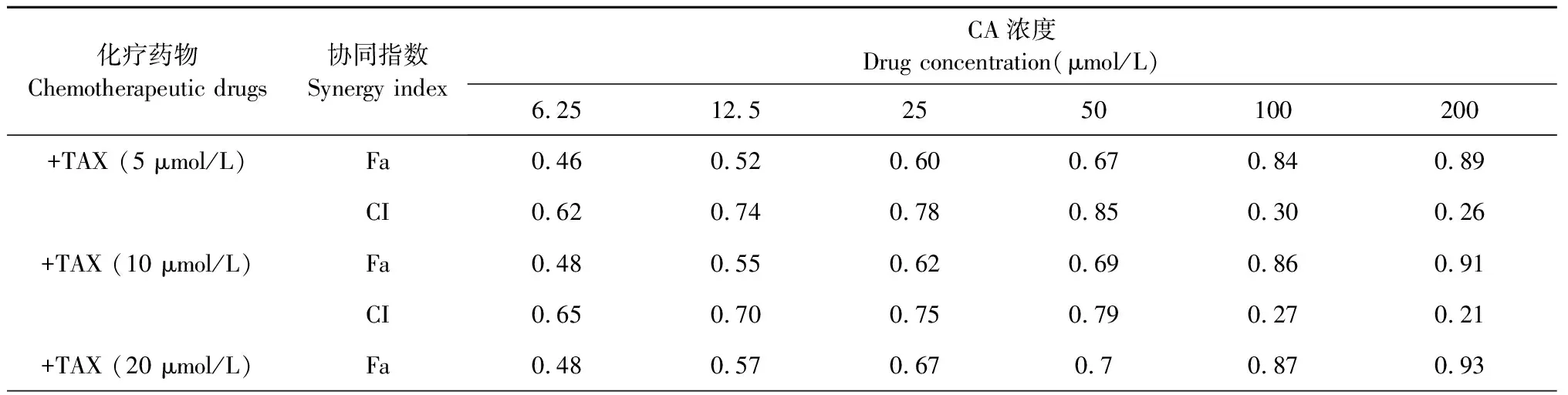
表1 CA联合三种宫颈癌化疗药物在Siha细胞中的协同指数

续表1(Continued Tab.1)
3 讨论与结论
宫颈癌是最常见的妇科恶性肿瘤之一,常伴有高复发率和高转移率的特点,严重威胁女性健康[12]。近年来,天然化合物通过抑制E6/E7,已广泛探索其作为宫颈癌治疗的潜在用途。例如,丹参酮IIA在转录水平抑制E6/E7,对宫颈癌细胞形成p53依赖的生长抑制[13];茴香酸通过蛋白酶体降解在蛋白水平下调宫颈癌细胞中的E6/E7表达,并诱导p53非依赖性线粒体凋亡[14];n-苄基肉桂酰胺通过抑制E6/E7 mRNA水平促进人宫颈癌细胞凋亡[15]。在本研究中,我们首次报道了CA能够诱导Siha细胞凋亡并下调HPV E6/E7蛋白的表达水平。
细胞周期异常是肿瘤形成的主要原因之一,其调控机制包括细胞周期驱动和监控。当驱动机制受损时,会促使正常细胞生长失控,并向肿瘤细胞转化;当监控机制受损时,会诱导细胞在DNA修复以及细胞死亡等环节发生功能紊乱,恶化整个调控机制[16,17]。我们通过流式细胞仪检测发现,CA能够诱导Siha细胞中G2/M期的细胞比例明显增加,说明CA阻滞在G2/M期。细胞凋亡是细胞程序性死亡的一种形式[18,19],其过程主要涉及死亡受体信号通路、线粒体信号通路和内质网信号通路[20,21]。其中“线粒体信号通路”中的代表蛋白为Bcl-2及Bax等,它们在接收到胞内的死亡信号后激活,在线粒体外膜或胞浆中产生相互作用,从而引起线粒体膜通透性的改变、跨膜电位的丢失,进而释放细胞色素C和其他蛋白[22]。前期实验我们首先通过Hoechst 33342染色证实CA诱导Siha细胞凋亡;随后通过JC-1荧光探针检测,发现CA显著降低Siha细胞中线粒体的跨膜电位;进一步的Western blot验证发现CA使Siha细胞中的抗凋亡蛋白Bcl-2,survivin减少,促凋亡蛋白Bax增多,进一步说明细胞发生凋亡。E6/E7蛋白有助于维持伴有HPV感染的宫颈癌细胞的恶性表型,并且能够调节许多与细胞存活、凋亡通路相关的分子。本文证明CA能够下调E6/E7的表达水平,从而诱导伴有HPV感染的Siha细胞发生凋亡。随后我们探究了CA诱导E6/E7降解的具体机制。结果证实用蛋白酶体抑制剂MG132预先作用后,能够明显减弱CA诱导的E6/E7降解现象,说明这两个蛋白之前是由于蛋白酶体而发生降解。
小分子药物对基因功能的影响都具有浓度依赖性[23]。如果一个小分子药物能够发挥抗肿瘤作用,它就可以采用亚致死浓度去筛选出能够与其协同致死的药物,这种方法被称为化学基因组学筛选策略[24]。由于目前临床上治疗宫颈癌的化疗药物对患者具有一定的选择性,且长期使用会出现耐药性等副作用,而现有的临床联合给药方案也仅对部分患者有效。因此,寻找并开发出新的治疗药物和联合给药的方案是我们需要进行的研究工作。在本研究中,我们利用化学基因组学筛选策略,对CA与临床上常用的治疗宫颈癌药TAX、Pt、5-FU在Siha细胞中进行协同效果的检测。结果证实,CA联合上述化疗药物均能在一定浓度下呈现协同效果,且联合用药组的作用效果优于单独用药组,差异有统计学意义。据文献报道,在抗肿瘤过程中,上述化疗药物均可引起DNA损伤,并阻滞细胞周期;其中,TAX可阻滞G2M期[25];Pt可阻滞G2M期[26];5-FU可阻滞G0/G1期[27]。根据本文研究结果,提示CA可能与上述化疗药物通过共同阻滞细胞周期,发挥协同增效的作用,进而诱导细胞凋亡,增强其抗宫颈癌效果。
综上所述,本研究证实CA通过线粒体途径诱导Siha细胞凋亡,并通过蛋白酶体途径下调HPV E6/E7蛋白的表达;同时与多种宫颈癌常用化疗药物均能在细胞水平上呈现协同效果。以上研究为更好地治疗宫颈癌提供了新的研究思路,同时也提出了新的联合给药方案,为减轻患者在抗宫颈癌治疗中的耐药性,提高对患者的有效率,提供了理论依据。

