降香化学成分研究
焦莹莹,梅文莉,戴好富,陈惠琴,袁靖喆,曲有乐,王 昊*
1佳木斯大学药学院,佳木斯154007;2中国热带农业科学院热带生物技术研究所海南省黎药资源天然产物研究与利用重点实验室,海口571101;3海南热带农业资源研究院 海南省热带农业生物资源保护与利用重点实验室,海口571101
降香是豆科(Leguminosae)植物降香黄檀(DalbergiaodoriferaT.Chen)的树干和根的干燥心材[1]。降香黄檀又名黄花梨,主要分布于海南岛西部及西南部平原或丘陵地区[2]。降香性温味辛,归肝、脾经,具有活血化瘀、止血止痛的功效,主要与丹参配伍治疗冠心病、心绞痛等心脑血管疾病,临床上较常见的如复方丹参注射液和冠心丹参片等[3]。降香中有效化学成分是二氢黄酮、异黄酮、二氢异黄酮、异黄烷、紫檀素、查尔酮等黄酮类化合物和主要由橙花叔醇等倍半萜类化物组成的挥发油[4]。药理作用研究表明,降香中黄酮类化合物具有抗炎、抗氧化、抗肿瘤和抑菌等活性,挥发油类成分具有抗血栓、促进血管新生、改善心肌功能等作用。此外,降香还具有乙酰胆碱酯酶抑制活性、神经保护等生物活性[3,5-9]。
α-葡萄糖苷酶是引起高血糖的关键酶,其抑制剂能起到降血糖作用[10]。现代研究表明,黄酮类化合物不仅具有抗炎、抗菌等生物活性,也是潜在的α-葡萄糖苷酶抑制剂,备受研究人员的关注[11,12]。降香含有大量的黄酮和倍半萜类化合物,而降香化学成分的α-葡萄糖苷酶抑制活性的研究比较薄弱。为了进一步挖掘降香中具有α-葡萄糖苷酶抑制活性的化学成分,丰富降香的物质基础,本研究采用各种色谱技术对降香乙醇提取物的乙酸乙酯部分进行分离纯化,并采用pNPG法测定化合物对α-葡萄糖苷酶的抑制活性。
1 材料与方法
1.1 仪器与试剂
Bruker AV-500型超导核磁仪(德国Bruker公司);Autospec 300质谱仪(英国VG公司);UV-2550紫外光谱仪(日本Shimadzu公司);Nicolet 380红外光谱仪(美国Thermo公司);MOS-500圆二色光谱仪(法国Biologic公司);MCP 5100旋光仪(奥地利Anton Paar公司);安捷伦1260分析型高效液相色谱仪、安捷伦1260半制备型高效液相色谱仪(美国安捷伦科技有限公司);柱层析硅胶G(200~300目、60~80目)和薄层层析硅胶板(青岛海洋化工厂);Sephadex LH-20葡聚糖凝胶(德国Merck公司);氘代试剂(青岛腾龙微波科技有限公司);常用有机试剂为国产AR级试剂(天津市康科德科技有限公司);色谱纯甲醇(天津市科密欧有限公司);酶标仪(美国宝特公司);α-葡萄糖苷酶、阿卡波糖、对硝基苯基-α-D-吡喃葡萄糖苷(PNPG)(美国Sigma Chemical公司);二甲基亚砜(天津富宇精细化工有限公司);磷酸氢二钠、磷酸二氢钠(西陇科学股份有限公司)。
1.2 材料
降香样品于2018年9月购买自海南省海口市,经中国热带农业科学院热带生物技术研究所王军副研究员鉴定其基原植物为降香黄檀DalbergiaodoriferaT.Chen,凭证标本(No.201816)存放于中国热带农业科学院热带生物技术研究所。
1.3 提取与分离
降香(21.0 kg)用95%乙醇室温浸提(3×100 L,每次7天),减压浓缩后得到乙醇萃取物(1 952.0 g),将萃取物分散于水中成悬浊液,然后依次用石油醚、二氯甲烷、乙酸乙酯和正丁醇萃取,得到石油醚萃取物、二氯甲烷萃取物、乙酸乙酯萃取物和正丁醇萃取物。乙酸乙酯萃取物(1 006.8 g)采用硅胶柱色谱进行分离(石油醚-乙酸乙酯20∶1→0∶1),经薄层层析分析后,合并得到10个流分(Fr.1~Fr.10)。Fr.3(5.6 g)经硅胶柱色谱(石油醚-乙酸乙酯300∶1→3∶1)分离得到6个流分(Fr.3-1~Fr.3-6)。Fr.3-5(251.4 mg)经Sephadex LH-20(甲醇)分离得到8个流分(Fr.3-5-1~Fr.3-5-8)。Fr.3-5-1(101.4 mg)经硅胶柱色谱(石油醚-丙酮16∶1→3∶1)得到化合物8(2.0 mg)、9(8.4 mg)和10(17.4 mg)。Fr.6(127.0 g)经减压柱色谱(石油醚-丙酮8∶1→0∶1)分离,得到15个流分(Fr.6-1~Fr.6-15)。Fr.6-9(3.3 g)经Sephadex LH-20(氯仿-甲醇1∶1),分离得到7个流分(Fr.6-9-1~Fr.6-9-7),将Fr.6-9-2(793.6 mg)经硅胶柱色谱(石油醚-乙酸乙酯10∶1→0∶1)分离得到化合物1(9.9 mg)和2(8.1 mg)。将Fr.6-9-6(359.7 mg)经硅胶柱色谱(氯仿-甲醇300∶1→1∶1)和Sephadex LH-20(氯仿-甲醇1∶1)得到化合物3(5.5 mg)。Fr.6-10(3.7 g)经Sephadex LH-20(氯仿-甲醇1∶1),得到流分Fr.6-10-1~Fr.6-10-10,将Fr.6-10-7(776.3 mg)经硅胶柱色谱(氯仿-甲醇200∶1→1∶1)和Sephadex LH-20(氯仿-甲醇1∶1)分离得到化合物4(2.2 mg)和5(1.6 mg)。将Fr.6-10-8(14.5 mg)经半制备高效液相色谱(C18柱,甲醇-水,60∶40),分离得到化合物7(3.6 mg,tR= 41 min)。Fr.6-10-9(131.7 mg)经硅胶柱色谱(氯仿-甲醇200∶1→1∶1)和Sephadex LH-20(氯仿-甲醇1∶1)得到化合物6(35.8 mg)。
1.4 α-葡萄糖苷酶抑制活性测试
采用pNPG[13]法对化合物1~10进行α-葡萄糖苷酶抑制活性筛选,将10 μL用DMSO溶解的待测化合物(10.0 mmol/L)与100 μL磷酸缓冲液(pH 6.8)溶解的α-葡萄糖苷酶溶液(2 U/mL)混合后加入96孔板中,实验重复3组,37 ℃下温育15 min后每孔加入40 μL PNPG(2.5 mmol/L),继续温育15 min后用酶标仪(405 nm)检测吸光度。阴性和空白对照为DMSO,阳性对照为阿卡波糖,根据以下公式计算抑制率。根据初筛时抑制率将化合物1浓度配制为500、400、300、200、100 μmol/L,其他化合物浓度配制为200、100、50、25、12.5 μmol/L,分别测试抑制率,取3次测定结果的平均值,用GraphPad Prism软件计算IC50值。
2 结果
2.1 结构鉴定
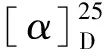
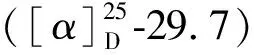
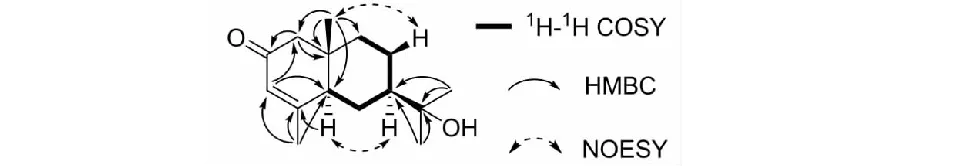
图1 化合物1的关键2D NMR相关信号Fig.1 Key 2D NMR correlations of compound 1
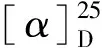
化合物3白色无定形粉末;ESI-MS:m/z299 [M + H]+。1H NMR(500 MHz,CDCl3)δ:8.26(1H,d,J= 8.9 Hz,H-5),8.05(1H,s,H-2),7.09(1H,d,J= 8.5 Hz,H-6′),7.07(1H,dd,J= 8.9,2.4 Hz,H-6),6.92(1H,d,J= 2.4 Hz,H-8),6.65(1H,d,J= 2.5,H-3′),6.54(1H,dd,J= 8.5,2.5 Hz,H-5′),3.95(1H,s,7-OCH3),3.82(1H,s,4′-OCH3);13C NMR(125 MHz,CDCl3)δ:154.7(C-2),125.0(C-3),178.9(C-4),128.0(C-5),115.8(C-6),164.9(C-7),104.5(C-8),158.0(C-9),117.2(C-10),113.0(C-1′),158.0(C-2′),99.9(C-3′),162.1(C-4′),107.8(C-5′),130.3(C-6′),55.3(7-OCH3),55.9(4′-OCH3)。以上数据与文献[18]报道一致,故鉴定为4,7-二甲氧基-2′-羟基异黄酮。
化合物4白色无定形粉末;ESI-MS:m/z283 [M + H]+。1H NMR(500 MHz,CDCl3)δ:8.21(1H,d,J= 8.9 Hz,H-5),7.92(1H,s,H-2),7.50(2H,d,J= 8.5 Hz,H-2′,6′),6.99(1H,dd,J= 8.9,2.3 Hz,H-6),6.97(2H,d,J= 8.5 Hz,H-3′,5′),6.85(1H,d,J= 2.3 Hz,H-8),3.91(1H,s,7-OCH3),3.84(1H,s,4′-OCH3);13C NMR(125 MHz,CDCl3)δ:152.1(C-2),124.8(C-3),175.9(C-4),127.6(C-5),114.5(C-6),163.8(C-7),100.1(C-8),157.9(C-9),118.4(C-10),124.2(C-1′),130.1(C-2′,6′),113.9(C-3′,5′),159.5(C-4′),56.6(7-OCH3),55.8(4′-OCH3)。以上数据与文献[19]报道一致,故鉴定为7,4′-二甲氧基异黄酮。
化合物5白色无定形粉末;ESI-MS:m/z286 [M + H]+。1H NMR(500 MHz,CD3OD)δ:8.17(1H,s,H-2),8.11(1H,d,J= 8.6 Hz,H-5),7.14(1H,d,J= 8.1 Hz,H-6′),7.08(1H,dd,J= 8.6,2.0 Hz,H-6),7.06(1H,d,J= 2.0 Hz,H-8),6.50(1H,d,J= 2.4 Hz,H-3′),6.48(1H,dd,J= 8.1,2.4 Hz,H-5′),3.93(1H,s,7-OCH3),3.77(1H,s,2′-OCH3);13C NMR(125 MHz,CD3OD)δ:156.8(C-2),124.1(C-3),178.8(C-4),128.2(C-5),116.4(C-6),116.2(C-7),103.2(C-8),162.7(C-9),113.0(C-10),118.8(C-1′),158.0(C-2′),106.6(C-3′),159.8(C-4′),101.2(C-5′),133.0(C-6′),56.6(7-OCH3),55.7(2′-OCH3)。以上数据与文献[20]报道一致,故鉴定为3-(4-羟基-2-甲氧基苯基)-7-甲氧基-4H-色烯-4-酮。
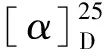
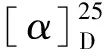
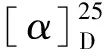
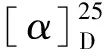
化合物10白色无定形粉末;ESI-MS:m/z297 [M + H]+。1H NMR(500 MHz,CDCl3)δ:7.92(1H,d,J= 8.6 Hz,H-1),7.84(1H,m,H-7),7.14(1H,d,J= 2.2 Hz,H-4),7.02(1H,dd,J= 8.6,2.2 Hz,H-2),6.96(1H,br s,H-10),6.95(1H,m,H-8),3.89(6H,s,3-OCH3,9-OCH3);13C NMR(125 MHz,CDCl3)δ:121.7(C-1),113.1(C-2),162.7(C-3),101.6(C-4),155.2(C-4a),159.4(C-6),103.6(C-6a),116.8(C-6b),122.6(C-7),113.3(C-8),160.2(C-9),97.0(C-10),156.6(C-10a),158.6(C-11a),106.3(C-11b),56.0(3-OCH3),55.9(9-OCH3)。以上数据与文献[25]报道一致,故鉴定为3,9-二甲基-6H-苯并呋喃[3,2-c]色烯-6-酮。
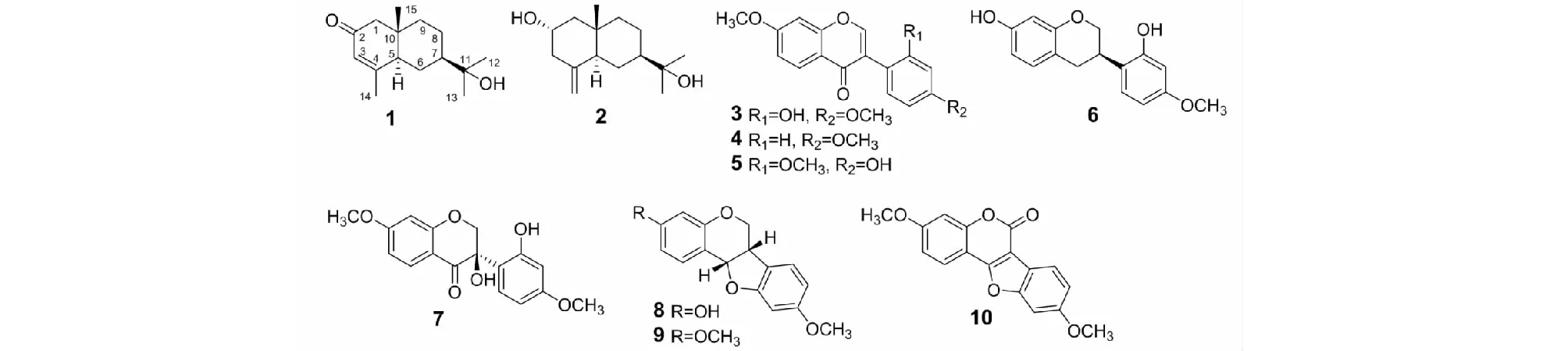
图2 降香中化合物1~10的结构Fig.2 The chemical structures of compounds 1-10 from Dalbergiae Odoriferae Lignum
2.2 α-葡萄糖苷酶抑制活性
采用pNPG法测试了化合物1~10的α-葡萄糖苷酶抑制活性。结果显示,化合物1、6、8、9具有一定的α-葡萄糖苷酶抑制活性,其IC50值分别为366.77 ± 1.46、113.11 ± 0.87、56.21 ± 1.01和92.63 ± 0.91 μmol/L,优于阳性对照阿卡波糖(IC50= 582.00 ± 2.60 μmol/L),化合物2~5、7和10在200 μmol/L浓度下的抑制率低于50%。构效关系分析表明,化合物1中α,β-不饱和酮增强α-葡萄糖苷酶抑制活性,活性优于化合物2,而化合物10中α,β-不饱和酮降低α-葡萄糖苷酶抑制活性,明显弱于化合物8和9的活性。
3 结论
从降香中分离得到10个化合物,包括2个倍半萜类化合物(1、2)和8个黄酮类化合物(3~10)。其中,化合物1为桉烷型倍半萜,具有一定的α-葡萄糖苷酶抑制活性,为降香中首次报道具有该活性的化合物类型;化合物8和9为紫檀素类化合物,其α-葡萄糖苷酶抑制活性较为显著。据文献报道,化合物8对枯草芽孢杆菌、绿脓杆菌和金黄色葡萄球菌均具有一定的抑制作用[26],化合物8和9也表现出抑制人肝癌细胞增殖的作用[27],因此在后续工作中,应对此类化合物的作用机制进行深入的研究。本文为降香的药理研究提供了物质基础,也为降香的开发应用提供参考。

