罗布麻壳针孢生物学特性
冉阳露,蓝艳茹,王 莉,段廷玉
(1. 兰州大学草地农业生态系统国家重点实验室 / 兰州大学农业农村部草牧业创新重点实验室 / 兰州大学草地农业科技学院,甘肃 兰州 730020;2. 新疆阿勒泰戈宝茶股份有限公司, 新疆 阿勒泰 836500)
罗布麻(Apocynum venetum)又称野麻、野茶、红麻、红花草、茶叶棵子等[1],主要分白麻和红麻两种,为夹竹桃科(Apocynaceae)直立半灌木或多年生宿根草本植物[2]。中国是世界上罗布麻分布面积最大的国家[3],3 个主要分布区为西北内陆的白麻和红麻干旱分布区、北部的红麻半干旱分布区、沿海及内地的红麻半湿润及湿润分布区[4],在新疆、吉林、青海、河南、山西等十几个省(市、自治区)广泛分布,其中数新疆维吾尔自治区罗布麻的分布面积最广[5-6]。罗布麻具有特殊的组织和器官,如,薄叶片下表皮分布的气孔器形成孔下室,根、茎的皮层内含有深色贮藏物质,茎环绕内生韧皮部,根系粗壮,木质部发达等,使得罗布麻的生存能力极强,多生长于寒冷、干旱、盐碱的荒漠地区,具有耐盐碱、耐干旱、耐高温、耐霜冻、耐风沙侵蚀等特点,成为保持水土、涵养水源、改良土壤、调节气候、防风固沙的荒漠植物之一,同时在制药、制茶和纺织等方面也充当着重要角色,具有一定的经济价值和生态效益[7-11]。
罗布麻壳针孢(Septoria apocyni)引致的斑枯病是阿勒泰地区罗布麻的主要真菌病害之一,兰州大学团队研究发现该病在新疆阿勒泰栽培和野生罗布麻上发生普遍,引起叶片病斑,枯黄萎蔫,寄主早衰,病叶率、病株率最高可在50%以上,严重影响罗布麻的产量与品质[12]。
近年来,随着中医药、保健行业的发展,我国栽培罗布麻面积不断扩大,加之环境因素的影响以及国内外防控技术的缺乏,导致该病害发病严重,蔓延加快,成为限制罗布麻产业的重要因素。国内外关于该病害的研究仅限于病原鉴定和寄主范围测定,缺乏对病原生物学特性的研究。生物学特性是病原真菌特性的重要内容,通过研究罗布麻壳针孢菌的生物学特性有利于深入了解该病原真菌侵染条件和侵染机制,在病害防控过程中制定出合理的防控策略。因此,本研究目的在于明确不同培养基、酸碱度、温度、光照对菌落生长的影响,筛选罗布麻壳针孢菌的最佳培养条件,为深入研究该病原菌及病害提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1供试植物
供试宿主植物为甘肃榆中县和新疆阿勒泰种植的罗布麻,种子均由新疆阿勒泰戈宝麻公司提供。
1.1.2供试菌株
供试菌株罗布麻壳针孢(Septoria apocyni)为新疆阿勒泰地区和甘肃榆中县种植罗布麻田病样分离纯化所得。病样采集自甘肃榆中县和新疆阿勒泰罗布麻田,用实验室常规的病害病原分离方法,将典型有害状的样叶用无菌水冲洗干净,75%酒精浸泡40 s,5% 次氯酸钠浸泡1 min,无菌水清洗3 次,然后用灭菌滤纸进行干燥,干燥完成后,用镊子将其置于新的灭菌滤纸上,灭菌镊子固定,用切刀切取样叶病健交界处约2 mm × 2 mm 大小的组织,接种于马铃薯葡萄糖琼脂(PDA)培养基上,每个PDA培养基中放5 个大小约2 mm × 2 mm 的组织,于黑暗条件下25 ℃培养箱中进行培养,每叶片3 个重复,选择仅有罗布麻壳针孢菌落生长的平板,在菌丝体形成后,用接种针挑取菌丝置于新的PDA 培养基平板上进行分离纯化,随后于25 ℃培养箱中进行黑暗培养[13-14]。
1.1.3供试培养基
通过研究白术(Atractylodes macrocephala)、白芷(Angelica dahurica)、大黄(Rheum palmatum)、党参(Codonopsis pilosula)等分离出的壳针孢属真菌在不同培养基平板上的生长情况和试验结果[15-25],本研究最终选定7 种培养基平板进行试验,分别为PDA培养基[26]、马铃薯蔗糖琼脂(potato sucrose agar, PSA)培养基[27]、10%罗布麻汁液 + PDA 培养基[28]、20%罗布麻汁液 + 琼脂培养基[28]、理查德(Richard)培养基[29]、胁本哲氏培养基[15]、V-8 培养基[30]。
1.2 试验方法
将甘肃榆中县和新疆阿勒泰分离纯化的两个罗布麻壳针孢菌株(分别简写为GS 和XJ) 在PDA 培养基上25 ℃黑暗条件下培养2 月,在生长2 月的菌落边缘用直径5 mm 的打孔器打出菌饼,接种至直径9 cm 的培养皿中,每皿1 个菌饼[31]。
d(菌落净生长直径) =d1(菌落总直径) -d2(菌饼直径),比较各种处理间菌落净增长直径。
v(菌落生长速率) =d(20 d 时的菌落净生长直径) /t(培养时间),比较各处理间菌落生长速率与生长特征。
1.2.1 不同培养基对菌落生长的影响
将GS、XJ 两个菌株的菌饼分别接种于供试培养基平板上,共7 个处理,每处理4 个重复,25 ℃条件下黑暗培养20 d,每隔4 d 用十字交叉法测定一次菌落直径,记录菌落特征。
1.2.2 黑暗条件下温度对菌落生长的影响
将GS、XJ 菌饼接种于PDA 和10%罗布麻汁液 +PDA 培养基平板上,分别置于5、10、15、20、25、30和35 ℃条件下黑暗培养20 d,共7 个温度梯度,每处理4 个重复,其他操作同1.2.1。
1.2.3 光照条件对菌落生长的影响
将GS、XJ 菌饼接种于PDA 和10%罗布麻汁液 +PDA 培养基平板上,分别置于24 h 连续光照、24 h 连续黑暗、12 h 光照12 h 黑暗,共3 个处理,每处理4 个重复,25 ℃条件下连续培养20 d,其他操作同1.2.1。
1.2.4 pH 对菌落生长的影响
用1 mol·L-1NaOH和1 mol·L-1HCl将PDA和10%罗布麻汁液 + PDA 培养基pH 调成4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0、9.5、10.0,共13 个处理,将GS、XJ 菌饼接种于不同pH 的PDA 和10%罗布麻汁液 + PDA 培养基平板上,每处理4 个重复,25 ℃条件下黑暗培养20 d,其他操作同1.2.1。
1.3 数据分析
试验按照不同培养条件处理,用Excel 2021 进行数据汇总整理及表格制作,用JMP IN 4 软件进行培养基和真菌种类间交互效应分析,用SPASS 20.0进行单因素方差分析,应用最小显著差异法(LSD)对平均数进行比较(P< 0.05)。
2 结果与分析
2.1 不同培养基对菌落生长的影响
GS 和XJ 两个罗布麻壳针孢菌株在供试的7 种培养基上均可以生长(表1、图1),但未产孢。GS 的生长速率为0.76~1.57 mm·d-1,在PDA、20% 罗布麻汁液 + 琼脂培养基上的生长速率显著高于除V-8外的其余培养基 (P< 0.05),在Richard 培养基上的生长速率最低(表1)。XJ 的生长速率为0.52~1.40 mm·d-1,在10%罗布麻汁液 + PDA 培养基上的生长速率显著高于胁本哲氏和Richard 培养基,在Richard培养基上的生长速率依旧最低。总体上,GS 和XJ在供试的7 种培养基平板上菌落直径均存在显著差异(P< 0.000 1) (表2)。GS 在PDA 培养基平板上生长的最好,XJ 的最适培养基为10% 罗布麻汁液 +PDA,且GS 的生长速率高于新疆阿勒泰地区(表1)。同种培养基平板上两个菌株菌落直径也存在显著差异(P= 0.000 2) (表2)。其中,Richard培养基上两个菌株均生长最慢,但在此培养基上GS 菌株的生长速率较新疆阿勒泰地区快46.15% (表1)。另外,培养基种类和两个菌株之间存在显著的交互效应(P= 0.001 6) (表2),且不同培养基平板上GS 和XJ壳针孢菌落大小、颜色和形状、气生菌丝和内生菌丝的生长均有所差异(表1、图1)。
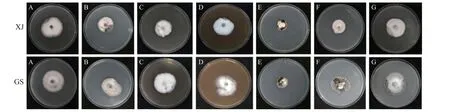
图1 20 d 时不同培养基处理下菌落特征Figure 1 Morphological characteristics of colonies under different medium treatments at 20 days
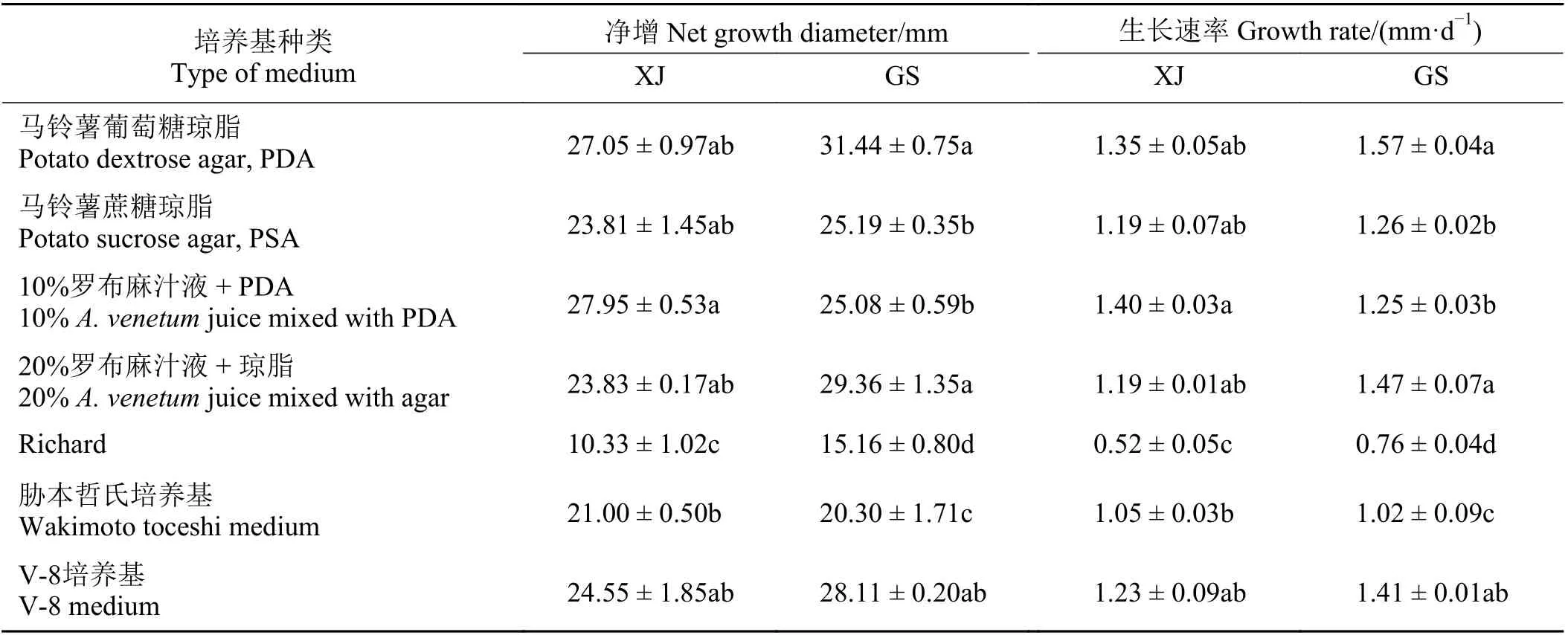
表1 罗布麻壳针孢在7 种培养基上的生长情况Table 1 Growth of Septoria apocyni on Apocynum venetum on seven types of culture media in Xinjiang Altay and Gansu Yuzhong

表2 培养基类型和不同地点菌株之间的交互效应Table 2 Interaction effects between medium types and strains at different sites
在PDA 和PSA 培养基上XJ 和GS 的菌落特征相似,气生菌丝较多,白色绒毛状、絮状,圆形凸起,基生菌丝呈黑色或青绿色,毡状,可生长至培养基中,一段时间后培养基底部凹陷,裂开(图1 A),不同的是PSA 培养基上的气生菌丝较PDA 上的少(图1 B);在10%罗布麻汁液 + PDA 培养基上XJ 和GS 的气生菌丝为白色绒毛状凸起,边缘不规则隆起,坚硬,基生菌丝呈黑色或红褐色,毡状,一段时间后培养基底部凹陷,裂开,不同的是XJ 的气生菌丝较GS 多(图1 C);在20% 罗布麻汁液 + 琼脂培养基上XJ 的气生菌丝白色绒毛状、絮状,圆形隆起,基生菌丝白色或浅褐色,少量黑色,可生长至培养基中,培养基底部无凹陷和裂痕(图1 D),GS 的气生菌丝生长稀疏分散,边缘不齐,基生菌丝黑色或褐色,可生长至培养基中,其他同10%罗布麻汁液 + PDA 培养基(图1 D);在Richard培养基上XJ 和GS 菌落生长极其缓慢,黑色,隆起,坚硬,气生菌丝极少;基生菌丝黑色,中心少量红褐色,培养基底部凹陷,裂开(图1 E);在胁本哲氏培养基上XJ 的气生菌丝呈白色绒毛状,极规则圆形凸起,边缘极规则圆形;基生菌丝白色、青绿色,培养基底部无裂痕(图1 F),GS 菌落生长较Richard 平板快,底部裂痕小,其他同Richard(图1 F);在V-8 培养基上XJ 的气生菌丝较多,白色绒毛状,圆形凸起;基生菌丝白色、青绿色、少量黑色,放射状,培养基底部无裂痕(图1 G),GS 的气生菌丝较少,白色绒毛状,圆形凸起,基生菌丝青绿色、黑色,放射状(图1 G)。
2.2 黑暗条件下温度对菌落生长的影响
在供试的两种培养基上,XJ 与GS 适宜生长的温度范围较广,于10~30 ℃范围内均能生长,最适温度为25 ℃ (表3)。5~25 ℃时,该病原菌的生长量随温度的升高而升高,25~35 ℃时随温度的升高呈下降趋势,25 ℃生长的最好,高于30 ℃时,不生长。25 ℃黑暗条件下,在PDA 培养基上,GS 的生长量总体上较XJ 的好,4 d 生长约3.45 mm,8 d 时菌落直径增加约9.58 mm,20 d 后菌落净增长直径达31.43 mm,较XJ 增加1.25 mm;在10%罗布麻汁液 + PDA 培养基上,XJ 的生长量则较GS 更好,4 d 生长约0.70 mm,8 d 时菌落直径增加约7.30 mm,20 d 后菌落净增长直径达29.54 mm,较GS 增加3.44 mm。上述结果表明,5 和35 ℃均能抑制该菌的正常生长发育;15、20、25 和30 ℃温度处理下,XJ 与GS 于不同培养基上黑暗培养20 d 时菌落生长存在差异 。
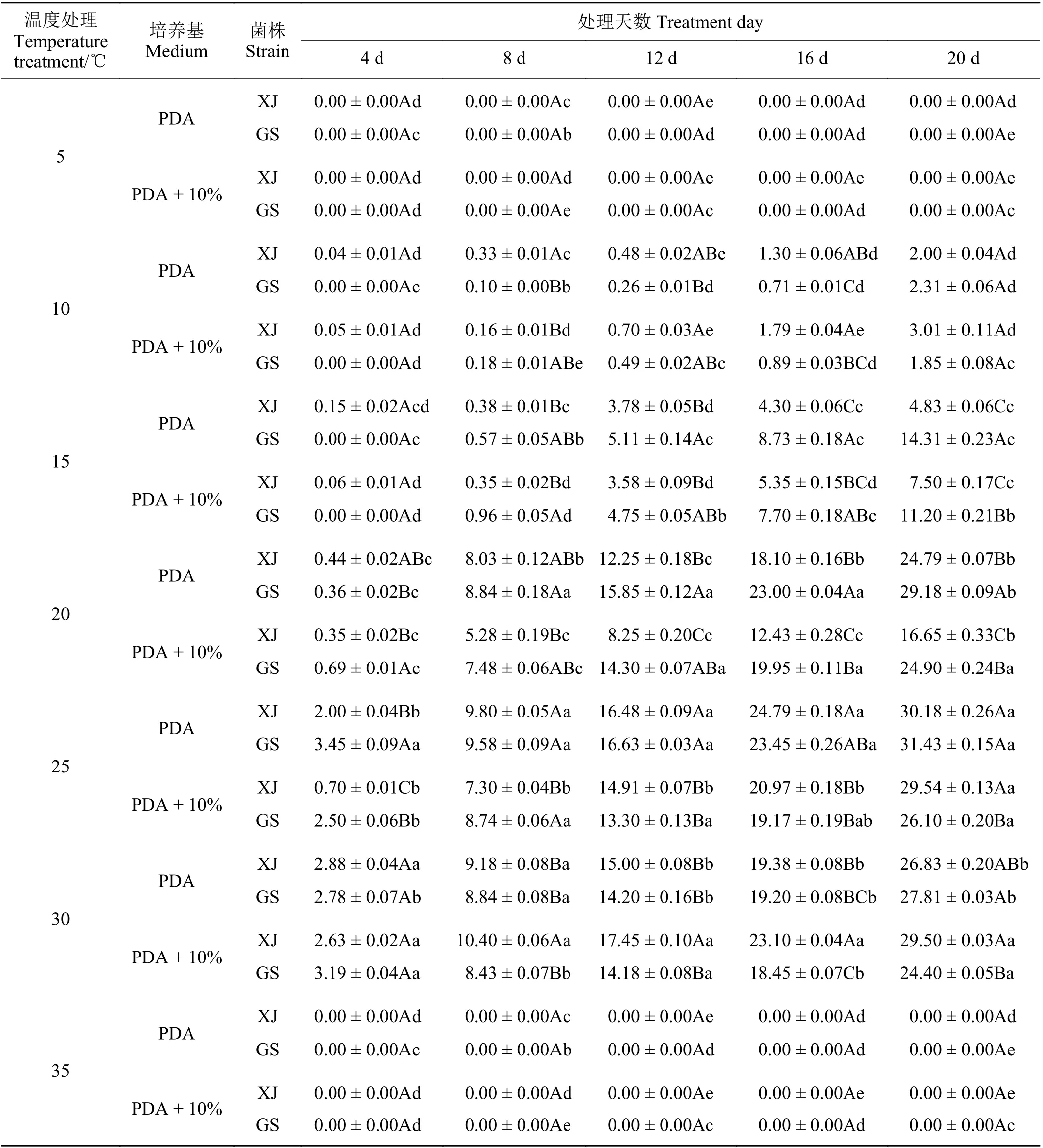
表3 温度对罗布麻壳针孢菌落净增长直径的影响Table 3 Effect of temperature on net growth diameter of colony of Septoria apocyni mm·d-1
2.3 光照条件对菌落生长的影响
在供试的两种培养基上,XJ 和GS 均在光暗交替条件下菌丝生长较好。于PDA 培养基上,20 d 时菌落净增长直径分别可以达到30.56 和26.28 mm;于10%罗布麻汁液 + PDA 培养基上,分别可达28.90和27.90 mm。PDA 培养基上,XJ 于连续黑暗和光暗交替条件下,20 d 时菌落净增长直径均显著大于持续光照(P< 0.05),其他未表现出明显差异;光暗交替条件下,PDA 培养20 d 后XJ 菌落净增长直径均显著高于GS (P< 0.05),与10%罗布麻汁液 + PDA培养基平板上的则无明显差异(P> 0.05)。由此可见,XJ 与GS 于3 类光照处理下,适宜生长的光照条件相同;总体上,20 d 时不同菌于不同培养基上菌落净增长无明显差异(P> 0.05) (表4)。
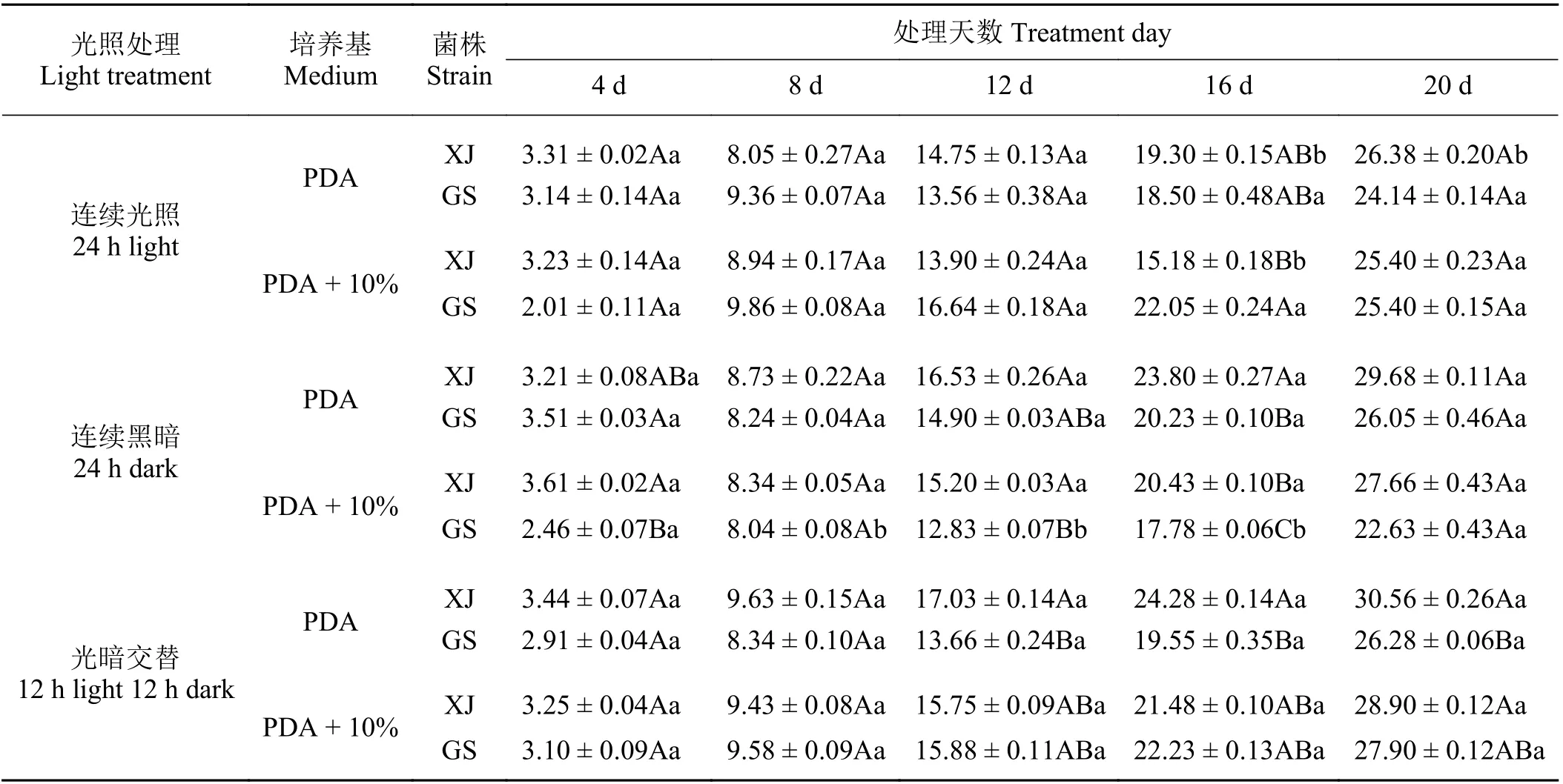
表4 光照对罗布麻壳针孢菌落净增长直径的影响Table 4 Effect of light on net growth diameter of colony of Septoria apocyni mm·d-1
2.4 pH 对菌落生长的影响
如 表5 所列,在供试的两种培养基上,XJ 与GS 生长的pH 范围较宽,pH 于4~10 内均能生长。总体上,随着pH 的增加,XJ 与GS 在两种培养基上的净增长直径总体上呈先上升后下降的趋势。在PDA 和10% 罗 布 麻 汁 液 + PDA 培 养 基 上,XJ 在pH 为5.5 时菌落生长的最好,GS 则在pH 为5 时生长的最好。pH 为5.5,25 ℃黑暗培养20 d 时,XJ 菌落净增长直径在两种培养基上可达30.00 和29.07 mm;pH 为5,25 ℃黑暗培养20 d 时,GS 菌落净增长直径可达33.60 和34.88 mm,同比16 d,分别增加6.82、9.62、10.73 和10.43 mm。结果表明,pH 过高过低均能限制该菌的正常生长发育,黑暗培养20 d时,pH 分别为4、4.5、5、5.5、6、6.5、9、9.5、10 时,两种菌于两种培养基上菌落生长存在显著差异(P<0.05),pH 分 别 为4 和9.5 时,PDA 上 培 养20 d 的XJ 菌落净增长直径显著低于PDA 上的GS 和10%罗布麻汁液 + PDA 上的XJ 与GS,pH 分别为4.5 和5 时,PDA 上的XJ 菌落净增长直径显著低于GS,且10%罗布麻汁液 + PDA 上的XJ 菌落净增长直径也显著低于GS,pH 分别为7、7.5、8、8.5 时,两种菌于两种培养基上菌落净增长直径则无明显差异(P> 0.05)。
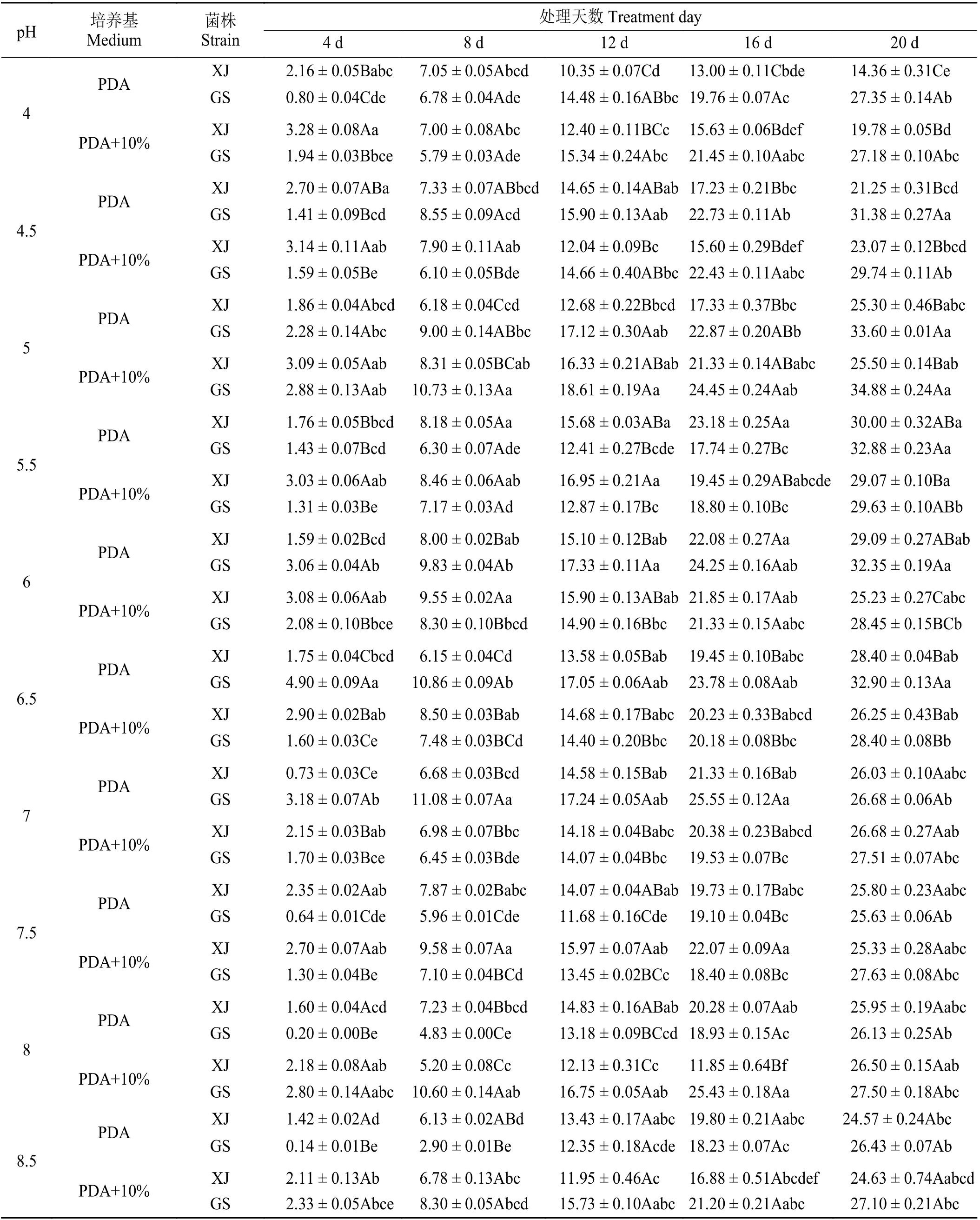
表5 pH 对罗布麻壳针孢菌落净增长直径的影响Table 5 Effect of pH on net growth diameter of colony of Septoria apocyni mm·d-1
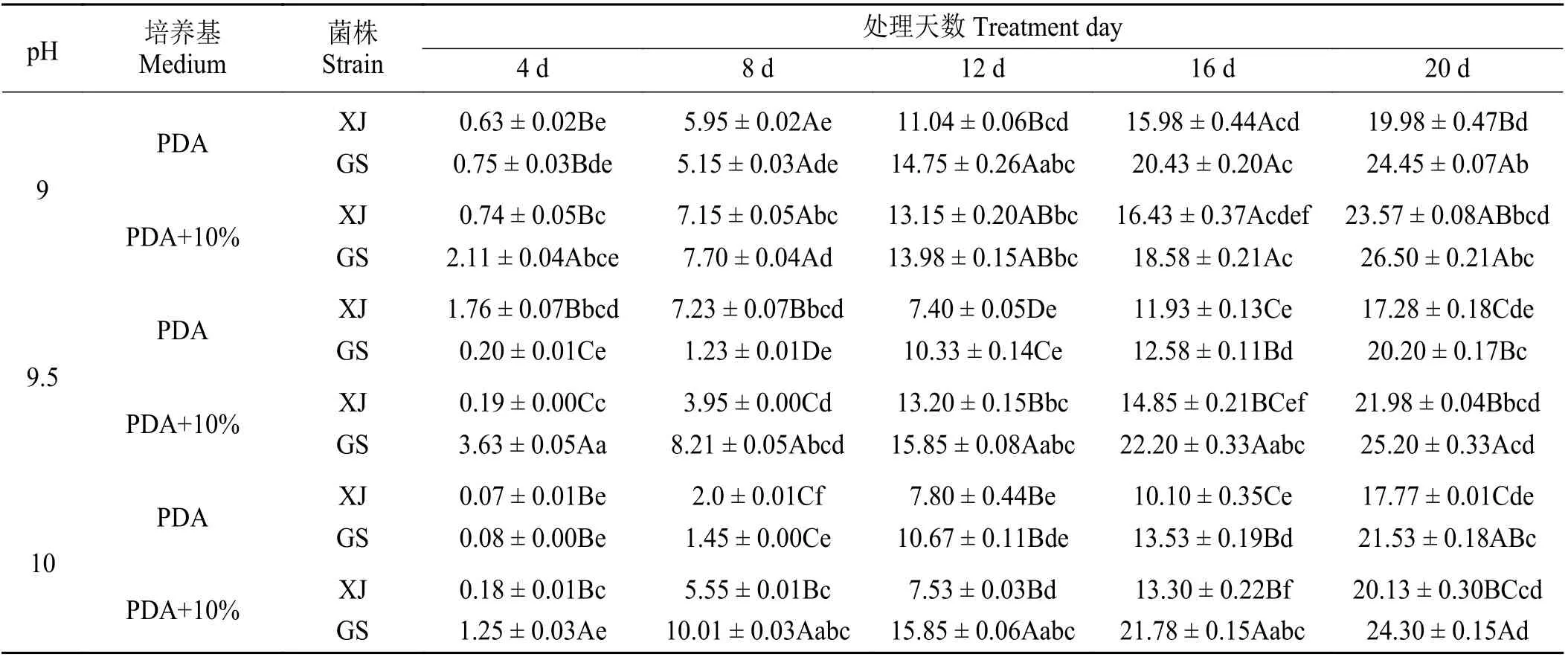
续表5Table 5 (Continued)
3 讨论与结论
壳针孢属真菌可以侵染30 多种药用植物,引起12 科24 种真菌病害[32],此外,还侵染小麦(Triticum aestivum)[33]、大麦(Hordeum vulgare)[34]、大豆(Glycine max)[16]等多种粮食作物,对寄主产量和品质造成严重影响。其引致罗布麻斑枯病的报道可追溯到1933 年,Lantzova 和Tcheenyak[35]在俄罗斯地区的大麻状罗布麻(A. cannabinum)和伸展型罗布麻(A.androsaemifolium)上发现了壳针孢菌,同年,在中亚地区的西伯利亚罗布麻(A. sibiricum)上也进行了报道,而后2014 年兰州大学团队报道了罗布麻壳针孢叶斑病新病害,对其发病症状、病原种类、致病性及寄主范围等进行了相关调查、鉴定与报道[36],但缺乏对病原生物学特性的研究。
本研究首次较系统地研究了引致罗布麻斑枯病的病原真菌罗布麻壳针孢(Septoria apocyni)菌丝生长所需的培养条件,明确了不同培养基、温度、光照、pH 处理对该菌菌丝生长的影响。与白术斑枯病菌(Septoria atractylodis)、白芷斑枯病菌(Septoria dearnessii)、大黄斑枯病菌(Septoria palmati)等球壳孢属真菌相似[23-25],罗布麻壳针孢菌生长极其缓慢,培养基中加入寄主汁液能够促进菌落生长。两个罗布麻壳针孢菌株的最适生长温度均为25 ℃,说明该菌为中温真菌,低于5 ℃或高于30 ℃菌落均不生长;最适生长pH 为5~5.5,说明该菌偏爱弱酸性环境,pH 过高过低也会抑制该菌的正常生长发育。不同光照处理中,光暗交替最适宜该菌的生长。在7 种培养基处理下,两个罗布麻壳针孢菌株均未产孢,但两个菌株于不同培养基上的生长情况存在差异,甘肃榆中县罗布麻壳针孢菌在PDA 培养基上生长的较好,新疆阿勒泰罗布麻壳针孢菌则在10%罗布麻汁液 + PDA 培养基上生长的较好。培养20 d 时,PDA与PSA 两种培养基上的壳针孢菌落特征相似,可能是由于蔗糖中一半为葡糖糖,葡糖糖提供的碳源与蔗糖提供的碳源相似,导致该菌对两种碳源的利用率更接近,因而PDA 与PSA 的菌落特征相似,其他培养基平板上菌落大小、形态颜色却存在差异[37]。
该菌适合在中温环境中生长,此结果与姚远等[22]报道的龙胆草斑枯病菌(Rough gentian)、郑艳等[24]报道的白芷斑枯病菌生物学特性的研究结果一致。温度过高过低均抑制生长,源于高温破坏了生物膜结构和蛋白质空间结构,例如:氢键、离子键、疏水力和范德华力等非共价键会随着温度的升高被破坏,进而使蛋白质永久变性,酶失活,高温对病原真菌的抑制性是致死的、不可逆的;而低温仅是抑制了菌落生长速度,降低了相关酶的代谢活性,是暂时的、可恢复的[38-39]。菌落适宜生长的pH 范围与靳学慧等[16]的大豆壳针孢菌(Septoria glycines)、王艳等[19]的大黄壳针孢菌研究结果一致,pH 过高过低也会抑制菌落的生长,作用机理与温度相似。
光是地球上所有生命必不可少的一种环境信号,调节着生物体的正常生长发育,包括病原真菌的生存生长、新陈代谢和繁殖传播[40-42]。本研究表明,24 h 光照24 h 黑暗交替处理下,GS 与XJ 菌落生长得最好,但各光照处理间无显著差异(P> 0.05),这与威灵仙(Septoria clematidis-flammulae)[15]、大黄[19]、龙胆草(Septoria gentianae)[22]、玄参(Septoria scrophulariae)[28]、落羽杉斑枯病病菌(Pestalotiopsis maculans)[43]的研究结果一致,也有报道表明蝴蝶花斑枯病病菌(Fusarium oxysporum)在连续黑暗条件下生长得最好[17],可能是不同寄主植物间存在差异。
罗布麻是一种稀有的野生植物,在制药、制茶、纺织以及生态环境建设等方面发挥着重要作用,由罗布麻壳针孢(Septoria apocyni)引致的斑枯病严重损害了罗布麻产业的发展。本文对该菌的生物学特性进行了较为全面的研究,表明罗布麻壳针孢喜中温、弱酸性和光暗交替的生长环境,GS 和XJ 的最适生长培养基分别为PDA 和10% 罗布麻汁液 +PDA。这为进一步研究罗布麻斑枯病提供了基础,但具体的提早预防与有效控制措施亟需进一步开展试验进行研究。

