基于分子对接技术研究鱼源抗冻多肽与鱼肌球蛋白的相互作用
江文婷,陈 旭,蔡茜茜,杨傅佳,黄 丹,黄建联, ,汪少芸,
(1.福州大学生物科学与工程学院,福建福州 350108;2.福建省冷冻调理水产品加工重点实验室,福建厦门 361022;3.福建安井食品集团股份有限公司,福建厦门 361022)
我国水域辽阔,生物资源丰富,是世界上渔业资源最丰富的国家。海鲈鱼营养丰富,养殖产量高,常用于加工生产鱼糜制品,深受消费者的喜爱,产量和市场需求逐年增加。鱼糜及鱼糜制品在加工、储存、运输等过程中产生的冰晶生长和重结晶问题会导致鱼糜蛋白质的冷冻变性,使其分子内部原有的高度规律性的空间结构发生变化,导致蛋白质的理化性质和生物学性质都有所改变,是影响冻藏品质的关键。其中,鱼糜蛋白中的肌球蛋白是凝胶形成最主要的功能成分,影响着肉制品的品质。肌球蛋白重链(Myosin Heavy Chain,MHC)具有与完整肌球蛋白形成凝胶的相同能力。而肌球蛋白轻链不能单独形成凝胶,只在肌球蛋白重链碱基凝胶形成中起辅助作用。因此,肌球蛋白重链在肌球蛋白形成凝胶三维网状结构的过程中起着非常重要的作用。
抗冻多肽是一类小分子蛋白或蛋白质水解物,它是抗冻蛋白中局部具有抗冻活性的特异多肽链结构域。抗冻多肽在结冰或亚结冰状态下能保护生物体免受伤害,它能非依数性降低溶液冰点、有效降低冰晶生长率、抑制冰晶重结晶的发生,抑制冻结所造成的低温损伤。实验室前期研究发现鱼源胶原蛋白制备的抗冻多肽,在低温冻融循环中对鱼糜表现出保护作用。为研究鱼源胶原蛋白抗冻多肽对鱼糜的保护机制,本文使用不同蛋白酶酶解鱼源胶原蛋白,以嗜热链球菌的低温保护活性为指标筛选出能酶解产生高活性抗冻多肽的蛋白酶。为简化分离纯化及质谱等繁锁步骤,通过计算机模拟酶解鱼源胶原蛋白并预测活性肽性质,得到能与肌球蛋白直接作用的抗冻多肽序列,利用同源建模构建海鲈鱼肌球蛋白重链的空间结构。通过分子模拟技术探究抗冻多肽与海鲈鱼肌球蛋白的相互作用,以期为今后冷冻鱼糜产品开发应用提供理论基础。
1 材料与方法
1.1 材料与仪器
鱼鳞胶原蛋白() 安井食品集团股份有限公司;嗜热链球菌() 上海交通大学农业与生物学院;风味蛋白酶、碱性蛋白酶、中性蛋白酶、木瓜蛋白酶、胰蛋白酶 上海源叶生物科技有限公司;其他试剂 均为分析纯;海鲈鱼肌球蛋白重链(GenBank Accession No:AGT60847.1) 美国国立生物技术信息中心NCBI(https://www.ncbi.nlm.nih.gov/);鱼源胶原蛋白O93484 蛋白质数据库UniProt(https://www.uniprot.org/)。
SW-CJ-1F 超净工作台 上海博迅公司;Genesys 10S 紫外可见分光光度计 美国Thermo Fisher Scientific 公司;214 差示扫描量热仪 德国Netzsch 公司;SMZ-745T 体视显微镜、D-7500CCD 高清相机日本Nikon 公司;RT4加热制冷循环器 德国VIVO 公司。
1.2 实验方法
1.2.1 鱼源胶原蛋白的酶解 犁齿鲷鱼鳞清洗、烘干后粉碎成絮状。底物浓度3%(w/v),超声90 min(50 ℃,200 W),高温处理1 h(121 ℃,0.1 MPa),冷却后调节至酶最佳pH,分别加入5%(w/w)酶底比的碱性蛋白酶、中性蛋白酶、胰蛋白酶、风味蛋白酶和木瓜蛋白酶,在酶最适温度下酶解6 h,沸水浴灭酶后离心取上清液冻干。
1.2.2 抗冻多肽的低温保护活性测定 取50 μL 二次活化的嗜热链球菌接种到4 mL M17 液体培养基中,培养4 h(37 ℃,180 r/min),5000 r/min 离心10 min,收集菌泥,用等体积的无菌水洗涤两次后重悬于两倍的无菌水中,获得嗜热链球菌菌液。分别从不同酶解液中取540 μL 加60 μL 菌液混匀,540 μL 生理盐水加60 μL 菌液做空白组。吸取50 μL 到4 mL M17培养液中,培养7 h,检测600 nm 处的吸光值A,剩余的菌液于-20 ℃冷冻24 h 且在起始时间内间隔2 h 进行两次冻融循环。之后将菌液37 ℃水浴解冻10 min,再次取50 μL 接种培养7 h 后测吸光值A。根据公式(1)计算存活率。

式中:A表示冷冻前菌液OD;A表示冷冻后菌液OD。
1.2.3 热滞活性测定 热滞活性测定参照Wu 等方法稍作变化。取5 μL 15 mg/mL 样品或牛血清蛋白到铝样品盘,参比组为空白铝样品盘,将二者同时置入差示扫描量热仪中,以-2 ℃/min 速率降温至-30 ℃,平衡5 min,再以2 ℃/min 速率升温至保留温度(-0.5、-0.3、0 ℃),使样品处于部分熔融状态,平衡5 min。根据DSC 热流曲线分析样品的抗冻活性。冰晶含量(Φ )和THA 分别按照公式(2)和(3)计算。

式中:Φ 为样品中的冰晶含量(%);△H为保留温度停留后继续降温过程中体系的放热焓(J/g);△H为样品结晶的总放热焓(J/g);T为保留温度(℃),即样品熔融峰所涵盖温度区间的某一温度;T体系融化部分再次冻结时的起始温度(℃)。
1.2.4 重结晶抑制活性测定 取3 μL AFPs(1.0 mg/mL,20%蔗糖溶液配制)于载玻片上,盖上盖玻片,置于冷台上。以-20 ℃/min 速率快速冷却至-20 ℃并维持5 min,使其完全冻结;再以5C/min 速率逐渐升温至-6 ℃,保持1 min;再以1 ℃/min 让样品在-8~-6 ℃之间循环,模拟温度波动环境下的重结晶情况。并在-6 ℃分别保持0、10、30 min,通过CCD 相机采集循环前后冰晶形态图像,通过OPLENIC软件分析冰晶尺寸变化。20%蔗糖溶液做空白组,BSA(1.0 mg/L,20%蔗糖溶液配制)做对照组。
1.2.5 计算机模拟酶解 在UniProt 数据库中搜索鱼源胶原蛋白,选取O93484 胶原蛋白序列,通过酶切工具Peptide Cutter(https://web.expasy.org/peptide_cutter/)选择胰蛋白酶进行模拟酶解。
1.2.6 活性肽的性质预测 使用活性预测工具Peptide Ranker(http://distilldeep.ucd.ie/PeptideRanker/)对酶解获得的多肽片段活性进行预测,筛选高活性(>0.5)的肽片段。使用毒性预测工具ToxinPred(https://webs.iiitd.edu.in/raghava/toxinpred/multi_submit.php)筛选无毒的活性肽。使用抗冻蛋白/抗冻多肽数据库CryoProtect(http://codes.bio/cryoprotect/)筛选属于抗冻多肽的肽序列。
1.2.7 海鲈鱼肌球蛋白重链的同源建模 分别使用SWISS-MODEL(https://swissmodel.expasy.org/)、ITASSER(https://zhanggroup.org/I-TASSER/)对肌球蛋白重链进行同源建模,选择准确度高的建模结果。
1.2.8 分子对接 使用Discovery studio 2019 软件进行分子对接。进行''Prepare Protein''的前处理操作去除肌球蛋白重链晶体的水分子和配体并定义为受体。配体活性肽通过''Prepare Ligands''前处理并通过''Full Minimization''进行CHARMm 力场最小化优化结构。处理后的肌球蛋白重链晶体以及抗冻多肽分别进行Dock Ligands(CDOCKER)分子对接。筛选结果中对接成功的化合物,并选取分值最高的对接结果。
1.2.9 分子动力学模拟 分子动力学模拟使用Discovery studio 2019 软件进行。将分子对接的蛋白-多肽复合物导入,进行''Prepare Protein''前处理,添加力场charmm36,进行Solvation 流程溶剂化复合物。打开动力学流程Standard Dynamics Cascade,设置Simulation Time(ps)为20、Simulation Time(ps)为200、Number of Processors 为8,其它参数保持默认。
2 结果与分析
2.1 不同酶解产物的抗冻活性
选用五种蛋白酶分别测定不同酶解物的抗冻活性,以嗜热链球菌的低温保护活性为检测指标,结果如图1。由图可知,经过胰蛋白酶的水解后,鱼鳞酶解物对嗜热链球菌存活率显著提高(<0.05),达到80.35%±4.39%。后续对其抗冻活性进行表征,并命名为AFPs。
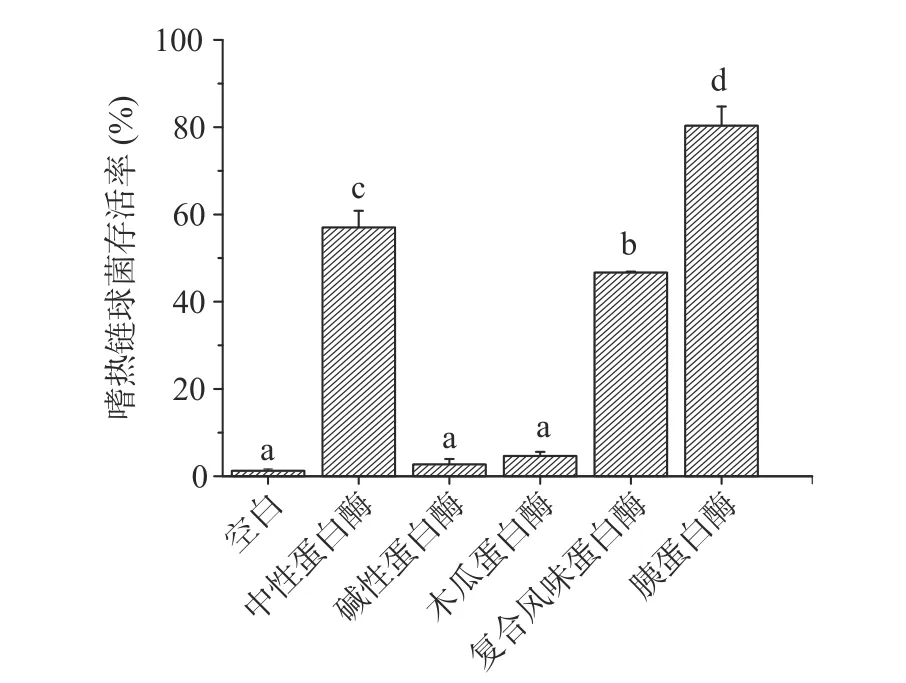
图1 不同蛋白酶对嗜热链球菌存活率的影响Fig.1 Effect of different proteases on the viability of S.thermophiles
2.2 热滞活性
在不同保留温度下测定了BSA 和AFPs 的部分融化过程DSC 曲线,二者相应的DSC 热流曲线结果如表1 所示。随着保留温度T的上升,BSA 组的冰核百分含量(Φ)从91.8%下降到38.2%,而AFPs组的冰核百分含量(Φ)从44.7%下降到5.3%。在相同保留温度时,AFPs 的冰核含量明显低于BSA,而热滞活性高于BSA。说明当T越接近样品融点时,Φ 含量越低,THA 越高,THA 与冰核百分含量(Φ)存在一定的负相关关系。

表1 BSA 和AFPs 的冻结起始温度、保留温度、冰晶含量和热滞活性Table 1 Freezing initiation temperature,retention temperature,ice crystal content and thermal hysteresis activity of BSA and AFPs
2.3 重结晶抑制活性
大冰晶的表面能小于小冰晶的表面能,冻融过程中小冰晶不断聚合形成大冰晶,产生冰重结晶现象。而抗冻多肽可以使冷冻溶液中冰晶保持小尺寸状态,抑制冰晶的重结晶。如图2 所示,在含有AFPs 的溶液中,冰晶尺寸小于同浓度的BSA 溶液和空白组。

图2 水分子重结晶显微成像Fig.2 Photomicroscope images showing inhibition of ice recrystallization
2.4 计算机辅助挖掘鱼源抗冻多肽
选择PeptideCutter 中的胰蛋白酶对鱼源胶原蛋白进行酶解切割,通过模拟酶解方法,省去分离纯化及质谱等步骤。经模拟酶解后1356 个氨基酸的鱼源胶原蛋白序列被酶解为115 条肽段,具体结果如表2 所示。

表2 模拟酶解肽段序列及切割位点Table 2 Mimic enzymatic hydrolysis peptide sequence and cleavage site
2.5 鱼源抗冻多肽的筛选
将所有肽段进行Peptide Ranker 活性预测,选择预测活性分数大于0.5 的共47 条肽段序列,并对其进行ToxinPred 毒性预测,结果表明除GATGPGGIR序列外其余序列皆无毒,使用抗冻蛋白/抗冻多肽数据库CryoProtect 筛选,结果表明除R 序列外其余序列皆属于潜在的抗冻多肽。具体结果如表3。

表3 肽段序列活性、毒性分析及抗冻活性预测Table 3 Peptide sequence activity,toxicity analysis and antifreeze activity prediction
2.6 鱼肌球蛋白的同源建模
对海鲈鱼肌球蛋白重链进行同源建模,采用SWISS-MODEL 构建的三维结构模型见图3a,ITASSER 构建的三维结构模型见图3b。为进一步说明同源建模结果的合理性,通过SAVESv6.0(https://saves.mbi.ucla.edu/)对建模结果进行评估。拉式构像图(Ramachandran plot)是描述蛋白质结构中氨基酸残基二面角ψ 和φ 是否在合理区域的一种可视化方法,也可以反映出该蛋白质的构象是否合理。由图4a、图4c 可知,SWISS-MODEL 构建的三维结构模型有氨基酸88.9%落在完全允许区,9.2%落在允许区,0.9%落在最大允许区,0.9%落在不允许区,99.1%落在合理的区域。I-TASSER 构建的三维结构模型有氨基酸81.6%落在完全允许区,16.1%落在允许区,2.3%落在最大允许区,没有落在不允许区氨基酸,100%落在合理的区域。

图3 海鲈鱼肌球蛋白重链同源建模的三维结构Fig.3 3D structure of sea bass myosin heavy chain homology modeling
蛋白三维结构准确性随着整体质量因素值的增加而增加。通常,高分辨率晶体结构的值可以达到95%,而分辨率较低的结构的值只能达到大约91%。由图4b、图4d 可知,SWISS-MODEL 构建的三维结构模型精确值为92.661%,I-TASSER 构建的三维结构模型精确值为96.154%。与高分辨率晶体结构更接近,表明I-TASSER 构建的三维结构模型的准确性相对较高。故I-TASSER构建的三维蛋白结构模型更可靠,用于后续的分子对接研究。
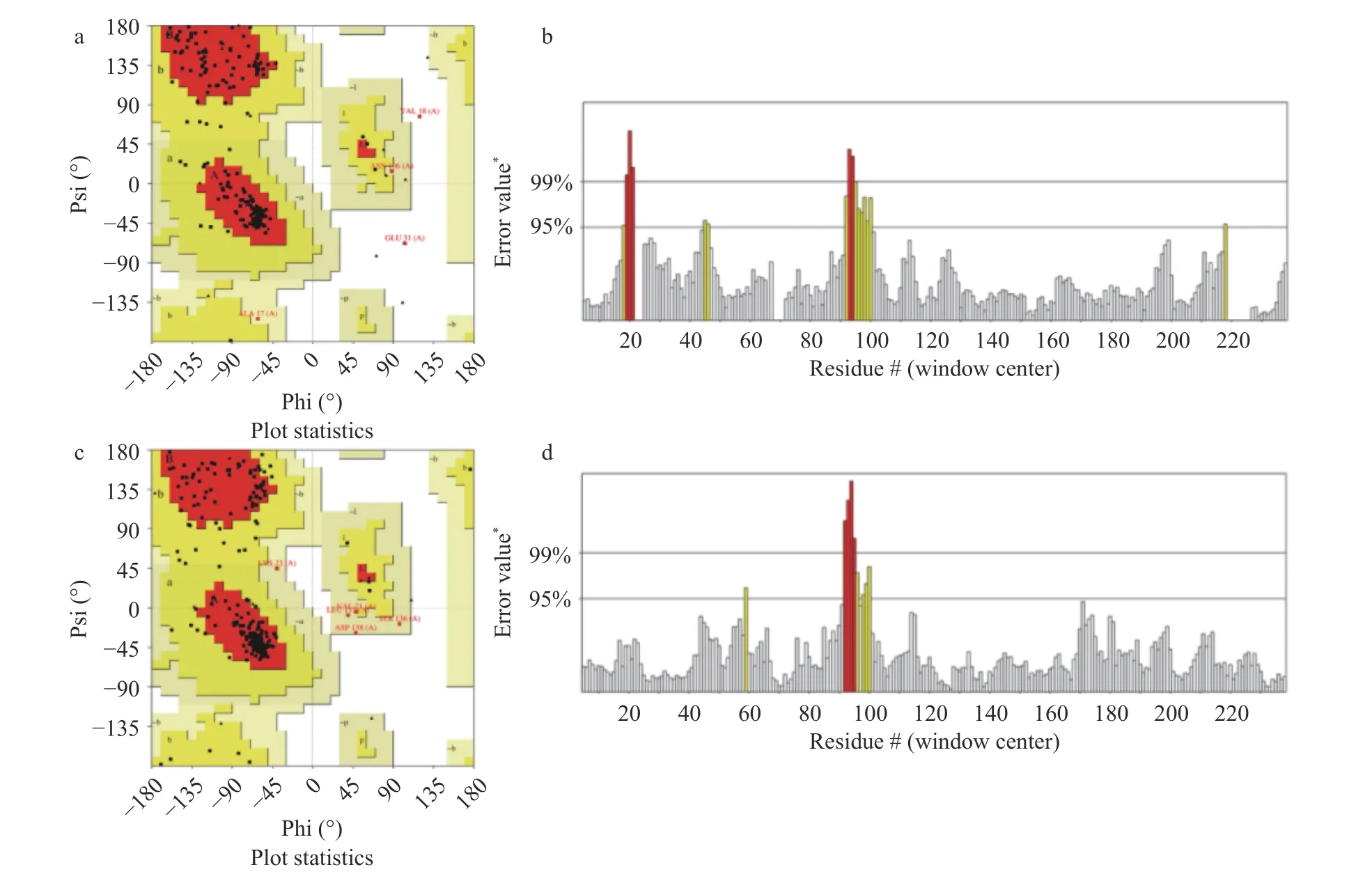
图4 建模结果评估Fig.4 Modeling result evaluation
2.7 抗冻多肽与鱼肌球蛋白重链的分子对接
与肌球蛋白重链对接上的抗冻多肽序列共有GR、GMK、GAR、GPR、GPAGGK 五条。Graham等从雪蚤中纯化的抗冻蛋白氨基酸序列为GAA GAGSSGP。Cao 等通过序列分析推导出AP-3 抗冻蛋白氨基酸组成为GLLGPLGPRGL。Wang 等纯化的鲨鱼皮胶原蛋白抗冻多肽氨基酸序列为GAIGPAGPLGP。Nikoo 等从黑龙江鲟鱼皮明胶中提取的抗冻多肽是PAGT,并验证出PAGT 在肉糜模型系统中具有抗氧化和冷冻保护作用。Damodara 等分离的鱼明胶抗冻多肽氨基酸序列为KDGTPGQFGP(OH)PGAPGKGN(OH)H、NEGT PGTGPAGPP(OH)GFHTPK(OH)W,它们都含有GTPG-和GPP(OH)G-结构指纹。综上,选择更符合胶原蛋白抗冻多肽的序列GPR 与GPAGGK 进行进一步对接及动力学分析。
选择的对接结合空腔坐标为64.5359、85.5816、76.7437、半径为8,GPR 和GPAGGK 与肌球蛋白重链的对接结果如图5a、图5b 所示,对接位点2D 示意图如图6 所示,模拟酶解肽段GPR 可以与MHC 中Ile34 氨基酸形成碳氢键,与Asp76 氨基酸形成静电作用,与Ala75、Asp76、Ile77 氨基酸形成氢键,还能以范德华力与Ile9、Gln33、Asn38、Ala40、Ile62、Arg63、Ile64、Phe155 氨基酸结合。模拟酶解肽段GPAGGK 可以与MHC 中Ala75 氨基酸形成氢键,还能以范德华力与Gln33、Ala37、Leu41、Phe58、Gly59、Phe61、Ile62、Ser74、Asp76、Ile77、Glu78、Thr79、Tyr80、Leu153 氨基酸结合。

图5 抗冻多肽与肌球蛋白重链的分子对接Fig.5 Molecular docking of antifreeze peptides and myosin heavy chain

图6 对接2D 示意图Fig.6 2D diagrams of docking
在冻藏过程中,首先被冻结的为组织内的自由水。随着冻结时间的延长,自由水完全转化为冰后与蛋白质结合的结合水也开始发生冻结,脱离蛋白,从而导致疏水键及二硫键等化学键的形成并聚集,蛋白的各个侧链相互聚集,发生不可逆的变性。抗冻多肽可以通过氢键、疏水相互作用和范德华力等分子之间作用力,吸附在液体冰晶表面,阻碍了冰晶在固、液界面位移及与水分子的结合。通过抗冻多肽与肌球蛋白重链的分子对接发现,抗冻多肽还可以通过氢键、范德华力等分子间作用力与肌球蛋白直接作用,结合在肌球蛋白的结构空腔上,影响疏水键及二硫键等化学键的形成,阻碍蛋白侧链聚集与结构改变,对冰晶的位移也有一定影响作用。
2.8 抗冻多肽与海鲈鱼肌球蛋白重链的分子动力学模拟
通过绘制蛋白质的RMSD 作为构象变化的函数,可以可视化整体蛋白质稳定性。在分子动力学模拟中,RMSD 用于评估与初始蛋白质结构的结构偏差(即估计蛋白质完整性)。RMSD 连续增加至高值表明构象不稳定。MHC、MHC-GPR 和MHCGPAGGK 计算出的RMSD 值如图7a 所示。RMSD值随着构象变化逐渐增加,MHC 的RMSD 值在构象60 时达到最大,波动约为0.8 Å;MHC-GPR 的RMSD 值在构象73 时达到最大,波动约为1.5 Å;MHC-GPAGGK 的RMSD 值相较其他较为稳定,波动约为0.5 Å,这些波动可能是因为肌球蛋白三级和二级结构的变化。与单独的MHC 相比MHC-GPR初始稳定性会提高,但随着温度和时间变化,构象会变得更不稳定,这可能是因为GPR 与MHC 的结合并不牢固。而MHC-GPAGGK 可以使蛋白在温度和时间的变化中变得构象更加稳定。

图7 分子动力学模拟结果Fig.7 Molecular dynamics simulation results
为了进一步表征肌球蛋白重链的构象灵活性,绘制了RMSF 作为残基数的函数。RMSF 值是残留灵活性的标准。如图7b 所示,残基17~32,173~187和214~231 的RMSF 值显著增加。这些具有较大RMSF 波动的位置是肌球蛋白重链柔性较大的区域,推测是肌球蛋白重链与抗冻多肽作用的位置。通过RMSD 与RMSF 的结果,可以发现,抗冻多肽GPAGGK 与肌球蛋白结合可以在温度变化的过程中,稳定构象,延缓蛋白变性。
3 结论
本研究发现鱼源胶原蛋白的胰蛋白酶酶解物具有较高的抗冻活性,使用胰蛋白酶模拟酶解鱼源胶原蛋白,运用计算机筛选得到抗冻多肽,省去分离纯化及质谱等步骤。并与同源建模后的海鲈鱼肌球蛋白重链进行分子模拟,以研究鱼源胶原蛋白抗冻多肽对肌球蛋白的保护机制。分子对接结果表明,肽段GPR 和GPAGGK 能够通过碳氢键、氢键和范德华力等分子作用力对海鲈鱼肌球蛋白的结构及聚集行为产生影响,阻碍蛋白侧链聚集、结构改变和冰晶的位移等。分子动力学结果表明,肽段GPAGGK 比肽段GPR 结合的更稳定,由此结果可预测肽段GPAGGK 对鱼糜及鱼糜制品在冷冻贮藏中的品质保持起到更明显的作用,GPAGGK 可作为潜在的抗冻剂应用于后续抗冻鱼糜产品的研发。

