冰菜多酚的提取优化及抗氧化和抑菌活性研究
王贞利,王俊斌,b,通信作者,王敏,杨宗芬,王海凤
(天津农学院,a.基础科学学院,b.化学实验教学中心,c.农业分析测试中心,天津 300392)
冰菜(Mesembryanthemum crystallinum)为番杏科日中花属1 年或2 年生草本植物,原产于非洲南部,分布广泛,具有极强的抗旱性和耐盐碱性,可以在低盐碱化土壤中维持正常生长,生长周期为3~6个月,是植物耐盐性研究的代表植物之一。冰菜因其独特的口感和丰富的营养价值,在很多国家作为一种新兴健康蔬菜被人们食用[1]。研究表明,食用含有酚类和黄酮类化合物等植物化学物质的功能性食品可以预防各类疾病。冰菜中含有黄酮、多酚、超氧化物歧化酶、抗坏血酸过氧化物酶等多种抗氧化活性高的物质和酶类[2-3]。多酚是具有苯环并结合了多个羟基化学结构物质的总称[4]。天然来源的植物多酚具有显著的抗氧化活性,可作为抗氧化剂、抑菌剂、防腐剂等广泛应用于营养保健、食品、医药等领域,具有很大的开发潜力。天然多酚类物质的抗氧化活性一直备受关注,尤其是植物来源的天然抗氧化剂[5-6]。植物多酚通过抑制细菌细胞膜的形成,破坏细胞结构,导致内容物发生渗透,抑制了细菌产酸及产霉活性等[7]。
已有研究证实冰菜多酚类提取物具有较高的抗氧化能力[8],说明冰菜多酚具有很大的开发潜力。目前,国内对于冰菜活性物质提取和应用的相关研究较少,限制了其进一步综合利用。本研究主要对冰菜多酚的提取工艺进行探索和优化,并测定其对1,1-二苯基-2-三硝基苯肼(DPPH)自由基和羟基自由基的清除能力和抑菌效果,以期为冰菜作为抗氧化食品的加工和开发利用提供依据。
1 材料与方法
1.1 材料、试剂与仪器
将新鲜冰菜冲洗干净置于烘箱中,37 ℃烘干至恒重,粉碎,过60 目筛备用。没食子酸,中国药品生物制品检定所,其余试剂均为分析纯。试验仪器包括Elma P120 超声仪、T6 新世纪紫外-可见分光光度计以及其他常规分析仪器。
1.2 标准曲线的绘制
采用Folin-ciocalteau 方法并适当修改[9],以吸光度对没食子酸含量进行线性回归(图1),得到回归方程:y=95.657x-0.008,R2=0.997 6。
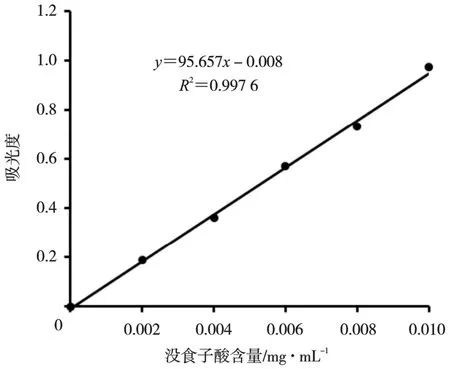
图1 没食子酸标准曲线
1.3 冰菜多酚的提取和测定
根据预试验结果进行单因素试验,称取1 g冰菜粉末,放入50 mL 离心管中,在不同条件下对冰菜进行提取,离心。将提取液脱色(加入液体体积1%的活性炭,60 ℃,保温40 min)[10],冷却至常温,离心(4 000 r/min,5 min)后过滤,根据料液比稀释适当倍数,即得冰菜提取液。
准确量取冰菜多酚提取液10 mL,置于25 mL比色管中,按照1.2 所示方法测定吸光度,带入回归方程,求得冰菜提取液中多酚的质量浓度,按公式(1)计算冰菜多酚提取率。
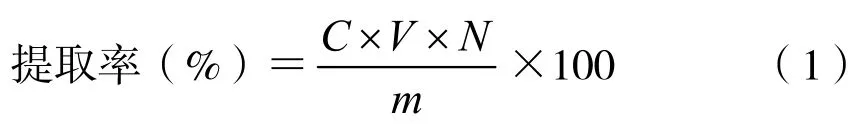
式中,C——提取液多酚质量浓度,mg/mL;V——提取液体积,mL;N——提取液稀释倍数;m——用于提取的冰菜粉末质量,mg
1.4 单因素试验
采用超声波辅助提取法[11],超声功率固定为300 W,37 Hz,考察乙醇体积分数(50%、60%、70%、80%、90%)、料液比(1∶5、1∶10、1∶15、1∶20、1∶25)、提取温度(40、50、60、70、80 ℃)、提取时间(60、90、120、150、180 min)对冰菜多酚提取率的影响。
1.5 正交试验
根据单因素试验结果,以多酚提取率为评价指标,分别选取乙醇体积分数、料液比、提取温度、提取时间4 个因素中最优的3 个因素,进行L9(34)正交试验[12],正交试验表见表1。
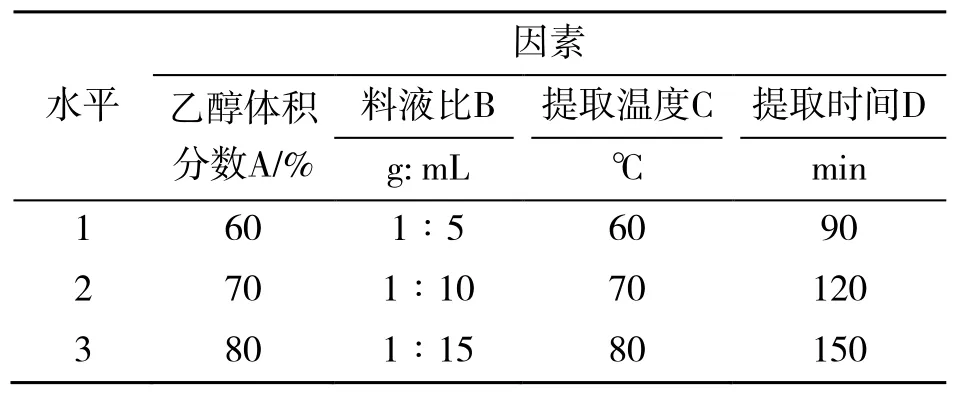
表1 正交试验因素及水平
1.6 对DPPH 自由基清除能力测定
向2.50 mL 0.20 mmol/L 的DPPH 乙醇溶液中加入1 mL 冰菜多酚提取液,提取液质量浓度分别为 0.02、0.04、0.06、0.08、0.10 mg/mL,反应30 min(避光),在波长517 nm 处测定其吸光度,记作A1。另取具塞试管加入2.50 mL 0.20 mmol/L 的DPPH 乙醇溶液和1 mL 无水乙醇混合,测定其吸光度,记作A0。再另取具塞试管加入2.50 mL 无水乙醇和1 mL不同质量浓度的冰菜多酚提取液混合均匀,吸光度记为A2。用同质量浓度的维生素C 作为阳性对照,按公式(2)计算冰菜多酚提取液对DPPH 的清除率[13]。
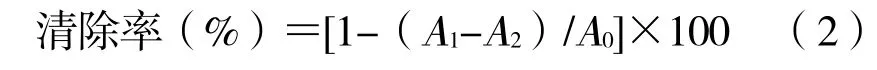
1.7 对羟基自由基清除能力测定
利用水杨酸法测定冰菜多酚提取液对羟基自由基的清除率。取6 mmol/L 硫酸亚铁溶液、6 mmol/L水杨酸乙醇溶液各1 mL 加入试管,混匀,再分别加入0.02、0.04、0.06、0.08、0.10 mg/mL 冰菜多酚提取液1 mL 及6 mmol/L 过氧化氢溶液1 mL,混匀,于37 ℃水浴锅中反应30 min,蒸馏水调零,于510 nm 处测定样品管吸光度A1,以1 mL 蒸馏水代替样品溶液测定A0,以1 mL 蒸馏水代替H2O2溶液测定A2。用相同质量浓度的维生素C 作为阳性对照,按公式(3)计算多酚提取液对羟基自由基的清除率[13-14]。
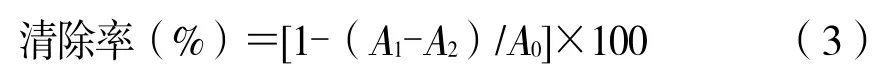
1.8 冰菜多酚提取物抑菌活性测定
利用滤纸片法[10]对冰菜粗提物(多酚)进行抑菌试验。选用常见菌种大肠杆菌进行抑菌试验,观察多酚提取物对大肠杆菌的抑菌效果。在乙醇体积分数为60%、料液比1∶10(g:mL)、提取温度80 ℃、提取时间120 min 的条件下提取冰菜多酚,离心过滤,旋蒸浓缩多酚提取液,定容使多酚含量为3 mg/mL。
2 结果与分析
2.1 单因素试验结果
2.1.1 提取溶剂体积分数对多酚提取率的影响
由图2 可以看出,在乙醇体积分数50%~70%范围内,冰菜多酚提取率随乙醇体积分数的增加而增加,当乙醇体积分数超过70%时,多酚提取率呈逐渐下降趋势。这是由于溶剂体积分数过高,可能导致其他杂质溶出增多,造成多酚含量减少。故选择70%乙醇用于后续单因素试验,此时冰菜多酚提取率达到最高。
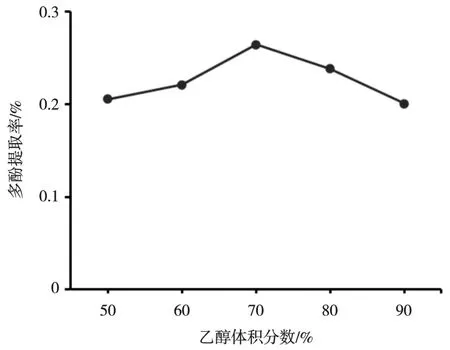
图2 乙醇体积分数对冰菜多酚提取率的影响
2.1.2 料液比对多酚提取率的影响
比较不同料液比冰菜多酚的提取率可知,当料液比在1∶10 时多酚提取率最高,之后随着料液比降低,提取率不断下降(图3)。这可能是由于料液比较低时,溶质和溶剂接触不充分,导致细胞中的多酚不易溶出,而过大的料液比会降低超声波的超声效果,使冰菜细胞壁不易被破坏,多酚难以溶出,提取率也随之下降。
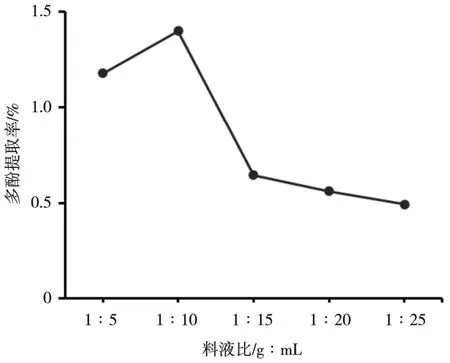
图3 料液比对冰菜多酚提取率的影响
2.1.3 提取温度对多酚提取率的影响
温度是影响植物活性物质提取的重要因素。由图4 可以看出,当提取温度低于70 ℃时,随着提取温度的不断上升,多酚提取率也不断增加。当提取温度大于70 ℃时,多酚提取率略有下降。这是由于适当提高温度会加快分子运动,有利于冰菜多酚的扩散和浸出,但温度过高时,因化学和酶促降解使不稳定的多酚类物质受热分解,造成提取率下降,这可能与酚类物质的热敏性有关。此结果与尚红梅等[15]的研究结果相符。故选取70 ℃作为后续单因素试验的提取温度。
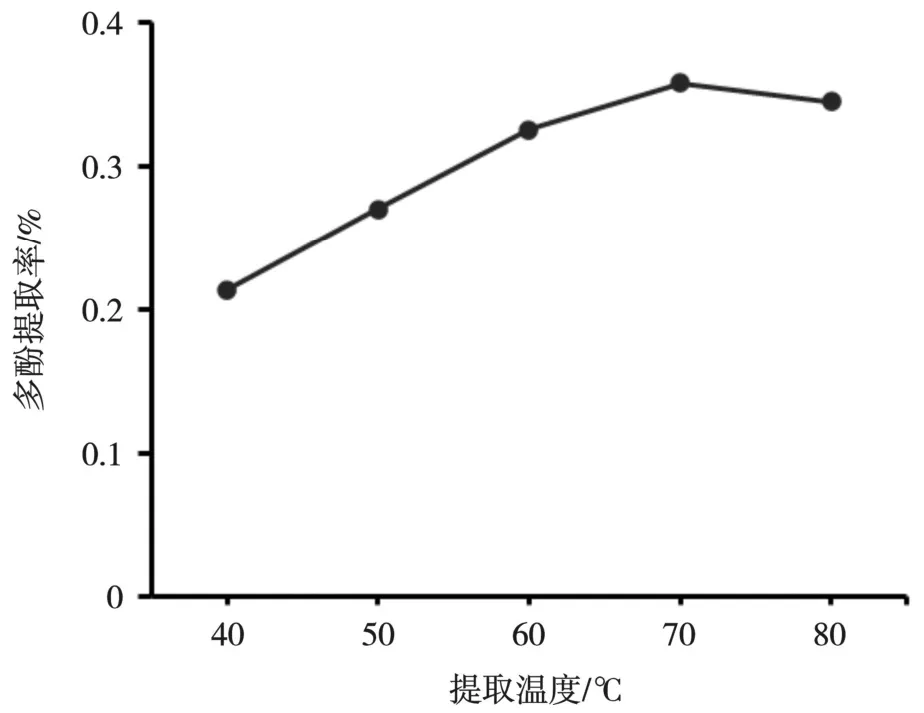
图4 提取温度对冰菜多酚提取率的影响
2.1.4 提取时间对多酚提取率的影响
由图5 可以看出,当提取时间在30~90 min范围内,多酚提取率随时间的延长而增加,在提取时间为90 min 时,提取率达到最高。但当提取时间超过90 min 时,多酚提取率呈下降趋势。可能是由于随着提取时间的增加,部分多酚遭到破坏,导致提取率下降。
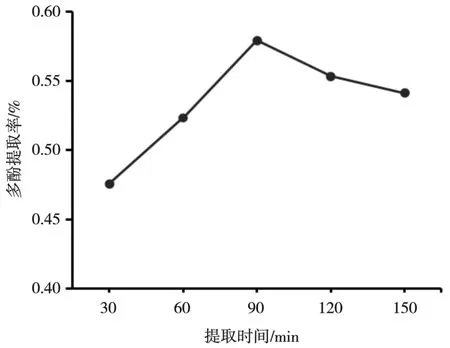
图5 提取时间对冰菜多酚提取率的影响
2.2 正交试验结果
在单因素试验基础上,通过正交试验确定冰菜多酚的最佳提取条件,如表2 所示。由表2 可知,多酚最佳提取工艺条件为A1B2C3D2,即:乙醇体积分数为60%、料液比1∶10(g:mL)、提取温度80 ℃、提取时间120 min。在此工艺条件下进行验证试验,多酚提取率为1.42%。表2 还表明,各因素对试验指标的影响顺序为:提取温度(C)>料液比(B)>乙醇体积分数(A)>提取时间(D),其中提取温度对提取率的影响最为明显。忻晓庭等[16]研究了热风干燥温度对多酚含量和抗氧化活性的影响,表明80 ℃时多酚含量最高,与本研究结果一致。
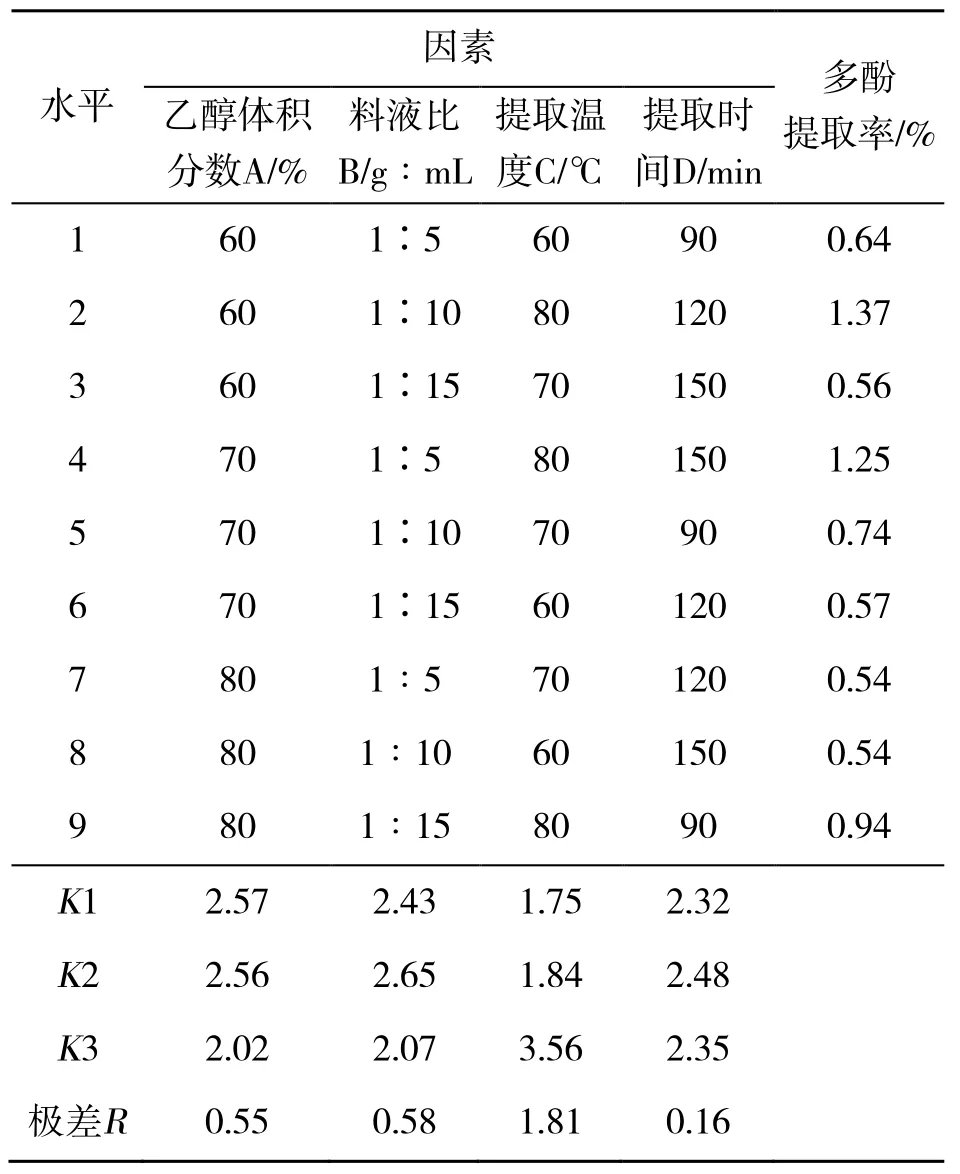
表2 正交试验结果
2.3 冰菜多酚提取物的抗氧化能力
研究表明,多酚类物质具有清除自由基的能力。本试验中采用DPPH 自由基和羟基自由基清除率来评价冰菜多酚提取物的抗氧化活性。
2.3.1 冰菜多酚对DPPH 自由基的清除能力
由图6 可以看出,随着提取物质量浓度的上升,对DPPH 自由基的清除能力也在不断增加,当提取物质量浓度达到0.10 mg/mL 时,对DPPH的清除率达到 64.19%,但冰菜多酚提取物对DPPH 自由基的清除能力略低于维生素C。
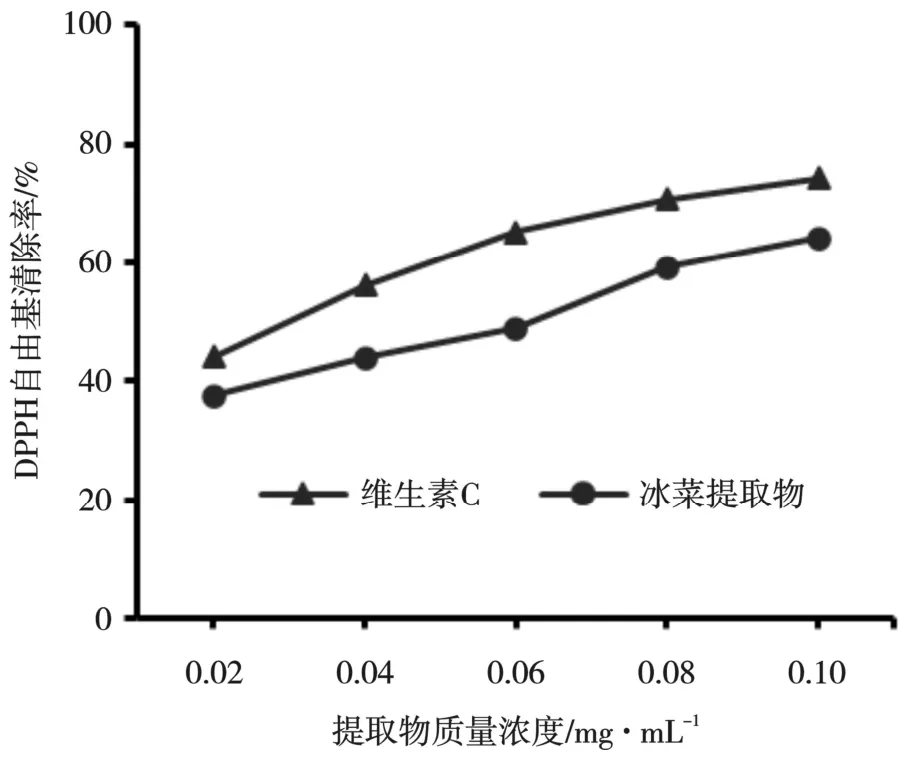
图6 冰菜多酚提取物对DPPH自由基的清除能力
2.3.2 冰菜多酚对羟基自由基的清除能力
图7 表明,冰菜多酚提取物对羟基自由基的清除能力随多酚质量浓度的增加呈上升趋势。当提取物质量浓度高于0.04 mg/mL 时,对羟基自由基的清除能力明显强于维生素C,当提取物质量浓度为0.10 mg/mL 时,对羟基自由基的清除率最高可达88.10%。与荠菜相比,冰菜多酚提取物对羟基自由基的清除率较高[17]。
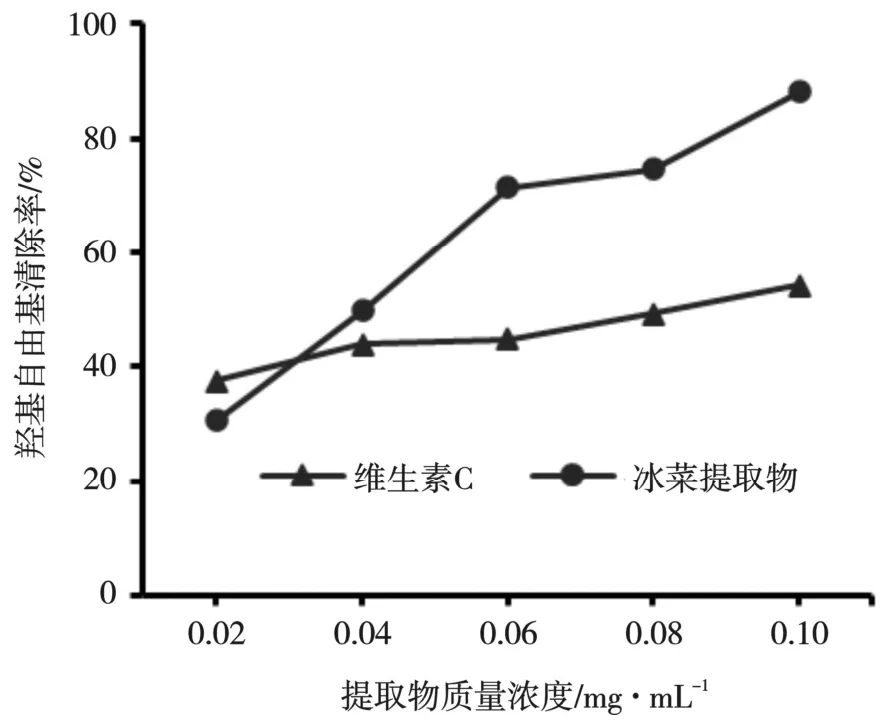
图7 冰菜多酚提取物对羟基自由基的清除能力
2.4 冰菜多酚提取物的抑菌活性能力
研究表明,很多抗氧化物质同时具有抑菌活性。本试验结果表明,冰菜多酚提取物对大肠杆菌有明显的抑制效果,且随提取物质量浓度的增大抑制效果也明显增强(图8),当提取物质量浓度达到3 mmg/mL 时,抑菌圈直径为12 mm。

图8 冰菜多酚提取物对大肠杆菌的抑制作用
3 讨论与结论
冰菜是一种含有多种活性物质的高营养价值蔬菜,具有降血糖、防脱发、促进脂肪代谢等多种保健功能[3]。本研究中选取新鲜冰菜低温干燥并粉碎成粉末,用超声波辅助法提取多酚,探索和优化冰菜多酚的提取条件,并对多酚提取物进行抗氧化及抑菌活性试验。由试验可知,冰菜多酚提取率相对较低,可能是提取过程中温度过高且时间较长,对冰菜多酚造成了一定程度的破坏,这与忻晓庭等[16]的研究结果相符。植物组织中多酚类物质有较强的抗氧化和抑菌活性,其评价方法很多[18-19]。IBTISSEM 等[20]研究表明,冰菜水提物具有抗氧化和抗菌活性。SEUNGMI 等[21]认为,冰菜提取物具有抗氧化活性,可作为一种天然的抗氧化功能性食品。本研究以维生素C 为对照,采用DPPH 自由基和羟基自由基清除法测定冰菜乙醇-水溶液提取物的抗氧化和抑菌活性。结果表明,提取物的抗氧化活性大小与酚含量有关,当冰菜多酚质量浓度为0.10 mg/mL 时,对DPPH 自由基和羟基自由基的清除率均超过60%,与维生素C 相比,提取物对DPPH 自由基的清除率比较低。当提取物质量浓度大于0.04 mg/mL 时,对羟基自由基的清除率明显高于维生素C,说明冰菜多酚具有较强的抗氧化能力。冰菜中含有的多酚类活性物质对大肠杆菌的抑制作用,可以为冰菜抑制肠道细菌提供依据,或可用于预防或缓解肠道疾病[22]。本研究中冰菜多酚提取物只是一个粗提物,尚没有经过纯化,有待今后进一步研究。
试验中发现,在最佳提取工艺条件下,冰菜多酚提取率为1.42%,且提取物的质量浓度越大,对DPPH 自由基及羟基自由基的清除能力越强。当冰菜多酚提取物质量浓度为0.10 mg/mL 时,对DPPH 自由基清除率达到最大,为64.19%,低于同质量浓度的维生素C;羟基自由基清除率达到最大时,清除率为88.10%,远高于同质量浓度的维生素C。并且冰菜多酚对大肠杆菌有明显的抑制作用。本研究结果表明,冰菜多酚可作为一种天然抗氧化剂与抑菌剂,具有广阔的开发前景。

