番茄愈伤组织筛选及抗逆突变体的获得
何远秦,许丁帆,刘艳军,通信作者,季核亮,赵丽丽,董洪雨
(1.天津农学院 园艺园林学院,天津 300392;2.天津市耕耘种业股份有限公司,天津 300408)
番茄(Solanum lycopersium),茄科茄属植物,果实风味独特,营养价值丰富,是世界范围内栽培最为普遍的果菜之一。植物在生长发育期间会受到各种不良环境因子的影响,其中包括生物胁迫和非生物胁迫[1]。番茄在营养生长及果实形成过程中对水分的需求居茄果类蔬菜之首[2]。多数栽培番茄品种对干旱胁迫敏感,对盐胁迫中度敏感[3]。在如今土壤盐渍化等环境问题日趋严重的趋势下,培育具有良好抗逆性的番茄品种对番茄产业的发展具有重要作用。
经过长期的人工选育,现代番茄栽培种的遗传背景已变得十分狭窄,因此通过杂交筛选将野生种与栽培种的优良农艺性状相结合是番茄较普遍的抗逆育种途径[3-4],然而此种方法存在着育种周期长和基因资源有限等问题。随着分子生物学技术的发展,抗性基因的定位技术已经在甘蔗、水稻上应用,利用转基因技术将相应的抗性基因导入蔬菜中,可以创造出抗逆性育种的新材料[5]。虽然已利用植物基因工程技术获得相关的番茄抗逆性植株,但转基因番茄的安全性、后代持续抗性、广谱抗性等还有待进一步研究和探讨。因此,目前转基因技术并没有广泛应用于番茄的生产中[6]。据研究报道,在植物组织培养过程中会出现广泛的变异情况即体细胞无性系变异,而体细胞无性系变异的变异率可以高达30%~40%,一些具体性状的变异率可以达到0.2%~3.0%[7],故可以通过植物组织培养技术对愈伤组织进行筛选进而获得抗性突变体植株,相关研究已经在多种植物的抗性育种中得到应用,但在番茄育种中的应用少有报道[8-9]。
聚乙二醇(PEG)是一种理想的渗透剂,会降低植物细胞胞外水势,进而对植物细胞外膜产生胁迫作用[10]。细胞外膜在受到非生物胁迫的刺激后,会产生相应的第二信号分子,进而刺激细胞内膜调节胞内Ca2+水平,产生磷酸化蛋白分子,促进与细胞保护相关蛋白或相关转录因子的产生,进而提升植物细胞对逆境的适应能力[11]。当前PEG 相关研究大多集中在使用PEG 对植物种子和幼苗进行胁迫和筛选,在愈伤组织研究中的应用相对较少[12-14]。张聪等[15]在诱变选育菜用甘薯耐旱材料的试验中,使用PEG 对辐射诱变后的愈伤组织进行筛选获得了耐旱材料。本试验通过在培养基中添加PEG-8000 造成渗透胁迫,筛选番茄愈伤组织中某些耐渗透突变细胞,同时诱导愈伤组织细胞再生,通过再生植株叶片表型和生长势筛选出突变体。突变植株如经过进一步抗逆性检测验证,可作为番茄育种的抗性种质资源。
1 材料与方法
1.1 试验材料
供试番茄盆栽苗品种为‘盛美’,由天津市耕耘种业股份有限公司提供。番茄盆栽基质为V草炭∶V蛭石∶V珍珠岩=2∶2∶1。
1.2 试验方法
1.2.1 番茄组培苗的获取
选取长势一致且健壮的茎段,剪去叶片及部分叶柄,在超净台中剪成2~3 cm 带一个腋芽的茎段,70%乙醇浸泡30 s,无菌水冲洗3 次,每次5 min,然后用含2.0%有效氯的次氯酸钠溶液消毒5 min,无菌水冲洗5 次,每次5 min,冲洗后用无菌滤纸吸干外植体表面,并将茎段两端各剪去约3 mm,接种到不含植物激素的MS 培养基上进行初代培养。每天观察腋芽萌发情况并及时清除污染苗,经过20 d 初代培养,将萌发的腋芽从基部切下,转接至MS 培养基上进行继代增殖培养,获得大量番茄组培苗备用。
1.2.2 番茄组培苗愈伤组织的诱导试验
选取顶芽正常、生长健壮且长势一致的番茄组培苗,以初展叶片的叶柄为外植体,剪成长度约0.5 cm 小段,接种到含不同激素的愈伤组织诱导培养基上,进行愈伤组织诱导。诱导培养基采用MS 为基本培养基,改变MS 无机盐倍数、添加不同浓度配比的BA 和2,4-D(见表1),培养基pH 为5.8,碳源为30 g/L 蔗糖,7 g/L 琼脂粉固化。100 mL 广口三角瓶每瓶加入约30 mL 培养基。每个处理接种5 瓶,每瓶接种6 个外植体,重复3次。每天观察外植体变化及愈伤组织生长情况,30 d 后记录并统计试验结果。
愈伤组织诱导率/%=诱导出愈伤组织的外植体数/接种外植体数×100
1.2.3 番茄愈伤组织不定芽分化诱导
将1.2.2 诱导所得的番茄愈伤组织在超净工作台中分割成大小约3 mm×3 mm 的小块,转接到番茄愈伤组织再生培养基上。培养基采用MS 为基本培养基,添加不同浓度的激素(见表2),调节pH值为5.8,蔗糖与琼脂粉用量同1.2.2。每个处理重复3 次,一个处理接种5 瓶,每瓶接种6 块愈伤组织,30 d 后统计愈伤组织的不定芽分化情况。
不定芽分化率/%=分化不定芽的愈伤组织数/接种愈伤组织数×100
1.2.4 愈伤组织逆境分化诱导
通过1.2.3 确定番茄愈伤组织最佳分化培养基:MS+1.0 mg/L BA。将愈伤组织分割成大小约3 mm×3 mm 小块,转接到分别添加质量分数1%、3%、5%、7%、9% PEG-8000 的最佳分化培养基中。每个处理接种6 瓶,每瓶接种5 块愈伤组织,重复3 次。每天观察不定芽生长情况,30 d 后统计愈伤组织上分化出的不定芽数。在继续培养15 d 后,观察统计不定芽的生长情况,统计生长势正常的不定芽数量。通过分化出的不定芽的生长情况进行判断,筛选抗逆性强的不定芽。
不定芽正常生长率/%=生长势正常的不定芽数/愈伤组织分化出的不定芽数×100
1.3 培养条件
接种后的培养瓶置于组培室内,培养温度为(25±2)℃,光照强度为2 000 lx,进行连续光照培养。
2 结果与分析
2.1 番茄愈伤组织诱导试验
试验结果如表1 所示,从愈伤组织诱导率看,除未附加任何激素的MS 培养基外,其余培养基均诱导获得了番茄愈伤组织,且愈伤组织诱导率达100%,说明以番茄叶柄为外植体易诱导愈伤组织,在培养基中附加一定量2,4-D 即可诱导出愈伤组织;从愈伤组织质地与结构看,在只添加2,4-D 的MS 培养基上,番茄愈伤组织生长迅速,结构松散,但质地较软,表面白色,在显微镜下观察愈伤组织多为薄壁细胞,液泡大,细胞质稀;当降低MS 培养基无机盐倍数,使用1/2MS 培养基附加2,4-D 时,愈伤组织生长速度加快,颜色透明,显微观察愈伤组织基本由巨大型细胞组成,这类细胞一般不能继续分裂,只能随着生长而解体,不具备再生能力;为获得能够再生的愈伤组织,本试验在附加1.0 mg/L 和2.0 mg/L 2,4-D 的MS 培养基中添加1.0 mg/L BA,比较愈伤组织质地,在2.0 mg/L 2,4-D 与1.0 mg/L BA 下诱导的番茄愈伤组织质地较硬,结构松散,颜色黄绿色,多由个体较小,细胞质浓,处于旺盛分裂的细胞类型组成。综上所述,MS+1.0 mg/L BA+2.0 mg/L 2,4-D 培养基可诱导出理想的愈伤组织。
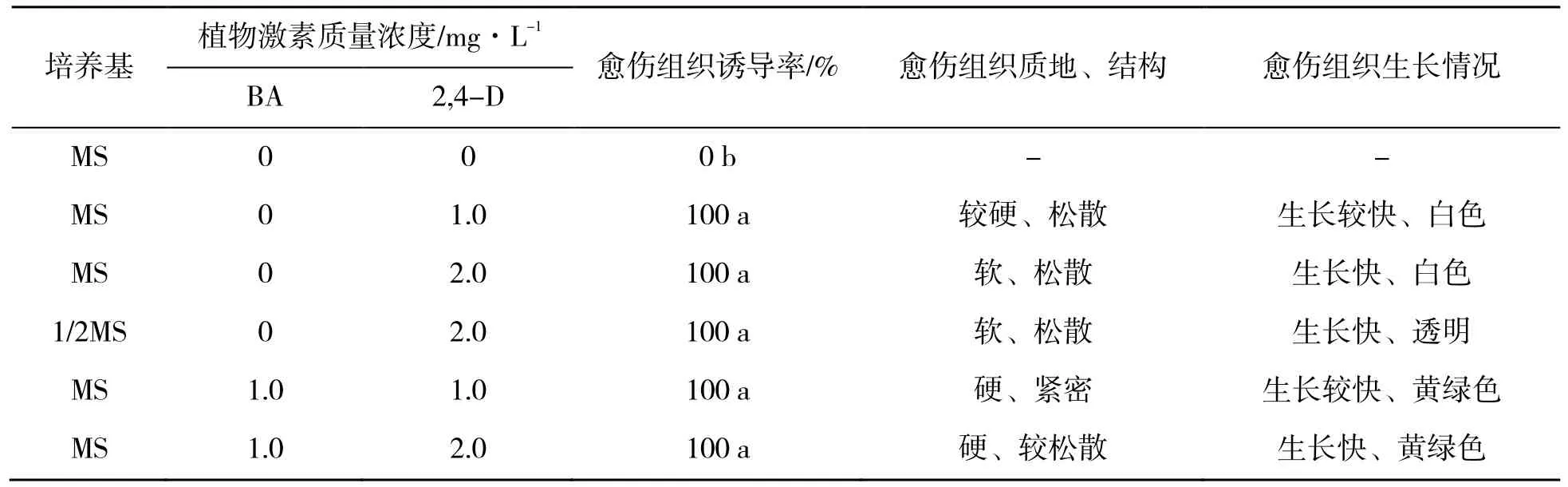
表1 番茄叶柄愈伤组织诱导试验结果
2.2 番茄愈伤组织不定芽分化培养试验
将番茄愈伤组织转接到分化培养基上,经过一段时间培养后,在愈伤组织表面产生较多的不定根,之后在部分愈伤组织上出现绿点并逐渐出现不定芽结构。由表2 可知,在不添加任何激素的MS 培养基上,番茄愈伤组织分化率较低,仅有少数愈伤组织上出现不定芽,且不定芽生长速度较慢。在MS 培养基中加入0.5 mg/L IAA 后,分化率与未加任何激素的MS 培养基无显著差异,不定芽数量少,且生长细弱。MS 培养基加入一定浓度BA 后,不定芽分化率显著提高,说明BA 能够促进番茄愈伤组织不定芽分化;番茄愈伤组织不定芽分化率随BA 质量浓度的升高而升高,BA质量浓度为1.0 mg/L 和2.0 mg/L 时不定芽分化率均高达100%,但不定芽生长情况不同:BA 质量浓度为1.0 mg/L 时,不定芽健壮且生长速度快;BA 质量浓度为2.0 mg/L 时,大多数不定芽出现玻璃化现象,说明高质量浓度BA 不利于不定芽生长。为平衡BA 的影响,在2.0 mg/L BA 的MS 培养基中添加0.5 mg/L IAA,仍出现了玻璃化现象。综上所述,在MS+1.0 mg/L BA 培养基上番茄愈伤组织不定芽分化效果最佳。
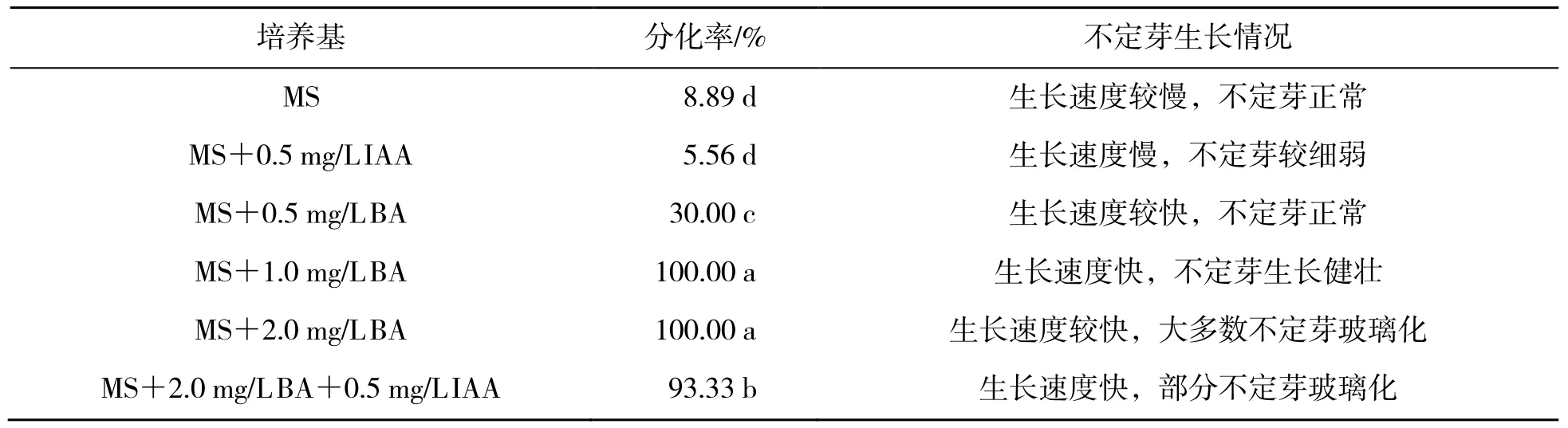
表2 番茄愈伤组织在不同培养基上的不定芽分化结果
2.3 番茄不定芽筛选压力的确定
在分化培养基中加入不同浓度的PEG-8000模拟渗透胁迫,经过30 d 培养后,部分愈伤组织可以分化出不定芽,在继续培养15 d 后,大量不定芽生长势减弱甚至死亡,只有少量的不定芽可以继续正常生长。试验结果见表3。
由表3 可知,当培养基中不添加PEG-8000时,分化出不定芽的数量和不定芽正常生长率显著高于添加了PEG-8000 的处理,说明PEG-8000能产生明显的胁迫作用;在培养基中添加一定质量分数的PEG-8000 后,随着培养基中PEG-8000质量分数升高,愈伤组织分化出的不定芽数量逐渐减少;当PEG-8000 质量分数为1%时,分化不定芽的数量与不添加PEG-8000 时没有显著差异,但在继续培养一段时间后正常生长率仅为1.23%,说明在此条件下的筛选效果不理想;但当培养基中PEG-8000 质量分数为7%时,培养初期,部分愈伤组织可再生出芽点,但随着培养时间的增长,芽点逐渐死亡,30 d 时,在7% PEG-8000 质量分数条件下不定芽正常生长率仅为 11.11%,在9%PEG-8000 条件下则无不定芽分化,说明高质量分数PEG-8000 产生的胁迫效果过强,使得不定芽不能正常分化,起不到筛选的作用;PEG-8000 质量分数为3%时,不定芽的平均数量达到21 个,但是正常生长率仅有3.18%,绝大多数不定芽生长势较弱,可见此浓度条件下筛选效果并不理想;当在培养基中加入5%的PEG-8000 时,正常生长的不定芽较多,且不定芽的正常生长率显著高于其他质量分数,证明此质量分数条件下的筛选效果比较理想。将逆境条件下分化得到正常生长的不定芽转接至添加了5% PEG-8000的MS培养基中继代培养,在继代培养过程中,幼苗能正常生长且没有出现渗透胁迫下叶片卷曲的现象,可见筛选获得的幼苗具有一定的抗逆性。筛选获得的幼苗在基因层面的改变有待进一步试验检测。

表3 不同PEG-8000 质量分数下番茄不定芽生长比较
3 讨论
外源激素的种类和浓度是影响愈伤组织再生的关键因素。有研究表明,不同激素组合及其质量浓度对诱导番茄愈伤组织形态和不定芽分化存在很大差异[16]。一般来说,具有再生能力的愈伤组织其内部已形成不定芽原基或胚性结构,此时无外源激素作用下也能再生。本试验中,在未添加外源激素的MS 培养基中,番茄愈伤组织先产生不定根,培养后期才出现少量不定芽,愈伤组织分化率低,可能是因为愈伤组织内源生长素含量较高,抑制了芽的分化。在培养基中加入1.0 mg/L BA 时,可有效提高愈伤组织分化率,且愈伤组织产生不定根的现象得以缓解。但分裂素质量浓度过高,也会抑制愈伤组织分化和不定芽生长,甚至出现玻璃化现象。本试验中当BA 添加量达到2.0 mg/L 时,多数不定芽玻璃化。这与一些表明诱导芽分化最适BA质量浓度为2.0 mg/L的研究结果不同[17],可能是由于番茄愈伤组织中内源激素的水平不同造成。赵燕等[18]认为IAA 和BA 结合使用会提高番茄外植体的再生频率。而本试验采用2.0 mg/L BA 和0.5 mg/L IAA 诱导愈伤组织分化效果不理想,这可能与番茄基因型、外植体生理状态等有关。
体细胞无性系变异广泛存在于植物离体培养过程中,培养基中的外源激素、培养环境等均有可能导致体细胞无性系变异的发生。利用体细胞无性系变异进行突变体筛选,通过在培养基中加入一定的选择压力以定向选择,从而有目的地筛选到特定的突变细胞系[19]。有研究表明,离体筛选的突变株与田间植株的抗性有一定的相关性[20],例如除草剂耐受性、对生物和非生物胁迫的抗性等。张建华等[8]用NaCl 进行直接高盐胁迫来筛选番茄耐盐体细胞变异体,最终得到了在盐胁迫培养基中芽体的生根率、鲜重及干重均显著高于原始株的耐盐植株,在150 mmol/L NaCl 的盐胁迫下,其幼苗的成活率可达66%。李永灿[21]以灰霉菌粗毒素为选择剂直接对番茄愈伤组织进行离体筛选,获得了对灰霉病抗性较强的再生植株。以上研究表明,使用选择剂直接对愈伤组织进行离体筛选也是一种获取抗性突变体的可行方法。本研究通过在培养基中附加质量分数5%的PEG-8000,增加培养基渗透压,给番茄愈伤组织再生创造渗透胁迫条件。在逆境环境下进行再生,使分裂旺盛或适应逆境的细胞表达胚性从而再生出植株[22]。最后,根据分化出不定芽的生长表现进行初步选择,以获得在渗透胁迫下仍能正常生长的抗逆性再生植株。综上所述,本试验通过对番茄愈伤组织突变细胞进行定向筛选获取了抗逆性再生植株,可为植物抗性育种提供参考。

