奥拉帕利联合TP化疗方案对晚期卵巢癌患者血清血管形成因子和细胞凋亡因子的影响
蔡志芳,沈晓青,王 丽
复旦大学附属妇产科医院妇科,上海 200090
卵巢癌发病率在女性生殖系统肿瘤中位于第3位,且该病的病死率较高[1]。由于缺乏早期诊断和筛查的方法,早期卵巢癌不易被发现,手术切除是早期卵巢癌的治愈方法,但大多数卵巢癌在确诊时已经属于晚期,肿瘤已经广泛种植和转移,失去手术机会[1]。目前一线的化疗药物治疗晚期卵巢癌具有较好的疗效,常用的一线方案为TP方案(紫杉醇+顺铂),但治疗后仍有70%以上的患者出现病情进展,需要进一步治疗[2]。因此,晚期卵巢癌的治疗仍是需要临床突破的瓶颈,寻找一种安全、有效和易行的方法,仍是临床需要解决的问题。奥拉帕利是一种新型卵巢癌的靶向药物,其主要机制是抑制多聚二磷酸腺苷核糖聚合酶的作用,抑制肿瘤细胞的增殖[3]。本研究采用奥拉帕利联合TP化疗方案治疗晚期卵巢癌取得了较好的疗效,现报道如下。
1 资料与方法
1.1一般资料 选择2018年1月至2020年12月本院收治的晚期卵巢癌患者90例为研究对象,根据随机数字表法,将患者分为观察组和对照组,每组45例。所有患者均签署知情同意书,本研究经医院伦理委员会审核通过。观察组年龄29~78岁,平均(49.95±12.28)岁;病程1~5年,平均(2.91±1.43)年;临床分期Ⅲ期12例,Ⅳ期33例;病理分型:透明细胞癌4例,子宫内膜癌6例,黏液性腺癌13例和浆液性腺癌22例。对照组年龄29~71岁,平均(49.60±11.78)岁;病程1~5年,平均(3.02±1.36)年;临床分期Ⅲ期13例,Ⅳ期32例;病例分型:透明细胞癌5例,子宫内膜癌7例,黏液性腺癌12例和浆液性腺癌21例。纳入标准:均符合晚期卵巢癌的诊断,经病理确诊;卡氏评分(KPS)>60分;预计生存时间超过6个月;可以耐受化疗。排除标准:在1个月内接受过手术、化疗和放疗;有化疗和靶向治疗的禁忌证;合并有其他部位的恶性肿瘤;孕妇和妊娠期患者;血液性和免疫性疾病;心、肝、肾等重要脏器功能障碍。两组年龄、病程和临床分期等资料比较,差异无统计学意义(P>0.05),具有可比性。
1.2方法
1.2.1治疗方法 两组患者入院后检测血常规、肝肾功能和心电图等,若无明显化疗禁忌证,对照组采用TP化疗方案,观察组在对照组的基础上予以奥拉帕利治疗。两组化疗前1 d静脉滴注2 000~3 000 mL液体进行水化处理。化疗前予以奥美拉唑、地塞米松和苯海拉明预防不良反应的发生。
TP方案:紫杉醇注射液 150 mg/m2静脉注射,顺铂50 mg/m2加入生理盐水500 mL中静脉滴注,每个周期第1天治疗,21 d为1个治疗周期,治疗6个周期结束。
观察组在对照组基础上予以奥拉帕利片300 mg,每天两次,第1~10天治疗,服药期间出现不良反应将药物减少至150 mg口服,每天两次,若患者出现不能耐受的不良反应,即可终止口服,并予以对症治疗。
1.2.2疗效评价 疗程结束后根据实体瘤的疗效评价标准(RECIST)进行疗效评价:病灶完全消失为完全缓解(CR);病灶缩小>30%为部分缓解(PR);病灶缩小≤30%或者增加≤20%为疾病稳定(SD);病灶增加>20%为疾病进展(PD)。总有效率=(CR例数+PR例数+SD例数)/总病例数×100%。
1.2.3血液标本采集和指标的检测 患者第1次化疗前和化疗6个疗程后抽取肘静脉血约 5 mL,离心后,将血浆放置在-80 ℃的冰箱中待检测。人附睾蛋白4(HE4)、转铁蛋白(SF)、糖类抗原(CA)125和CA199采用电化学发光法检测;基质细胞衍生因子-1α(SDF-1α)、基质金属蛋白酶-9(MMP-9)、血管生成素-2(Ang-2)、B淋巴细胞瘤-2(Bcl-2)、Bcl-2相关X蛋白(Bax)、可溶性细胞凋亡因子(sFas)和Bcl-2 结合抗凋亡基因-1(Bag-1)采用酶联免疫法测定。
1.3观察指标 观察两组治疗后的疗效及不良反应,两组治疗前后血清HE4、SF、CA125、CA199、SDF-1α、MMP-9、Ang-2、Bax、sFas、Bcl-2和Bag-1水平的变化。

2 结 果
2.1两组近期疗效的比较 观察组的总有效率为80.00%(36/45),对照组的总有效率为57.78%(26/45),观察组的疗效明显优于对照组(χ2=4.199,P<0.05)。见表1。
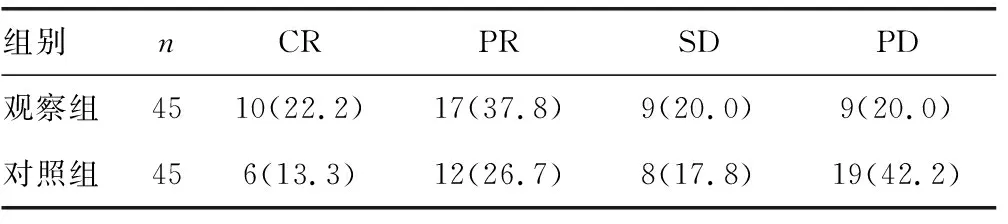
表1 两组疗效的比较[n(%)]
2.2两组治疗前后肿瘤相关指标的比较 治疗前两组血清HE4、SF、CA125和CA199水平差异无统计学意义(P>0.05);治疗后两组各指标水平均较治疗前明显降低(P<0.05);治疗后观察组各指标水平低于对照组(P<0.05)。见表2。

表2 两组治疗前后肿瘤相关指标的比较
2.3两组治疗前后血清SDF-1α、MMP-9和Ang-2水平的变化 两组治疗前血清SDF-1α、MMP-9和Ang-2水平差异无统计学意义(P>0.05),治疗后两组各指标水平均较治疗前明显降低(P<0.05);治疗后观察组各指标水平低于对照组(P<0.05)。见表3。

表3 两组治疗前后血清SDF-1α、MMP-9和Ang-2水平的变化
2.4两组治疗前后血清Bax、sFas、Bcl-2和Bag-1水平的变化 两组治疗前血清Bax、sFas、Bcl-2和Bag-1水平差异无统计学意义(P>0.05);治疗后观察组血清Bax水平较对照组明显升高(P<0.05),血清sFas、Bcl-2和Bag-1水平较对照组明显降低(P<0.05)。见表4。

表4 两组治疗前后血清Bax、sFas、Bcl-2和Bag-1水平的变化
2.5两组不良反应发生情况的比较 两组治疗后骨髓抑制、胃肠道反应、肝功能损伤、肾功能损伤和心脏不良反应发生率差异无统计学意义(P>0.05)。见表5。
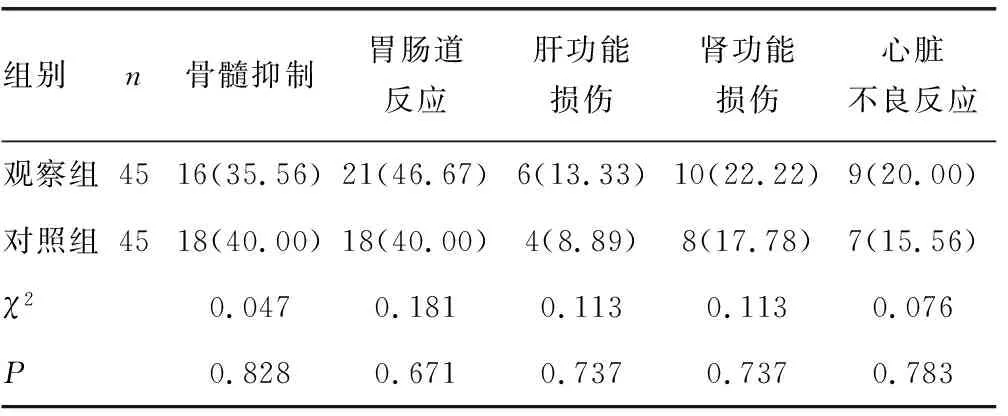
表5 两组不良反应发生情况的比较[n(%)]
3 讨 论
卵巢癌是一种异质性较高的恶性肿瘤,具有恶性程度高、治疗困难和预后差等特点,其病死率位居女性恶性肿瘤之首,晚期卵巢癌的5年生存率低于30%[4]。卵巢癌由于发生部位较深,早期缺乏典型的症状,影像学筛查的手段效果并不理想,多数患者在确诊时病情已经属于晚期,无法手术治疗,使得化疗成为其主要的治疗手段。目前,晚期卵巢癌的一线化疗方案是TP(紫杉醇+顺铂)和TC(紫杉醇+卡铂)等,虽然具有一定的疗效,但长时间使用常出现耐药。近年来,学者们尝试采用靶向药物联合化疗方案对卵巢癌进行治疗,以提高化疗药物的疗效[4]。奥拉帕利为聚腺苷二磷酸核糖聚合酶(PARP)抑制剂,应用到卵巢癌的治疗中可以使疗效得到质的提升,并且能够明显提高肿瘤细胞对铂类化疗药物的敏感性,从而达到延长肿瘤的生存期和改善预后的目的[5]。本研究显示,奥拉帕利联合TP方案治疗晚期卵巢癌患者的疗效明显优于单纯TP方案化疗,并不增加患者的不良反应发生率,可明显降低HE4、SF、CA125和CA199水平,说明奥拉帕利能够提高晚期卵巢癌的疗效,表现为肿瘤指标水平降低。现已知奥拉帕利是PARP的抑制剂,可以阻断DNA单链的修复从而达到抑制肿瘤细胞增殖和转移的目的[6],提高肿瘤患者的临床疗效和减少肿瘤复发的可能。
肿瘤血管形成在卵巢癌的病理生理过程中具有重要作用,肿瘤血管的形成是一个非常复杂的过程,大致有以下3个步骤[7]:血管内皮细胞出现增殖和迁移,血管外周围细胞基质的降解和毛细血管的分化吻合。SDF-1α主要由骨髓基质细胞和内皮细胞分泌,能够促进肿瘤细胞活动能力,参与了肿瘤细胞的存活和生长,对肿瘤血管形成具有促进作用[8]。SDF-1α与其相应受体结合后,参与了血管生成过程,同时MMP-9通过降解血管的基底膜,促进血管内皮细胞迁移,促进肿瘤细胞和内皮细胞FⅧ的表达[9]。Ang-2由内皮细胞和内皮旁细胞分泌,通过刺激内皮祖细胞的增殖,对新生血管生成具有促进作用[10]。Ang-2在血管内皮生长因子的作用下产生血管生成诱导信号,使肿瘤组织内新生血管持续生成,其水平升高与肿瘤微血管形成、肿瘤分期和预后具有明显的相关性[11]。本研究发现,奥拉帕利联合TP方案治疗晚期卵巢癌,降低了血清SDF-1α、MMP-9和Ang-2水平,较单纯TP方案更为明显,说明奥拉帕利抑制卵巢癌可能与降低晚期卵巢癌患者血清SDF-1α、MMP-9和Ang-2水平有关,其机制可能与奥拉帕利抑制晚期卵巢癌血管生成有关。
Bcl-2家族是线粒体凋亡途径的重要组成部分,主要有两类基因组成[12-13]:一类为抑制凋亡基因,如Bcl-2,其表达的升高能够明显延长肿瘤的增殖和存活时间,抑制肿瘤细胞的凋亡。Bcl-2能够通过将谷胱甘肽聚集在细胞核内,从而引起细胞内的氧化还原过程出现失衡,最终降低Caspase的活性,从而抑制肿瘤细胞的凋亡。另一类是促凋亡基因,如Bax,具有对抗Bcl-2引起的细胞凋亡作用,同时是Caspase-3活性的调节因子,可以通过激活Caspase-3活性,从而促进细胞凋亡的发生,同时Bcl-2与Bax结合后可能减弱Bax的促进凋亡作用,从而抑制凋亡的发生,因此认为Bcl-2与Bax平衡对凋亡具有明显的调控作用。本研究显示,与单纯TP方案比较,奥拉帕利联合TP方案治疗晚期卵巢癌能够明显降低Bcl-2水平,升高Bax水平,说明奥拉帕利抑制晚期卵巢癌可能与改变Bcl-2和Bax平衡具有明显关系。在细胞凋亡中,Fas与其受体结合是介导受体凋亡途径的关键分子,肿瘤细胞的增殖是由于受体介导的凋亡途径受阻,导致肿瘤细胞持续增殖引起病情的恶化[14]。sFas是Fas的可溶性形式,主要功能是与受体结合后拮抗Fas介导的受体凋亡通路,在恶性肿瘤中Fas表达明显降低,而sFas表达明显升高[15]。本研究与单纯TP方案比较,奥拉帕利联合TP方案治疗晚期卵巢癌后血清sFas出现明显降低,说明奥拉帕利能够明显降低晚期卵巢癌患者血清sFas水平。Bag-1属于抗凋亡蛋白成员,染色体定位于9p12,是一种多功能蛋白,可以与Bcl-2结合形成复合物,具有协同Bcl-2抑制肿瘤细胞的凋亡作用[16],同时Bag-1还可以通过其他途径引起细胞凋亡[17]。与单纯TP方案治疗比较,奥拉帕利联合TP方案治疗晚期卵巢癌能够明显降低血清Bag-1水平,说明奥拉帕利通过降低晚期卵巢癌患者血清Bag-1水平,促进肿瘤细胞的凋亡,从而达到提高疗效的目的。
综上所述,奥拉帕利联合TP化疗方案治疗晚期卵巢癌的疗效显著,与抑制血管形成,促进细胞的凋亡有关。

