度拉糖肽药物警戒信号的挖掘与评价
吴遵平,吴利利
0 引言
我国是目前全世界糖尿病患病人数最多的国家[1],糖尿病已成为现阶段国家重点干预的4种慢性病之一。近年来,胰高血糖素样肽-1(Glucagon-like peptide 1 receptor agonist,GLP-1)受体激动剂在国内外各指南降糖药物治疗中的地位逐渐提升[2]。继艾塞那肽、利拉鲁肽之后,2014年美国食品药品监督管理局(FDA)批准度拉糖肽(Dulaglutide)用于治疗成人2型糖尿病。2019年国家食品药品监督管理总局(CFDA)批准度拉糖肽在国内上市,2020年国家医疗保障局通过谈判促使度拉糖肽大幅降价,并进入医保报销目录。该药具有与人类同源性高、免疫源性低[3]、半衰期超长、注射简单方便、患者用药依从性高和肝肾功能不全无需调整剂量的优点。目前研究发现,度拉糖肽除具有降糖作用外,还有减轻体重、降压、心血管保护和肾脏保护作用[4-6],具有广阔的临床应用前景。但其上市时间不足5年,且患者需要终身使用,当前药物安全性数据较少,因此,加强新药上市后的安全性监测与评价具有重要意义。
数据挖掘技术目前被逐渐应用于药物不良反应监测领域,可发掘出新的、罕见、严重的药品不良反应信号,为评估药物风险提供参考。本研究拟利用美国FDA不良事件报告系统(FDA adverse event reporting system,FAERS)的公共数据,探索度拉糖肽可疑的ADR信号,并分析其危险因素,旨在为临床合理使用度拉糖肽提供依据。
1 资料与方法
1.1 数据来源与处理 FAERS为全球免费公开的数据库,由各个国家的医生、药师、厂商等自愿呈报,数据量大,信息丰富,每季度更新一次,现FDA广泛用于药品上市后安全性监测和再评价的重要信息来源。度拉糖肽为2014年上市,故本研究提取2014年第1季度至2021年第2季度的数据,剔除非药物及重复报告,获得药物ADR报告总数。然后以度拉糖肽通用名“Dulaglutide”为关键词,筛选首要怀疑药物(Primary suspect,PS)作为度拉糖肽报告的分析对象。合并相同首选术语(Preferred term,PT)的报告,不良事件分类描述按照MedDRA系统器官分类(System organ class,SOC)[7]。
1.2 数据挖掘
1.2.1 检测方法 本研究利用国内外广泛使用的比值失衡分析法进行数据挖掘[8]。目前有4种方法:频数法包括报告比值法(Reporting odds ratio,ROR)和比例报告比(Proportional reporting ratio,PRR),贝叶斯法包括贝叶斯可信区间递进神经网络法(Bayesian confidence propagation neural network,BCPNN)和伽马泊松缩减法(The gamma poisson shrinker,GPS)。频数法计算简单,灵敏度高,但特异度低[9]。贝叶斯法计算复杂,灵敏度一般,但特异度高,信号稳定[10]。为了尽量降低单独使用一种算法引起的结果偏倚,本论文采用ROR和BCPNN 2种方法相结合,形成互补,对度拉糖肽进行ADR信号挖掘及评价,计算方法见表1。ROR法以报告例数≥3、ROR的 95%置信区间(Confidence interval,CI)下限>1为检出信号;BCPNN法以报告例数≥3,信息成分(Information component,IC)的95%CI下限>0 为检出信号。当2种算法均呈阳性,则判断为可疑ADR信号。

表1 2种检测方法的计算公式
1.2.2 分析方法 结合本次ADR信号挖掘结果,统计和整理ADR信号对应的患者数据,以其性别、年龄、用药剂量作为影响因素(排除信息不完整的报告),利用SPSS 23.0软件进行χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 ROR和BCPNN法信号挖掘结果 经过数据清洗,2014年第1季度至2021年第2季度共纳入分析5 729 311份ADR报告,其中25 523份为首要怀疑度拉糖肽的ADR报告。最终使用ROR和BCPNN法同时挖掘出95个可疑的度拉糖肽安全警戒信号。2种检测方法信号强度排名前50位PT及ADR频数结果见表2。从表2可见,2种方法排名前50位的PT重合度达84%,一致性良好。

表2 度拉糖肽信号强度排名前50位PT及ADR频数
2.2 ADR信号SOC分类结果及与说明书对比 将上述95个信号按MedDRA累及系统/器官进行分类,度拉糖肽相关的ADR信号共涉及11个系统分类,见表3。其中胃肠系统ADR频数占比最高,其次是给药部位各种反应和代谢及营养类疾病。说明书中未提及的新的ADR信号有26个,也集中在胃肠系统。
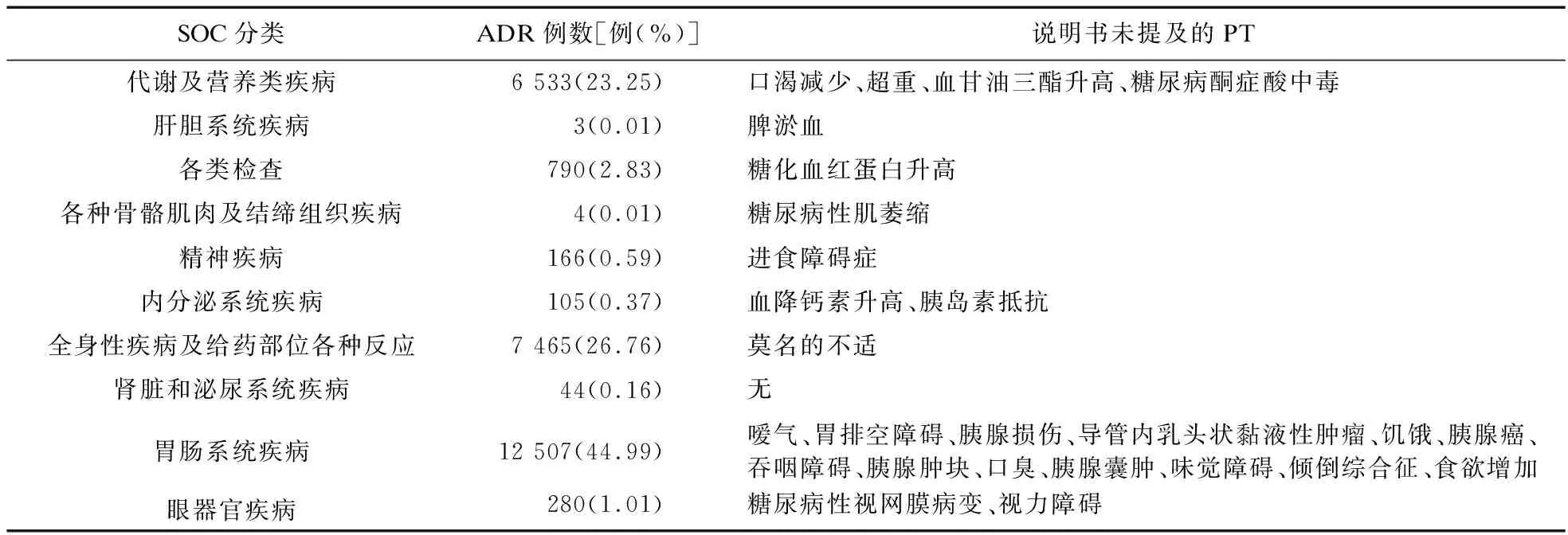
表3 度拉糖肽安全警戒信号累及系统/器官
2.3 胃肠系统ADR单因素分析结果 胃肠系统ADR信号强,报告数最多,本研究重点分析度拉糖肽相关的胃肠系统ADR的影响因素。排除其中任一信息不完整的报告,共纳入5 860例。卡方检验结果如表4所示,患者年龄、性别和给药剂量对胃肠系统ADR的影响均有统计学意义(P<0.05)。进一步分析发现,使用度拉糖肽后,发生胃肠ADR的女性多于男性,年龄以60岁以上居多,给药剂量多为0.75 mg/周。

表4 度拉糖肽ADR影响因素比较结果
2.4 度拉糖肽致严重ADR情况 度拉糖肽致严重ADR的报告共计2 065例,占比8.09%,以导致住院或住院时间延长最多,293例(14.18%)患者最终死亡。见表5。
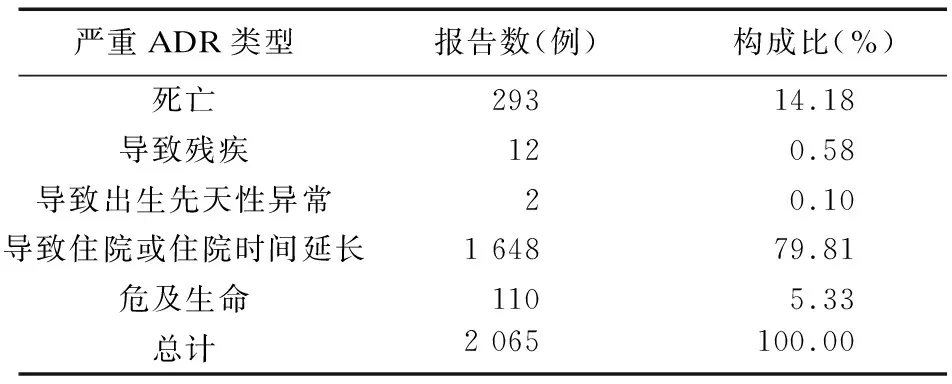
表5 度拉糖肽致严重ADR汇总
3 讨论
我国《药品不良反应监测管理办法》规定,进口药品自首次在国内上市5年内,应监测该药可能引起的所有可疑ADR。度拉糖肽在国内于2019年上市,持续监测其ADR信号,有助于识别和评估药品风险及潜在危害。
3.1 常见ADR信号评价 度拉糖肽ADR累及系统/器官中,ADR报告频次和信号数量最多的是胃肠系统,与药品说明书描述一致,胃肠道反应是其最常见的不良反应。本次的挖掘结果显示,嗳气、胃排空障碍、吞咽障碍、口臭、味觉障碍、倾倒综合征等信号在说明书中未提及,提醒临床如果11患者使用度拉糖肽期间出现类似反应,可及时采取干预措施。而胰腺损伤、导管内乳头状黏液性肿瘤、胰腺癌、胰腺肿块等胰腺相关ADR信号,说明书中也未描述,目前并没有直接证据表明GLP-1与人类胰腺炎、胰腺癌之间存在因果关系[11]。最近两项荟萃分析均未发现GLP-1可增加胰腺相关疾病风险的证据[12]。出于临床用药安全的考虑,如果怀疑发生了胰腺相关疾病,应立即停用度拉糖肽。
此外,性别、年龄和给药剂量均是引起胃肠系统ADR的显著影响因素,女性的发生率高于男性,年龄多在60岁以上,给药剂量以0.75 mg/周居多。分析可能与60岁以上的老年人群糖尿病患病率逐年上升有关[13];另有研究者发现,患者在使用度拉糖肽后,胃肠道反应的发生率与给药剂量呈正相关[14]。因此,在度拉糖肽临床应用过程中,中老年女性患者更应关注胃肠系统ADR的发生情况,小剂量起始可能改善患者的胃肠道反应。
度拉糖肽注射笔是隐形针头,无需安装、自动注射、操作容易,无需处理针头,可减少患者注射部位不适感[15]。但本研究仍挖掘到24个注射部位ADR信号,强度较高。发生注射部位反应可能与患者注射技术和注射部位等有关[16],建议可通过更换注射部位、指导患者正确使用度拉糖肽注射装置来减少该类不良反应的发生。
3.2 其他说明书中未提及ADR信号分析 在代谢及营养类系统方面,口渴减少、超重、血三酰甘油升高、糖尿病酮症酸中毒未在说明书中描述。2019年6月英国警示GLP-1受体激动剂与胰岛素联用致糖尿病酮症酸中毒风险,文中提及已有与度拉糖肽相关的严重且危及生命的糖尿病酮症酸中毒病例报告。因此,建议当启动度拉糖肽治疗且减少胰岛素剂量时,推荐采用阶梯式方法,患者必须自我监测血糖,以防血糖控制不佳。临床已证实度拉糖肽可减轻体重,可降低三酰甘油[17],因此超重和血三酰甘油升高可能为假阳性信号。
糖尿病性视网膜病变和视力障碍也是新的ADR信号,目前无度拉糖肽致眼部疾病的文献评估。研究者发现糖化血红蛋白的迅速降低与糖尿病性视网膜病变的早期恶化有关[18],因此,相关指南建议所有2型糖尿病患者,每1~2年进行1次眼科检查。
甲状腺疾病相关ADR信号血降钙素升高,说明书中也未提及,目前并无大量循证医学证据表明度拉糖肽与甲状腺疾病有显著关系[19],使用该药过程中可监测患者血降钙素水平,必要时复查甲状腺彩超。其他新的安全警戒信号如脾淤血、糖尿病性肌萎缩、进食障碍症等,未有临床研究报道,临床应用中应引起高度关注,并需要进一步长期临床验证。
4 小结
本研究基于FAERS真实世界数据填补了度拉糖肽安全警戒信号研究的空白,对挖掘出的ADR信号进行系统的分析评价,为其临床安全用药提供一定参考依据。随着度拉糖肽药品费用下降,其可及性增加,有关其不良反应报道也逐渐增多。本研究发现度拉糖肽致严重ADR占比达8.09%。由此可见,临床应引起高度重视,持续做好度拉糖肽上市后的药品再评价。

