对比G-CSF及阿托伐他汀干预对毛细血管及肾间质纤维化的影响及其机制
杨晓晶 白海涛 庄良金
(厦门大学附属第一医院 1质量管理部,福建 厦门 361003;2儿科)
肾间质纤维化是慢性肾脏疾病发展为终末期肾衰竭的中间过程,既往对肾间质纤维化形成过程的研究主要集中在肾小管上皮细胞凋亡、肾间质炎细胞浸润,纤维化因子释放、细胞外基质的生成增多等方面〔1,2〕,而缺乏对肾小管周围毛细血管的研究。研究显示,多种慢性肾脏病伴有不同程度的肾小管周围毛细血管丢失,提示肾小管周围毛细血管的丢失可能是肾间质纤维化的重要因素之一〔3,4〕。粒细胞集落刺激因子(G-CSF)〔5〕和他汀类药物〔6〕均为有效的干细胞动员剂,能动员骨髓内皮祖细胞,提高外周血内皮祖细胞数量。G-CSF是临床经典的干细胞动员剂,其安全性和有效性已被临床所证实〔7,8〕。本研究探讨G-CSF和阿托伐他汀干预对毛细血管和肾间质纤维化的作用。
1 材料与方法
1.1试验动物 选取雄性SD大鼠160只,6周龄,体重200~220 g,购自河北医科大学动物实验中心,适应性喂养1 w,随机分为假手术组、模型组、G-CSF组和阿托伐他汀组,每组40只,分别于造模后1、2、3和4 w随机抽取处死10只大鼠进行研究。
1.2实验方法
1.2.1造模及干预 ①假手术组:仅经右下腹切口,分离右侧输尿管,不结扎。②模型组:经右下腹切口,分离右侧输尿管,在肾输尿管移行处分两处结扎输尿管,然后从中间剪断输尿管,模型组及假手术组每天给予生理盐水 1 ml 灌胃。③G-CSF 组:结扎右侧输尿管并皮下注射 G-CSF 50 μg/(kg·d)。④阿托伐他汀组:结扎右侧输尿管并阿托伐他汀5 mg/(kg·d)灌胃给药。饲养于隔离环境中,普通喂养,食物和水经消毒处理,每日12 h光照,温度 23~26℃、湿度 50%~60%。造模后1、2、3和4 w将以上小鼠颈椎脱臼处死固定在固定平板上,打开腹腔,剪取右侧肾脏,放入生理盐水中漂洗以去除血迹和游离脂肪组织等。迅速放入 10%甲醛溶液中固定。
1.2.2肾脏组织Masson染色法 制作常规石蜡切片,进行脱水、脱蜡等步骤,于丽春红染液、2%冰醋酸、5%磷钼酸水溶液中分别染色2 min,再于甲基绿中染色3 min,用清水冲洗。然后进行梯度酒精脱水、二甲苯透明等过程,最后用中性树胶密封,在高功率(×200)下,选择15个没有肾小球和血管的肾皮质视野。以胶原纤维阳性染色程度对肾间质纤维化进行评分:0分:正常;1分:染色面积≤25%;2分:染色面积26%~50%;3分,染色面积51%~75%;4分,染色面积>75%。
1.2.3CD34+细胞免疫组化染色法 使用免疫组织化学染色对石蜡切片进行抗原修复,加入一抗并在4℃条件下孵育,二抗则在37℃条件下孵育30 min,并使用二氨基联苯胺(DAB)底物显色。微血管内皮细胞中CD34+在显微镜下显示棕褐色。任何一个棕褐色的内皮细胞或内皮细胞簇作为一条微血管,分支结构也作为一条血管计数(除外大血管),在显微镜下随机选择5个视野,计数阳性的毛细血管腔个数,得出PTC密度(个/mm2)取平均值。
1.2.4细胞间黏附分子(ICAM)-1、结缔组织生长因子(CTGF)免疫组化染色法 组织石蜡切片按照SP法试剂盒(福州麦新生物技术有限公司)的说明书进行操作。山羊抗大鼠CTGF和ICAM-1多克隆抗体,在室温下孵育1 h,洗涤3次,再加入兔抗山羊单克隆抗体(北京雅发生物制品有限公司),在室温下孵育15 min,DAB显色 2~5 min,苏木素复染,脱水封片,肾组织CTGF和ICAM-1 的免疫组织化学半定量分析采用HPIAS2000型图像分析软件(同济千屏影像工程公司研制),分析方法为每个标本在放大200倍图像的肾皮质区依次选取 40个视野,染色阳性部位的深浅及范围以平均光密度表示。
1.3统计学处理 采用SPSS22.0软件行方差分析。
2 结 果
2.1各组肾小管周围毛细血管密度比较 模型组、G-CSF组和阿托伐他汀组造模后2 w、3 w和4 w肾小管周围毛细血管密度显著低于假手术组(P<0.05),其中G-CSF组和阿托伐他汀组造模后2 w、3 w和4 w肾小管周围毛细血管密度显著高于模型组(P<0.05)。见表1。免疫组化染色棕褐色为CD34阳性细胞,假手术组PTC密度丰富,分布均匀,形态大致规则。模型组、G-CSF组和阿托伐他汀组PTC病变呈局灶性分布且PTC密度降低,模型组明显低于G-CSF组和阿托伐他汀组。见图1。
2.2各组肾间质纤维化评分比较 模型组、G-CSF组和阿托伐他汀组造模后1 w、2 w、3 w和4 w肾间质纤维化评分显著高于假手术组(P<0.05),其中G-CSF组和阿托伐他汀组造模后2 w、3 w和4 w肾间质纤维化评分显著低于模型组(P<0.05)。见表1。Masson染色可将肾小球间质胶原纤维、网状纤维染成蓝色,蓝染范围越多,颜色越深,则表明肾间质纤维化越严重。假手术组肾组织形态正常,模型组和G-CSF组、阿托伐他汀组可见肾小管扩张,肾间质纤维化,间质蓝染明显增多,模型组明显多于G-CSF组、阿托伐他汀组。见图2。
2.3各组肾间质ICAM-1、CTGF表达比较 模型组、G-CSF组和阿托伐他汀组造模后2 w、3 w和4 w肾间质ICAM-1、CTGF表达光密度值显著高于假手术组(P<0.05),其中G-CSF组和阿托伐他汀组造模后2 w、3 w和4 w肾间质ICAM-1、CTGF表达光密度值显著低于模型组(P<0.05)。见表2。
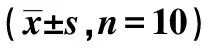
表1 各组造模不同时间肾小管周围毛细血管密度及肾间质纤维化评分比较
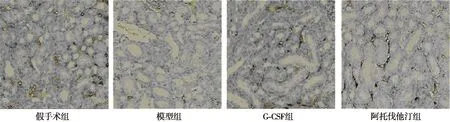
图1 各组造模后4 w肾脏病理切片CD34+(免疫组化染色,×100)
图2 各组造模后4 w肾脏病理切片(Masson染色,×200)
表2 各组造模不同时间肾间质ICAM-1、CTGF表达光密度值比较
3 讨 论
肾小管间质纤维化是由多种病因引起的慢性肾脏疾病发展为终末期肾脏疾病的最后一条途径。肾功能的恶化在很大程度上取决于肾小管间质纤维化程度〔9〕。肾小管周围毛细血管主要由内皮细胞和基底膜构成,其间散在扁而有突起的周细胞。内皮细胞损伤和功能障碍是肾小管周围毛细血管丢失的主要原因。研究显示维持内皮细胞的正常生理功能对毛细血管的结构和功能完整起重要作用,骨髓来源的内皮祖细胞能通过自身分裂增殖、分化为内皮细胞及旁分泌效应参与血管修复及新生〔10〕。
G-CSF是临床经典的干细胞动员剂,其安全性和有效性已被临床所证实〔11〕。他汀类药物是胆固醇合成中的限速酶,能够抑制肝脏胆固醇生成途径来减少脂质合成。国内外诸多研究表明〔12〕,他汀类药物具有降脂作用、促新生血管生成、抗心律失常、动员内皮祖细胞等作用。有研究〔13〕显示阿托伐他汀能够明显增加内皮祖细胞集落形成数目。
作为一种跨膜糖蛋白,CD34在毛细血管和小血管内皮细胞中的表达维持稳定状态是反映血管内皮细胞状态的标记物〔14〕。CD34数量能够反映肾小管周围的毛细血管密度,本研究中,内皮细胞用CD34染色标记被染成棕黄色。G-CSF动员了内皮祖细胞进而加速了血管新生过程。有研究显示:干细胞因子能够动员干细胞归巢,有助于减少肾小管周围毛细血管丢失。内皮祖细胞能够通过自身的分化增殖促进新生血管的生成;还可以通过旁分泌效应使血管内皮细胞发生增殖。阿托伐他汀为3-羟-3-甲基戊二酰辅酶 A还原酶抑制剂,其能促进受损冠状动脉和外周小动脉内皮化,他汀类药物的这一效应不依赖它的降胆固醇效应,他汀类药物促进血管新生可能是通过动员内皮祖细胞,并促进内皮祖细胞的增殖和分化。也可能是G-CSF和阿托伐他激活了磷脂酰肌醇-3激酶(PI3K)/蛋白激酶B(Akt)信号通路,该通路调节下游靶标因子并抑制内皮祖细胞凋亡,诱导内皮祖细胞增殖分化。
CTGF可促进细胞增殖,加速细胞外基质的生成,其在肾小球和肾小管周围表达〔15,16〕。黏附分子是一类糖蛋白,可介导细胞和细胞外基质黏附。 ICAM-1是跨膜单链糖蛋白,属于免疫球蛋白中的一种,其在内皮细胞中的表达能力最强〔17,18〕。肾组织单核细胞,特别是淋巴细胞和巨噬细胞的浸润,可对肾小管造成损害并引起间质成纤维细胞活化,最终导致肾小管间质纤维化。
G-CSF 和阿托伐他汀具有广泛的生物效应,有相似的生物活性,如动员骨髓内皮祖细胞,还能动员造血干细胞、中性粒细胞、单核细胞等,炎症细胞浸润可加剧微血管损伤及间质纤维化,集落刺激因子的炎症细胞动员作用是否会减弱其促进组织修复作用,目前尚缺乏进一步的研究。阿托伐他汀具有多种肾保护功能,除了降低血浆胆固醇外,它还可以改善内皮功能,抑制炎症反应和抗氧化活性,并可减少内皮细胞凋亡〔19〕,提高内皮一氧化氮合酶生物活性,调节促凝血活性和血小板功能,可促进微血管修复。
肾间质纤维化的发病机制还不是很明确。本研究从肾小管周围毛细血管密度的丢失和肾间质纤维化的进程方面探讨了他汀类药物及G-CSF的作用,将对临床改善肾小管周围毛细血管密度丢失和肾间质纤维提供理论依据。
综上, G-CSF及阿托伐他汀均能延缓单侧输尿管梗阻大鼠肾小管周围毛细血管密度丢失和肾间质纤维化进展,两者作用机制可能相同。

