FAdV-4感染对白羽肉鸡外周血细胞、血液生化指标和炎症因子的影响
黄瑞玲, 何 晴, 陆芍华, 严梦涵, 许丽惠, 王全溪, 黄翠琴, 黄其春[1.福建省兽医中药与动物保健重点实验室(福建农林大学),福建 福州 50002;2.中西兽医结合与动物保健福建省高等学校重点实验室,福建 福州 50002;.福建省家畜传染病与生物技术重点实验室,福建 龙岩 64012]
鸡感染Ⅰ群禽腺病毒4型(Fowladenovirusserotype 4, FAdV-4)后可引起肝炎—心包积液综合征(HHS)[1].1987年该病首次发生在巴基斯坦的安卡拉地区,随后在许多地区广泛流行起来[2-4].家禽易感染FAdV-4,急性感染后主要出现肌胃糜烂、包涵体肝炎和心包积液等症状.2015年以前,对鸡群危害较大的是感染FAdV-4导致的包涵体肝炎.在研究其致病机制的过程中发现,当FAdV-4感染机体细胞时,其纤维蛋白表面上的突起与细胞膜接触,然后进入细胞浆内进行蛋白的合成,随后病毒核酸转移至细胞核进行病毒的复制并装配成病毒粒子,当宿主细胞崩解时,新的病毒产生,故肝细胞核内常可见到病毒包涵体[1,5].目前,可以采取观察内包涵体、免疫荧光检测抗原等检测方法实现对禽腺病毒DNA的有效检测与鉴定[6].病毒分离鉴定、PCR反应及测序分析、琼脂扩散试验、病毒中和试验等病原学和血清学方法是FAdV-4鉴定及感染诊断的常用方法[7-9],然而对感染FAdV-4后病鸡外周血细胞、主要血液生化指标的研究并不丰富.近年来,该病则表现出更为严重的肝炎—心包积液综合征,并对全球养禽业造成巨大的经济损失,急需对该病的致病机制做进一步深入研究.
近年来,国内外对机体外周血炎症因子的探究已十分完善.如:孙培静等[10]研究表明,外周血免疫球蛋白E(IgE)、补体C3和C4的水平与肥胖型支气管哮喘患儿病情严重程度及肺功能呈正相关;詹奇等[11]研究表明,在机体感染丙型肝炎病毒(HCV)后的不同时期,都会提高外周血中白介素-2R(IL-2R)和γ-干扰素(IFN-γ)的水平;袁健生等[12]研究表明,感染红斑狼疮后,患者外周血中的免疫球蛋白A(IgA)、免疫球蛋白M(IgM)、免疫球蛋白G(IgG)、IFN-γ、肿瘤坏死因子-α(TNF-α)、白介素-4(IL-4)水平均提高.然而,FAdV-4感染后对机体外周血炎症因子的影响尚不明确,需进一步探明.
多种病毒感染后,对机体外周血中的免疫球蛋白、炎症因子和血细胞均有影响.禽腺病毒感染导致严重的心包炎和肝炎,其致病机制仍有许多需要进一步阐明.本研究主要从外周血角度,探究FAdV-4感染对鸡外周血细胞、主要血液生化指标和炎症因子的影响,旨在为FAdV-4致病机理的进一步研究提供参考.
1 材料与方法
1.1 材料
1.1.1 动物和病毒毒株 供试30只28日龄白羽肉鸡经PCR和酶联免疫吸附试验(ezyme linked immunosorbent assay, ELISA)检测为FAdV-4抗原、抗体双阴性.FAdV-4 NP株由本实验室分离鉴定并保存[13-14],其半数细胞培养物感染量(tissue culture infective dose, TCID50)=10-4.625·mL-1.
1.1.2 主要试剂 普通真空采血管、EDTA-K2真空采集管、头皮针等购自兰博利德有限公司;血常规检测试剂盒、血液生化检测盒、血液炎症因子ELISA检测试剂盒购自上海酶联生物技术有限公司;RNA提取试剂盒购自全式金生物技术有限公司;反转录试剂盒、SYBR荧光定量试剂盒购自Promega公司.
1.2 血液样品的制备
将30只供试鸡随机分为两组,每组3个重复,每个重复5只.试验开始时,试验组每只鸡肌肉注射0.5 mL FAdV-4 NP株病毒(TCID50=10-4.625·mL-1),对照组每只鸡肌肉注射等量的灭菌生理盐水.于感染3、6、12、24 h时,从每个重复中各取1只鸡,采集抗凝和非抗凝外周血.用分离血清后的非抗凝血检测血液生化指标和炎症因子;用抗凝血检测血细胞和病毒载量.
1.3 指标检测
1.3.1 病毒载量的检测 按照病毒RNA提取试剂盒说明书的步骤提取各组病毒RNA样本,按照RNA反转录试剂盒说明书的步骤进行反转录[15].合成的cDNA保存在-20 ℃.按照SYBR荧光定量试剂盒说明书的步骤进行荧光定量PCR扩增.反应体系20 μL:10 μL Mix,7.9 μL ddH2O,上、下游引物各0.6 μL,1.5 μL cDNA.qPCR的扩增条件为两步法:95 ℃ 1 min,95 ℃ 20 s,60 ℃ 1 min,72 ℃ 5 s,循环40次.以β-actin为内参基因,采用陈媛等[15]的方法计算基因表达量.引物由上海生工生物技术公司合成[13].引物信息如表1所示.

表1 荧光定量PCR相关引物序列
1.3.2 血细胞的检测 用抗凝血液检测血细胞,检测指标有白细胞数、红细胞数、血小板数.采用全自动血液细胞分析仪检测.
1.3.3 血液生化指标的检测 将普通真空采血管中的血液移至EP管中,待血液凝固后,于3 000 r·min-1离心10 min,吸取上清,弃去沉淀.用分离的血清检测血液生化指标,检测指标有血糖、甘油三酯、总蛋白等水平.采用全自动血液生化分析仪检测.
1.3.4 血液炎症因子的检测 检测的炎症因子有人高迁移率族蛋白B1(human high-mobility group box-1, HMGB1)、白介素-1β(interleukin-1β, IL-1β)、白介素-6(interleukin-6, IL-6)、组胺、缓激肽、P物质等水平.按照TransZol Up Plus RNA试剂盒说明书的步骤提取血液总RNA,按照GoScriptTMReverse反转录试剂盒说明书的步骤将RNA反转录成cDNA,采用RT-qPCR检测炎症因子的水平[13,15].
1.4 数据处理
试验数据采用SPSS 19.0软件进行独立样本t检验,结果以“平均值±标准差”表示,P<0.05表示差异显著.
2 结果与分析
2.1 FAdV4感染对鸡外周血细胞病毒载量的影响
3~24 h时,被FAdV-4感染的时间越长,鸡外周血细胞病毒载量越高,二者呈正相关(图1).

图1 FAdV-4感染对鸡外周血细胞病毒载量的影响
2.2 FAdV-4感染对鸡外周血细胞的影响
图2显示,与未攻毒组相比,随着被FAdV-4感染的时间越长,鸡外周血细胞中的红细胞数相应减少,而白细胞数则相应增加.感染3 h时,白细胞数、红细胞数与未攻毒组的差异不显著(P>0.05);感染6、12、24 h时,白细胞数、红细胞数与未攻毒组的差异显著(P<0.05).红细胞数与感染时间呈负相关,而白细胞数与感染时间呈正相关.感染3、6 h时,鸡外周血细胞中的血小板数与未攻毒组的差异不显著(P>0.05),感染12、24 h时的血小板数增加,尤其在12 h时增加最多,与未攻毒组的差异显著(P<0.05).

图柱上附不同字母表示差异显著(P<0.05),附相同字母表示差异不显著(P>0.05).
2.3 FAdV-4感染对鸡外周血液生化指标的影响
图3显示:与未攻毒组相比,感染FAdV-4 3~24 h,鸡外周血液中的血糖浓度显著升高(P<0.05),甘油三酯浓度显著下降(P<0.05),总蛋白含量也减少;总蛋白含量在被FAdV-4感染3、12 h时与未攻毒组的差异不显著(P>0.05),感染6、24 h时与未攻毒组的差异显著(P<0.05).

图柱上附不同字母表示差异显著(P<0.05),附相同字母表示差异不显著(P>0.05).
2.4 FAdV-4感染对鸡外周血炎症因子的影响
图4显示:感染FAdV-4 3、6、12 h时,鸡外周血液中的HMGB1含量与未攻毒组的差异不显著(P>0.05),感染24 h时显著增加(P<0.05);感染3~24 h时,IL-1β、组胺和缓激肽的含量较未攻毒组显著增加(P<0.05);感染6 h时,IL-6和P物质的含量与未攻毒组的差异不显著(P>0.05),感染3、12、24 h时,IL-6和P物质的含量均显著增加(P<0.05).
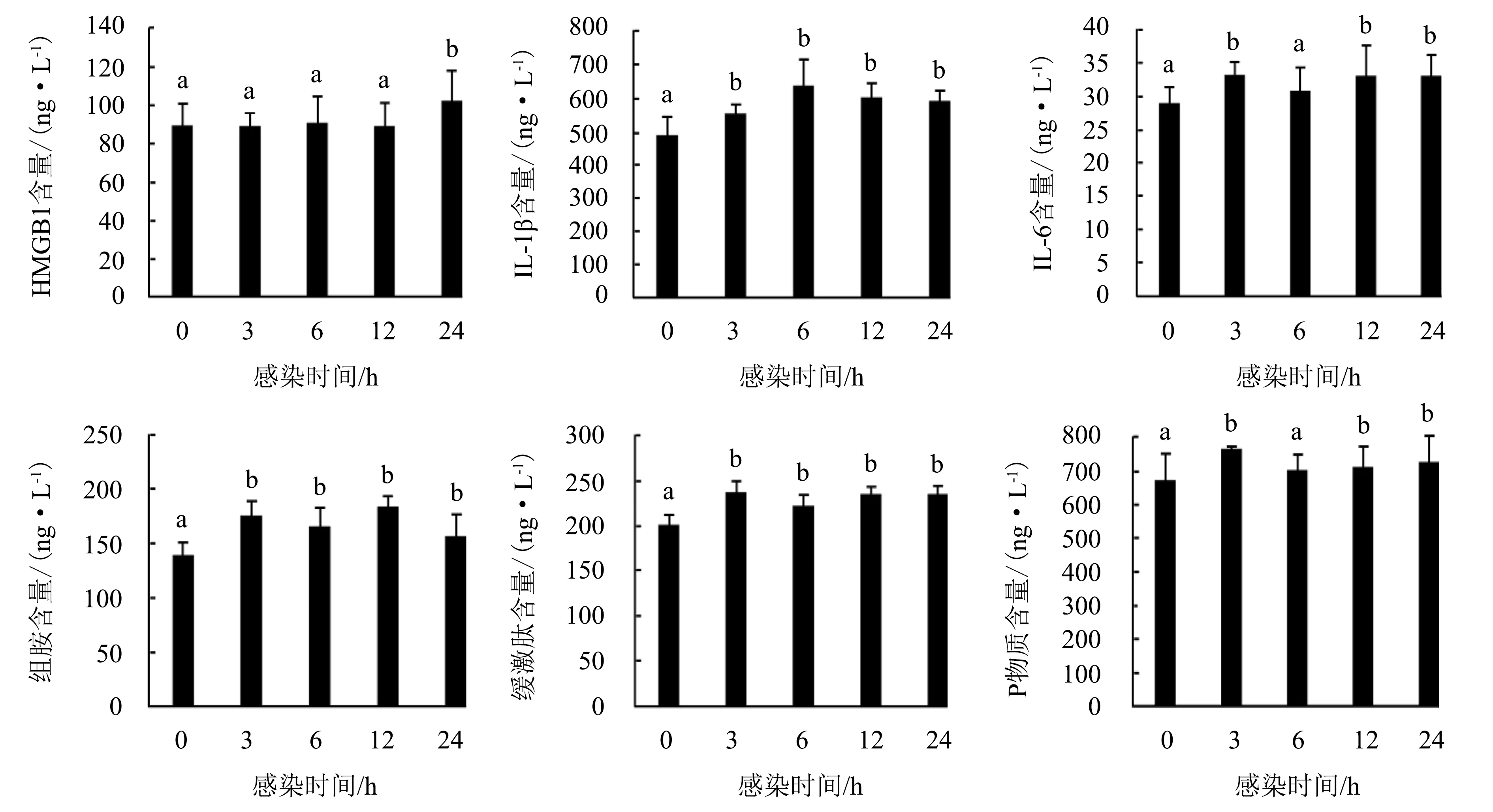
图柱上附不同字母表示差异显著(P<0.05),附相同字母表示差异不显著(P>0.05).
3 讨论
2015年后,全球陆续报道鸡发生严重的肝炎—心包积液综合征,经证实病原为FAdV-4,与鸡包涵体肝炎不同的是,肝炎—心包积液综合征导致3~5周龄鸡心包腔产生大量的黄色胶冻状渗出液,肝脏有大量出血点,肝炎严重,肝细胞变性坏死,肝血窦扩张,出现嗜碱性包涵体[1].目前,FAdV-4的致病机理尚未完全明确.
血常规包括红细胞数、白细胞数和血小板计数等.血常规检查首先可以确定机体是否存在炎症、贫血以及是否存在血小板数减少或者增加的现象,初步判定机体出血是否与血小板有关[16].本研究结果表明:感染FAdV-4后,鸡外周血细胞病毒载量与感染时间呈正相关;红细胞数随着病毒载量的增加而减少,说明感染FAdV-4后机体有出血或失血现象,此结果与临床病理剖检结果[13]一致.由于鸡感染FAdV-4后有出血症状,导致外周血红细胞数减少[17],鸡呈明显的贫血状态.鸡感染FAdV-4后,其肝脏发生严重的出血病变,肝脏病变会影响机体的凝血功能,导致外周血小板数增加,使外周血液处于高凝状态;此外,赵丽红[18]研究表明,“肝藏血”功能异常会导致肝炎患者血红细胞数下降.本研究结果显示,感染FAdV-4后,鸡外周血白细胞数与病毒载量呈正相关,表明炎症细胞显著增加,此结果与国纪垒[19]的研究结果“FAV-1攻毒后的24 h内白细胞数高于对照组”一致.唐迎元等[20]研究表明,儿童感染重症腺病毒肺炎后,外周血白细胞数和血小板数增加.有些病毒的感染也会导致机体发生严重的炎症反应,从而对机体造成损伤[17-20].
血液中的总蛋白、血糖、甘油三酯水平可以初步判定机体肝脏功能[21].研究表明,新冠病毒导致感染者血糖浓度升高,与糖尿病关系密切[22].由于新冠病毒会直接破坏胰腺进而破坏胰岛细胞[22],可能引起炎症因子发生改变从而导致机体肾上腺素等分泌增加,产生胰岛素抵抗,血糖浓度升高[22].糖皮质激素通过抗炎作用阻断炎症瀑布反应,作为胰岛素对抗激素,引起血糖浓度升高[22].由此猜想,FAdV-4感染是否与新冠病毒感染相同,通过破坏胰腺进而引起血糖浓度升高需要进一步探究.此外,牛玉娟[23]研究表明,感染FAdV-4 1 d后,鸡血糖浓度升高,此结果与本研究结果一致.由于肝脏是血糖代谢的主要器官,感染FAdV-4后,鸡肝脏功能被破坏,从而导致血糖降解能力减弱,出现血糖浓度升高的现象.本研究结果同样表明,感染FAdV-4后,鸡血糖浓度显著升高,可能与肝脏损伤有关.
外周血总蛋白含量减少常见于机体由于肝细胞病症或肝功能受损而引起的蛋白合成障碍.如:徐亚林等[24]研究表明,新冠肺炎明显损伤患者的肝功能,其中,总蛋白对于肝功能损伤具有一定程度的诊断价值;本研究结果表明,鸡感染FAdV-4后,病禽的肝脏呈现严重出血的病理症状,导致总蛋白合成障碍,外周血总蛋白含量减少;李硕[25]研究表明,甘油三酯浓度下降可能是鸡患有严重的肝病或者机体代谢异常所导致的.本研究中,鸡感染FAdV-4后,肝脏受损严重从而导致机体代谢紊乱,可能是甘油三酯浓度下降的原因.
HMGB1主要的作用是可以激活肥大细胞从而导致中枢炎症[26].IL-6是活化的T细胞以及成纤维细胞产生的淋巴因子,它的主要功能是能使B细胞前体产生抗体,还能与集落刺激因子协同促进原始骨髓源细胞的生长和分化,进一步增强自然杀伤细胞的裂解功能[27].HMGB1和IL-6含量的增加可以说明鸡感染FAdV-4后机体炎症因子释放明显[26-27].IL-1β作为内皮细胞活化因子,其主要的作用是在机体炎症产生的前期诱导单核—吞噬细胞的产生[26-27].汤正珍[28]研究表明,小鼠感染HAdV-7 24 h后,HMGB1的表达量显著增加.细胞外的HMGB1与Toll样受体、晚期糖基化终末产物受体相结合从而促使NF-kB通路被激活,进一步促进致炎细胞因子IL-6、IL-1β基因表达水平的上调,促进炎症的产生[29].组胺是一种活性胺化合物,是机体中的一种化学传导物质,对许多细胞的反应均有影响,其中就包括过敏反应和炎性反应[27].马卫红等[30]研究表明,鸡、鸭外周血中的组胺含量在感染病毒后均显著升高,表明低致病性H9N2禽流感病毒可引起禽类产生炎症反应并导致组胺含量升高.缓激肽可以提高心肌缺血早期三磷酸腺苷(ATP)和磷酸肌酸的含量,使糖原分解减少,乳酸生成下降,从而提高心肌的抗缺血能力[26].P物质在细神经纤维中广泛分布,逆向电刺激感觉神经或经细传入神经传出的轴突反射和背根反射冲动可使外周端末稍释放P物质,引起神经支配区血管扩张、通透性增强、血浆蛋白外渗等神经源性炎症反应[31].P物质是伤害性信息初级传入的神经递质,与许多炎症细胞、炎症介质和细胞因子相互作用,诱导产生多种细胞因子,从而促进单核细胞分泌 IL-1、IL-6等炎症因子[31].本研究结果表明,鸡感染FAdV-4后导致外周血多种炎症因子显著增加,说明与上述前人的研究结果一致,机体感染病毒后均会产生严重的炎症反应.

