包包曲和平板曲挥发性风味成分及真菌群落结构研究
刘延波,魏蒙蒙,王琳琳,王贤,沈祥坤,韩素娜,张立新,潘春梅
1.河南仰韶酒业有限公司 博士后科研工作站,河南 渑池 472400;2.河南牧业经济学院 食品与生物工程学院(酒业学院)/河南省白酒风格工程技术研究中心/郑州市白酒酿造微生物技术重点实验室,河南 郑州 450046;3.河南大学 生命科学学院,河南 开封 475004;4.赊店老酒股份有限公司,河南 社旗 473300;5.河南省食品工业科学研究所有限公司,河南 郑州 450003
0 引言
大曲是白酒酿造过程中的重要物质[1],是一种同时含有微生物菌系、微生物酶系和复合曲香物质的微生态制品[2],在大曲酒酿造过程中可同时作为糖化剂、发酵剂和生香剂[3],其品质是影响白酒品质的重要因素[4]。平板曲呈块状或砖状,其表面和内部均形成了有益的酿酒微生物群系[5];包包曲中间凸起的“包包”部位表面积大、结构疏松、气泡厚实,可形成高温区域[6]。大曲的制作受原料、环境的影响较大,故其中的微生物菌群十分复杂[7]。微生物的代谢产物及原料的分解产物直接或间接地构成了白酒的风味成分,这些风味成分不仅有助于研究白酒的香气成分,而且有助于判别大曲的品质[8]。大曲中的许多微量香气成分(如己酸、己酸乙酯、乙酸乙酯等)与基础白酒中的香气成分相似[9]。微生物中的霉菌具有糖化、液化、蛋白分解等水解能力及酯化能力[10],而酵母菌具有酒精发酵能力及产酯能力,二者对白酒中酒精及香味成分的产生均起着十分重要的作用[11]。
大曲是固体状态,提取其风味成分的难度比液体状态的白酒更大。顶空固相微萃取-气相色谱-质谱联用(HS-SPME-GC-MS)技术可对食品挥发性或难挥发性风味成分进行富集,并对混合成分进行鉴定或定性定量分析,具有操作简便、高效、准确、无需有机溶剂等优点,是目前应用较广泛的风味成分分析方法[12]。高通量测序技术具有数据产出通量高、分析全面、灵敏、快速等特点,可定性和定量揭示样品微生物群落组成和多样性信息[13],是分析复杂微生物群落结构的有效手段[14-15]。G.M.Fu等[16]使用Illumina MiSeq测序及HS-SPME-GC-MS技术分析了不同季节生产的茶味大曲的微生物群落结构及挥发性风味成分,确定了该类大曲的最佳生产季节;G.S.Fan等[17]利用上述技术表征了不同存放时间清香型白酒大曲的挥发性风味成分和微生物群落结构,发现老化有助于酯化活性的稳定。
河南地区酒企主要使用平板曲,但近年来,包包曲的应用比例逐年上升,而针对包包曲的研究相对较少,且对包包曲和平板曲的挥发性风味成分、真菌群落结构和酿酒优势的对比研究也较少。基于此,本研究拟利用HS-SPME-GC-MS和高通量测序技术,分析河南地区浓香型白酒包包曲和平板曲的挥发性风味成分及真菌群落结构,以期为河南地区大曲的选用与制作、浓香型白酒品质的提升及创新性发展提供理论依据和参考。
1 材料与方法
1.1 材料与试剂
1.1.1 大曲样品包包曲和平板曲样品,均取自赊店老酒股份有限公司浓香型白酒酿酒生产用曲。在包包曲和平板曲曲垛的上、中、下层各取1块,将3块大曲的曲心、曲皮混匀,粉碎过20目筛,存放于无菌采样袋中,分别标号为A1和B1,于-80 ℃冰箱存放,备用。
1.1.2 主要试剂DNeasy PowerSoil Pro Kit试剂盒,德国Qiagen公司产;QubitTMssDNA检测试剂盒、2×Rapid Taq Master Mix,赛默飞世尔科技(中国)有限公司产;MagicPure Size Selection DNA Beads 试剂盒,北京全式金生物技术有限公司产。
1.2 主要仪器与设备
7890B-5977A型气相色谱-质谱联用仪,安捷伦科技有限公司产;Pico-21型台式离心机,赛默飞世尔科技(中国)有限公司产;TT-2500-VM型漩涡混合器,北京金恒祥仪器有限公司产;ZX-30型混匀型干式恒温器,北京开源国创科技有限公司产;T100TMThermal Cyeler型 PCR仪,美国Bio-Rad公司产;Research plus移液器(0.5~10.0 μL),美国Eppendorf公司产;DYY-6C型电泳仪电源、DYCZ-21型电泳槽,北京市六一生物科技有限公司产;ZF-258型凝胶成像分析系统,上海嘉鹏科技有限公司产。
1.3 实验方法
1.3.1 挥发性风味成分检测HS-SPME条件:准确称取3.0 g大曲样品置于20 mL顶空瓶中;孵化炉温度为60 ℃,孵化10 min;萃取40 min;进样口温度为260 ℃,解吸2 min后,自动进行GC-MS分析。
GC条件:色谱柱为HP-FFAP(30 m×0.32 mm×0.25 μm);不分流,流速为1.21 mL/min;进样口温度为250 ℃;升温程序为40 ℃稳定3 min,以5 ℃/min升至60 ℃,再以8 ℃/min升至230 ℃并稳定7 min。
MS条件:接口温度为220 ℃;电离方式为电子电离(EI)源;电子能量为70 eV;离子源温度为200 ℃。
1.3.2 真菌DNA提取及高通量测序根据DNeasy PowerSoil Pro Kit试剂盒使用说明书进行真菌DNA提取,并采用琼脂糖凝胶电泳检测DNA的完整性。
PCR扩增真菌ITS区基因,引物为ITS1F(5′-CCCTACACGACGCTCTTCCGATCTN (barcode) CTTGGTCATTTAGAGGAAGTAA-3′)和ITS2R(5′-GTGACTG-GAGTTCCTTGGCACCCGAGAATTCCAGCTGCGTTCTT-CATCGATGC-3′)。PCR扩增条件参照文献[18],并对PCR扩增产物进行琼脂糖凝胶电泳检测。PCR扩增产物碱基长度为400 bp左右,与目标产物长度一致,使用MagicPure Size Selection DNA Beads试剂盒回收该产物,并利用Illumina公司Miseq PE 300测序平台进行高通量测序。
1.3.3 测序数据分析去除序列引物接头序列,将成对的reads拼接成一条序列,按barcode标签序列识别并区分样品后对数据进行质控过滤。对真菌群落结构进行OTU(操作分类单元)分析(http:∥drive5.com/usearch/manual/singletons.html)、α多样性分析、物种分类学分析、物种丰度差异分析等。
2 结果与分析
2.1 包包曲和平板曲的挥发性风味成分分析
通过HS-SPME-GC-MS技术检测包包曲和平板曲中的挥发性风味成分,并进行半定量分析。包包曲和平板曲的挥发性风味成分见表1。由表1可知,共检测到24种挥发性风味成分,包括7种醇类化合物、4种酯类化合物、1种酮类化合物、1种醛类化合物、4种酸类化合物、3种酚类化合物和4种碳氢化合物。包包曲中共检测出17种挥发性风味成分,平板曲中共检测出19种挥发性风味成分。

表1 包包曲和平板曲的挥发性风味成分Table 1 The volatile flavor components of bag Daqu and the brick Daqu
酯类化合物中的3-苯丙酸乙酯、棕榈酸乙酯、己二酸双(2-丁氧基乙)酯,酮类化合物中的3-叔-丁基-2-吡唑啉-5-酮,酸类化合物中的醋酸、己酸、辛酸、棕榈酸,醇类化合物中的苯乙醇,酚类化合物中的对甲酚、2,4-二叔丁基苯酚,以及碳氢化合物中的2,5-二甲基正己烷-2,5-二甲羟基过氧化物在包包曲中的相对含量均高于平板曲。3-苯丙酸乙酯是具有中等强度水果蜂蜜香的芳香活性酯[19-20]。
己二酸双(2-丁氧基乙)酯存在于酒、醋及其他发酵食品中,高浓度时对细菌具有抑制作用,低浓度时可作为碳源刺激真菌生长与繁殖[21]。棕榈酸乙酯、醋酸、己酸、辛酸、苯乙醇是浓香型白酒中的关键香气成分[22],其中棕榈酸乙酯为浅黄色油状液体,呈微弱蜡香、果香和奶油香气[23];醋酸对浓香型白酒风味具有积极的影响,是酯类的重要前体物质,但过多的醋酸可能会使浓香型白酒产生酸味[24];己酸在微生物催化的酯化作用下能产生浓香型白酒的主体香己酸乙酯,对浓香型白酒品质具有重要作用[25];辛酸是辛酸乙酯的重要前体物质,微量的辛酸乙酯在浓香型白酒中具有较明显的水果香[26];苯乙醇具有甜面包和玫瑰香气[27]。2,4-二叔丁基苯酚是一类具有抗真菌活性的抗氧化剂[24],其在包包曲中的相对含量高于平板曲,可能对包包曲真菌群落限制较大,这一猜想将通过后文关于真菌群落多样性和丰度的数据加以证实。
酯类化合物中的乙酸龙脑酯,醛类化合物中的癸醛,醇类化合物中的正己醇、1-辛烯-3-醇、2-乙基己醇、辛醇、(-)-4-萜品醇、DL-薄荷醇,酚类化合物中的苯酚,以及碳氢化合物中的1,4-二乙基苯、2,3,5,6-四甲基吡嗪、萘在平板曲中的相对含量均高于包包曲。其中,乙酸龙脑酯具有杀虫、抗炎、抗肿瘤、提高心血管活性、止痛、止泻、改善记忆等药理作用[28];癸醛只在平板曲中检出,其具有脂香,低浓度时呈花香[29]。包包曲中酯类挥发性风味成分的种类多于平板曲,但总酯相对含量低于平板曲。平板曲中醇类挥发性风味成分的种类及相对含量均明显高于包包曲,其中,正己醇、辛醇、(-)-4-萜品醇、DL-薄荷醇是浓香型白酒中的微量成分,俗称“杂醇油”或高级醇,具有强烈、特殊的刺激性气味[30],低浓度时具有青香、果香、醇香、甜香和醚香[31]。醇类化合物和酸类化合物可在酯酶催化或酯化条件下形成大量酯类化合物,从而赋予浓香型白酒更多的挥发性风味成分,且适量的高级醇能赋予浓香型白酒良好的感官特征[32-33]。1-辛烯-3-醇被证实是酒曲中最重要的香气成分之一,具有蘑菇、薰衣草、玫瑰和干草香气[34]。2,3,5,6-四甲基吡嗪是一种含氮杂环化合物,具有烘焙和坚果风味及极性香味阈值,可为浓香型白酒提供特殊的风味[24]。
包包曲和平板曲挥发性风味成分在组成和相对含量上具有差异,包包曲的挥发性风味成分主要为酯类化合物和酸类化合物;平板曲的挥发性风味成分主要为醇类化合物。大曲中的风味成分会随发酵基质最终呈现在浓香型白酒中[35],因此,使用包包曲、平板曲或混合曲对浓香型白酒风味形成具有一定的导向作用。
2.2 包包曲和平板曲真菌群落结构分析
2.2.1 高通量测序结果分析包包曲和平板曲经高通量测序分别产生原始序列数目60 511个和66 247个。将序列质控过滤后,包包曲有58 724个序列,平均长度为243 bp,平板曲有66 001个序列,平均长度为226 bp。经PCR扩增后,包包曲产生了62个嵌合体,平板曲产生了571个嵌合体。对测序错误数据进行剔除、校正等质量控制处理后,包包曲的序列数目为58 662个,平板曲的序列数目为65 430个。该结果表明,本研究测序数据的质量满足微生物群落结构的分析要求。
2.2.2OTU分析在97%的相似水平下进行OTU生物信息统计分析。比对数据库,包包曲共注释117个OTU,平板曲共注释156个OTU。Venn分析发现,包包曲和平板曲共有的OTU 数目为62个,包包曲和平板曲特有的OTU数目分别为55个和94个。
2.2.3α多样性分析α多样性可以反映微生物群落的多样性和丰度,其中Shannon指数和Simpson指数表示物种多样性,ACE指数和Chao1指数表示物种丰度,Coverage指数反映测序结果是否代表样本的真实情况。包包曲和平板曲的真菌α多样性指数见表2。由表2可知,与包包曲相比,平板曲的Shannon指数较高,而Simpson指数较低;包包曲的ACE指数和Chao1指数均低于平板曲,表明包包曲物种丰度低于平板曲,即平板曲中真菌的复杂程度明显高于包包曲。包包曲和平板曲的Coverage指数均高于0.99,足以反应二者真菌群落结构的真实信息。

表2 包包曲和平板曲的真菌α多样性指数Table 2 Fungal α diversity index of bag Daqu and brick Daqu
Shannon指数稀释曲线用于评估测序数据量。包包曲和平板曲的Shannon指数稀释曲线图如图1所示。由图1可知,代表包包曲的红线和代表平板曲的蓝线均随测序量的增加而趋于平坦,表明本研究的测序数据量是合理的。
图1 包包曲(A1)和平板曲(B1)的Shannon指数稀释曲线图Fig.1 Shannon index dilution curve of bag Daqu(A1)and brick Daqu (B1)
2.2.4 物种分类学分析通过高通量测序,基于OTU在门水平和属水平上对包包曲和平板曲真菌群落进行分类统计。包包曲和平板曲在门水平上的真菌群落结构分布图如图2所示。由图2可知,从门水平上分析,以平均相对丰度>0.50%为阈值,包包曲中的优势真菌门分别是子囊菌门(Ascomycota,96.54%)、被孢菌门(Mucoromycota,2.68%)和担子菌门(Basidiomycota,0.56%);非优势真菌门为Olpidiomycota(0.01%)。平板曲中的优势真菌门分别是子囊菌门(Ascomycota,81.47%)和被孢菌门(Mucoromycota,6.74%);非优势真菌门为担子菌门(Basidiomycota,0.14%)。包包曲和平板曲中共有的优势真菌门为子囊菌门和被孢菌门,且包包曲比平板曲多一个优势真菌门担子菌门。之前的研究[36-37]表明,浓香型白酒大曲中的真菌群落多为子囊菌门、被孢菌门、担子菌门和接合菌门,这与本研究结果基本一致。
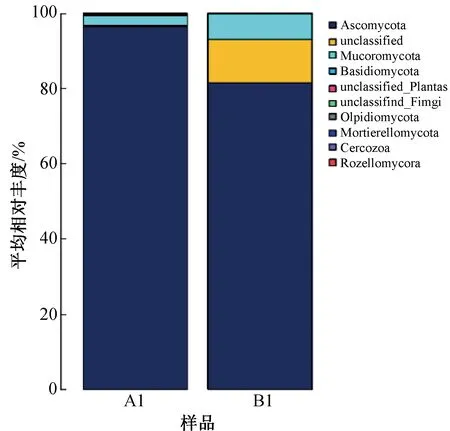
图2 包包曲(A1)和平板曲(B1)在门水平上的真菌群落结构分布图Fig.2 Distribution of the fungal community structure of bag Daqu(A1)and brick Daqu(B1) at the phylum level
包包曲和平板曲在属水平上的真菌群落结构分布图如图3所示。由图3可知,从属水平上分析,以平均相对丰度>1.00%为阈值,包包曲中的优势真菌属分别是嗜热子囊菌属(Thermoascus,76.90%)、曲霉属(Aspergillus,1.60%)、根霉菌属(Rhizopus,2.03%)和假丝酵母属(Candida,2.11%),非优势真菌属分别是双足囊菌属(Dipodascus,0.12%)、链格孢属(Alternaria,0.01%)、根毛霉属(Rhizomucor,0.62%)、附球菌属(Epicoccum,0.01%)、生丝毕赤酵母属(Hyphopichia,0.19%)、威克汉姆酵母属(Wickerhamomyces,0.04%)、镰刀菌属(Fusarium,0.02%)、红酵母属(Rhodotorula,0.37%)、嗜热真菌属(Thermomyces,0.04%)、Cutaneotrichosporon(0.02%)、Cystofilobasidium(0.09%)、丝孢酵母属(Trichosporon,0.03%)、青霉菌属(Penicillium,0.02%)、毛霉菌属(Mucor,0.01%)、Apiotrichum(0.02%)、Papiliotrema(0.01%)、毕赤酵母属(Pichia,0.01%)、棒孢酵母属(Clavispora,0.01%)、Diutina(0.01%)和油壶菌属(Olpidium,0.01%);平板曲中的优势真菌属分别是嗜热子囊菌属(49.70%)、曲霉属(8.41%)、根霉菌属(6.02%)、双足囊菌属(3.30%)、链格孢属(1.07%)和附球菌属(1.00%),非优势真菌属分别是假丝酵母属(0.19%)、根毛霉属(0.51%)、生丝毕赤酵母属(0.63%)、明梭孢属(Monographella,0.40%)、威克汉姆酵母属(0.33%)、镰刀菌属(0.34%)、红酵母属(0.01%)、嗜热真菌属(0.07%)、平脐蠕孢属(Bipolaris,0.10%)、Cutaneotrichosporon(0.07%)、丝孢酵母属(0.03%)、青霉菌属(0.04%)、横梗霉属(Lichtheimia,0.04%)、毛霉菌属(0.03%)、小球腔霉属(Leptosphaeria,0.03%)、丝衣霉属(Byssochlamys,0.02%)、Guehomyces(0.01%)、弯孢属(Curvularia,0.01%)、枝孢霉属(Cladosporium,0.01%)、篮状菌属(Talaromyces,0.01%)、亚隔孢壳属(Didymella,0.01%)、黑孢属(Nigrospora,0.01%)和地霉属(Geotrichum,0.01%)。李斌等[38]利用高通量测序技术得到的浓香型白酒中高温酒曲的优势真菌属为假丝酵母属、嗜热子囊菌属和根毛霉属,双足囊菌属、链格孢属和附球菌属含量较少,而这些含量较少的真菌属是本研究中平板曲的优势菌属。

图3 包包曲(A1)和平板曲(B1)在属水平上的真菌群落结构分布图Fig.3 Distribution of the fungal community structure of bag Daqu(A1)and brick Daqu(B1) at the genus level
属水平上包包曲和平板曲与菌属物种的关系图如图4所示。图4不仅反映了每个大曲样品的优势真菌属的组成比例,也反映了各优势真菌属在不同大曲样本上的分布比例。与平板曲相比,包包曲中占比较高的优势真菌属包括嗜热子囊菌属和假丝酵母属。嗜热子囊菌属可产生过氧化氢酶、内切葡聚糖酶、木聚糖酶、葡萄糖苷酶、角质酶、几丁质酶等,多数假丝酵母属具有酒精发酵能力[39]。平板曲中曲霉属、双足囊菌属、根霉菌属等均明显多于包包曲。曲霉菌属能产生淀粉酶、蛋白酶、糖化酶、酯化酶、果胶酶、纤维素酶、单宁酶等,在浓香型白酒的酿造过程中主要作用于发酵前期,是浓香型白酒发酵原料中淀粉等大分子物质分解的主要动力之一[40]。双足囊菌属的作用则主要表现在产香及产前体物质方面,对酸类化合物、醇类化合物具有较强的酯化能力,所产生的物质对浓香型白酒酒体风格的形成具有重要作用[41]。根霉菌属为固态发酵中后期的优势真菌[42],在酿酒发酵中非常常见,其产淀粉酶最为突出,在一定条件下,根霉菌属能同时进行糖化和发酵,产生乙醛、乙酸乙酯、乳酸乙酯、苯乙醇等风味成分[43]。

图4 属水平上包包曲(A1)和平板曲(B1)与菌属物种的关系图Fig.4 Relationship between bag Daqu(A1)and brick Daqu(B1)and mycorrhizal species at the genus level
2.2.5 物种丰度差异分析进一步对包包曲和平板曲的菌群丰度进行差异性分析,包包曲和平板曲真菌属丰度差异显著的误差线图如图5所示,其中,当P<0.05时,表示两者差异显著。由图5可知,除未分类的真菌属外,包包曲和平板曲丰度差异显著的真菌属共24个,其中,平板曲比包包曲多的真菌属包括曲霉属、双足囊菌属、根霉菌属、链格孢属、附球菌属、明梭孢属、镰刀菌属、威克汉姆酵母属、生丝毕赤酵母属、平脐蠕孢属、横梗霉属、小球腔霉属、丝衣霉属和Cutaneotrichosporon。包包曲比平板曲多的真菌属包括嗜热子囊菌属、假丝酵母属、红酵母属和Cystofilobasidium。

图5 包包曲(A1)和平板曲(B1)菌属丰度差异显著的误差线图Fig.5 Error line plot for comparing the differences in genera of bacteriophages of bag Daqu (A1) and brick Daqu (B1)
平板曲的真菌群落丰度高于包包曲。平板曲中曲霉属和根霉菌属负责形成一系列淀粉酶和糖化酶,为微生物生长提供合适的底物[44],且双足囊菌属类产香真菌[45]的相对丰度高于包包曲,这或许能解释真菌群落和挥发性风味成分上的差异。链格孢属、附球菌属、明梭孢属、小球腔霉属、横梗霉属、平脐蠕孢属、丝衣霉属和Cutaneotrichosporon在浓香型白酒发酵过程中虽已有报道,但其具体功能还未被解析[46];镰刀菌属与苯甲醛和(E,E)-2,4-壬二烯醛的形成呈正相关;威克汉姆酵母属是最主要的非酿酒酵母,存在于各类自然发酵食品中[47],这些真菌属赋予了平板曲强于包包曲的诸多功能。在包包曲中,因发酵温度较平板曲高,耐高温的嗜热子囊菌属、假丝酵母属是其主要的差异菌属,它们主要提供与糖化和乙醇发酵有关的酶[48];红酵母属对降解酒精发酵过程中的污染物氨基甲酸乙酯具有重要作用[49]。综上所述,平板曲在真菌群落结构组成上优于包包曲,可为浓香型白酒发酵提供更多的潜在功能。
大曲在自然发酵过程中依靠内源生物热驱动群落演变,在温度逐渐升高的过程中,部分不耐高温微生物会死亡[38]。本研究中包包曲真菌群落属水平上的多样性和丰度均低于平板曲,这是由于包包曲的“包包”部分温度高、湿度大、高温持续时间长,对微生物生长的制约较大。两种大曲形状的不同导致二者发酵参数不同,尤其是温度的变化,对真菌群落的结构起着决定性作用。大曲微生物菌群在发酵过程中代谢产生的各种酶可将大曲中的大分子淀粉和蛋白质降解为小分子还原糖和氨基酸供给微生物生长和风味代谢,其本身所含有的大量风味成分或前体物质在酿造过程中亦可直接或间接地进入酒体中[50-51]。大曲微生物的群落结构不仅决定大曲的功能,而且对大曲的风味成分代谢至关重要。本研究中包包曲和平板曲因形状不同,导致二者发酵温度不同,进而导致真菌群落结构不同,从而引起挥发性风味成分的差异。
2.2.6 系统发生进化树分析在属水平上,选取OTU聚类结果中总丰度较大的前50个OTU聚类的代表序列,以及数据库中与这50个代表序列种属信息一致且最长的序列,通过MUSCLE软件比对分析,构建的系统发生进化树如图6所示。图6可明显、系统地揭示包包曲和平板曲中菌落进化过程的顺序及其各个菌属进化的历史和机制。

图6 丰度较大的前50个OTU在属水平上的系统发生进化树Fig.6 Cluster diagram of the top 50 OTUs with the highest abundance at the genus level
3 结论
本文通过顶空固相微萃取-气相色谱-质谱联用技术检测了包包曲和平板曲中的挥发性风味成分,发现在两种大曲中共检测到24种挥发性风味成分,其中包括7种醇类化合物、4种酯类化合物、1种酮类化合物、1种醛类化合物、4种酸类化合物、3种酚类化合物和4种碳氢化合物;包包曲和平板曲挥发性风味成分的组成和相对含量均具有差异,包包曲中共有17种挥发性风味成分,主要为酯类化合物和酸类化合物,如3-苯丙酸乙酯、棕榈酸乙酯、己二酸双(2-丁氧基乙)酯、醋酸、己酸、辛酸和棕榈酸;平板曲中共有19种挥发性风味成分,主要为醇类化合物,如正己醇、1-辛烯-3-醇、2-乙基己醇、辛醇、(-)-4-萜品醇和DL-薄荷醇;包包曲中相对含量较高的2,4-二叔丁基苯酚可能是导致其真菌群落丰度低于平板曲的原因之一。通过高通量测序技术分析了包包曲和平板曲中的真菌群落结构,发现从门水平上分析,包包曲中含有的优势真菌门(平均相对丰度>0.50%)有3个,分别是子囊菌门、被孢菌门和担子菌门;平板曲中的优势真菌门(平均相对丰度>0.50%)有2个,分别是子囊菌门和被孢菌门;从属水平上分析,包包曲中的优势真菌属(平均相对丰度>1.00%)有4个,分别是嗜热子囊菌属、曲霉属、根霉菌属和假丝酵母属;平板曲中的优势真菌属(平均相对丰度>1.00%)有6个,分别是嗜热子囊菌属、曲霉属、根霉菌属、双足囊菌属、链格孢属和附球菌属。包包曲和平板曲中丰度差异显著的真菌属共24个,分析原因为包包曲和平板曲的形状不同使得二者发酵温度不同,进而导致真菌群落的多样性和丰度不同,从而引起挥发性风味成分的差异。该研究明确了河南地区包包曲和平板曲的挥发性风味成分组成和真菌群落结构,对河南地区大曲的制作、酒企对生产用曲的选择、浓香型白酒品质的提升及创新性发展具有重要意义。本研究只选取了发酵成熟阶段的包包曲和平板曲,对两种大曲整个发酵阶段的温度变化与真菌群落演替规律和挥发性风味成分代谢的关系尚不明确,因此,下一步将采用微生物组学和代谢组学联用的方法研究整个发酵阶段温度变化对微生物群落演替规律和挥发性风味成分代谢的影响。

