TLR4/MyD88/AMPK通路参与调节高脂饮食诱导的肥胖小鼠脂肪组织炎症和细胞凋亡
李琳娜 李坚 贺熙乔 刘丽丽 张浩强 仲彦霖 宋冰
(锦州医科大学附属第一医院,锦州 121000)
近年肥胖症患者逐年增加[1]。肥胖作为2型糖尿病、高脂血症、高血压、冠心病、呼吸睡眠暂停及骨关节炎等多种疾病的独立危险因素已得到广泛认可,给患者生活带来了极大困扰[2]。大量研究显示其主要病理机制与肥胖诱导的脂质代谢异常及脂肪组织慢性炎症密切相关。Toll样受体4(Toll like receptor 4,TLR4)作为TLRs家族重要成员,在机体固有免疫应答中扮演重要角色,参与诱导细胞内信号级联反应并调节炎症因子释放。TLR4/MyD88参与一系列组织器官损害(如心功能不全、急性肺部炎症、慢性肝炎病毒感染)等炎症反应调节[3-6]。但有关TLR4在高脂诱导的肥胖小鼠慢性炎症调节的研究较少。腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)作为重要的细胞代谢感受器,人和动物研究均已证实AMPK不仅参与脂肪组织慢性炎症、胰岛素抵抗调节,还参与脂肪细胞凋亡调控,后者与脂肪组织炎症反应密切相关[7-12]。AMPK激活可有效抑制肥胖诱导的脂肪组织慢性炎症和细胞凋亡。基于此,本研究旨在探索TLR4基因敲除是否可通过MyD88依赖的AMPK进而缓解高脂诱导肥胖脂肪组织慢性炎症和细胞凋亡,对临床发掘新的抗肥胖药物具有指导意义。
1 材料与方法
1.1材料
1.1.1实验动物4周龄健康雄性C57BL/6J小鼠(SCXK[京]2009-0015,北京华阜康有限公司)和TLR4基因敲除小鼠(022507,美国Jackson实验室)各24只,体质量(14±2)g。所有小鼠置于锦州医科大学附属第一医院SPF级环境[(22±2)℃,湿度(50±20)%,自由饮水、摄食,12 h昼夜循环]中饲养。动物实验操作均按照锦州医科大学伦理委员会规定进行。
1.1.2主要试剂与仪器HE染色试剂盒、兔抗小鼠TLR4、兔抗小鼠MyD88、兔抗小鼠AMPKα和磷酸化p-AMPKα(Thrl72)超敏ECL发光试剂盒(沈阳万类科技生物有限公司);兔抗鼠β-actin(美国Santa cruz);山羊抗兔HRP二抗、山羊抗小鼠HRP二抗(美国CST);小鼠MCP-1、IL-6、TNF-α和IL-10 ELISA试剂盒(上海酶联生物有限公司);PVDF膜(0.22/0.45 μm,美国Millipore);RIPA裂解液、BCA蛋白定量试剂盒、Western blot制胶试剂盒(上海碧云天生物科技有限公司);标准蛋白Marker(美国Themo Fisher Scientific);超纯水机(美国Millipore公司);制冰机(Sanyo公司);组织匀浆机、超声波破碎仪(美国Qsonica公司);高速冷冻离心机(Eppendorf公司);全自动酶标仪(Tecan公司);电泳仪、电泳槽(Bio-Rad公司);脱色摇床STS-3(上海琪特分析仪器有限公司);BT100-1L蠕动泵(保定兰格恒流聚有限公司);凝胶成像仪(Thermo公司);倒置显微镜、荧光显微镜(Olympus公司)。
1.2方法
1.2.1分组与模型建立4周龄雄性C57BL/6J和TLR4基因敲除小鼠各24只,随机分为正常对照组(NC,n=8)、肥胖组(OB,n=16)、TLR4基因敲除组(TK,n=8)、TLR4基因敲除肥胖组(TO,n=16)。NC组给予含脂肪10%的全价营养颗粒饲料,其他组给予含脂肪60%的专用高能饲料喂养,16周后成功筛选高脂饮食组体质量大于普通营养饲料喂养组小鼠体质量上限且未发生糖尿病的小鼠8只纳入肥胖模型,其余剔除。
1.2.2生化指标检测16周后(各组小鼠术前禁饮食6 h)称取体质量,断头处死,心脏取血,检测空腹血糖(fasting plasma glucose,FPG)、总胆固醇(total cholesterol,TC)、三酰甘油(triglyceride,TG)、低密度脂蛋白(low density lipoprotein,LDL)、高密度脂蛋白(high density lipoprotein,HDL)和游离脂肪酸(free fatty acid,FFA)水平。
1.2.3HE染色16周后取各组小鼠附睾周围脂肪组织,4%多聚甲醛固定,固定效果满意后进行组织脱水透明、石蜡包埋、切片等处理,按照HE染色试剂盒说明书进行染色,封片晾干,40倍光学显微镜下观察各组脂肪组织脂肪细胞形态变化。
1.2.4Western blot 16周后断头处死小鼠,速取各组小鼠附睾脂肪组织放入事先标记的洁净EP管,每组选取8份样本进行称重(多余的-80℃储存备用)。加入裂解液(RIPA∶PMSF=100∶1),冰上剪碎后4℃静置30 min,组织超声(10 s×3次),4℃离心(12 000 r/min,25 min),取中层液体,按BCA蛋白定量试剂盒说明测定各组样品蛋白浓度,调整终浓度至2 mg/ml,100℃水浴蛋白制样,15~20 μl/孔上样进行SDS-PAGE凝胶电泳,转至0.45 μm或0.22 μm PVDF膜,5%脱脂奶粉室温封闭2 h,1×TBST清洗(5 min×3次),加入相应蛋白一抗4℃过夜孵育,次日清洗后加相应辣根过氧化物酶标记的山羊抗兔/鼠二抗室温孵育2 h,1×TBST清洗(5 min×3次),GISt020凝胶图像分析仪成像,Image J软件分析各蛋白与相应β-actin条带灰度值,计算比值反映各组蛋白表达。
1.2.5ELISA收取各组小鼠血清按相应ELISA试剂盒说明依次检测单细胞趋化因子-1(monocyte chemotactic protein 1,MCP-1)、IL-6、TNF-α和IL-10表达。
1.3统计学分析采用SPSS22.0软件进行统计学分析,符合正态分布的计量资料以±s表示,多组间比较采用单因素方差(One-Way ANOVA)分析,两两比较采 用Turkey检验,P<0.05为差异有统计学意义。
2 结果
2.1TLR4基因敲除降低高脂饮食诱导的肥胖小鼠体质量建模前各组4周龄小鼠体质量差异无统计学意义,饲养16周后,与NC组相比,OB组小鼠体质量明显增加(P<0.01),TK组小鼠体质量明显降低(P<0.05);与OB组相比,TO组小鼠体质量明显降低(P<0.01,图1)。
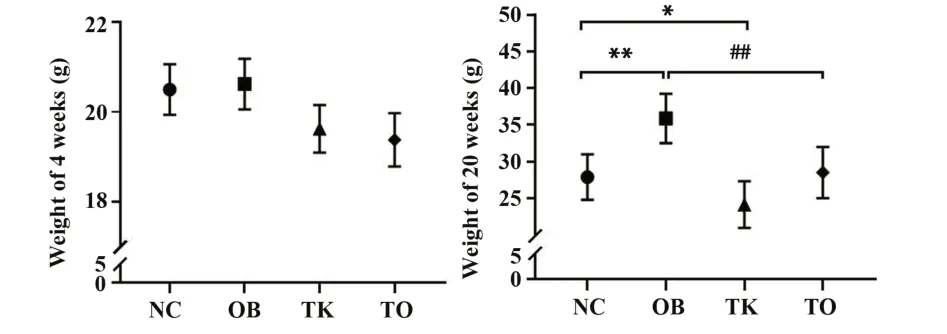
图1 各组小鼠体质量比较Fig.1 Comparison of body weight among different groups in mice
2.2TLR4基因改善高脂饮食诱导的肥胖小鼠脂代谢紊乱16周后,NC组相比,OB组小鼠血清FPG、TC、TG、LDL和FFA水平明显升高(P<0.01),HDL水平明显降低(P<0.01),TLR4基因敲除组FPG、TC、TG、LDL和FFA水平明显降低(P<0.01,P<0.05),HDL水平明显升高(P<0.01);与OB组相比,TK组和TO组小鼠血清FPG、TC、TG、LDL和FFA水平明显降低(P<0.01),HDL水平明显升高(P<0.01,P<0.05,表1)。
表1 各组小鼠16周后血生化指标比较(±s,n=8)Tab.1 Comparison of blood biochemical indexes among different groups after 16 weeks in mice(±s,n=8)
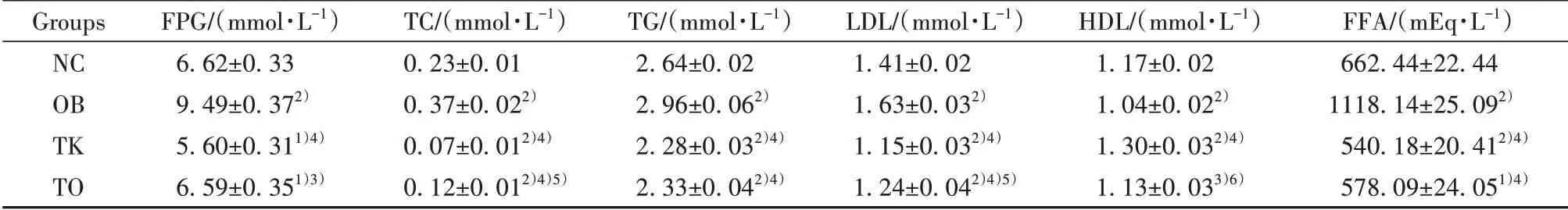
表1 各组小鼠16周后血生化指标比较(±s,n=8)Tab.1 Comparison of blood biochemical indexes among different groups after 16 weeks in mice(±s,n=8)
Note:Compared with NC group,1)P<0.05,2)P<0.01;compared with OB group,3)P<0.05,4)P<0.01;compared with TK group,5)P<0.05,6)P<0.01.
Groups NC OB TK TO FPG/(mmol·L-1)6.62±0.33 9.49±0.372)5.60±0.311)4)6.59±0.351)3)TC/(mmol·L-1)0.23±0.01 0.37±0.022)0.07±0.012)4)0.12±0.012)4)5)TG/(mmol·L-1)2.64±0.02 2.96±0.062)2.28±0.032)4)2.33±0.042)4)LDL/(mmol·L-1)1.41±0.02 1.63±0.032)1.15±0.032)4)1.24±0.042)4)5)HDL/(mmol·L-1)1.17±0.02 1.04±0.022)1.30±0.032)4)1.13±0.033)6)FFA/(mEq·L-1)662.44±22.44 1118.14±25.092)540.18±20.412)4)578.09±24.051)4)
2.3TLR4基因敲除缓解高脂饮食诱导的肥胖小鼠脂肪细胞变大16周后,HE染色结果显示,NC组小鼠脂肪细胞排列紧密,细胞大小、形态较均一,呈多边形或圆形。与NC组相比,OB和TO组小鼠脂肪细胞明显增大,形态不规则,呈大空泡状,细胞壁变薄,细胞间隙明显增宽,提示高脂饮食可诱导小鼠脂肪细胞肥大;与OB组相比,TK组和TO组小鼠脂肪细胞明显减小,细胞间隙变窄(图2)。
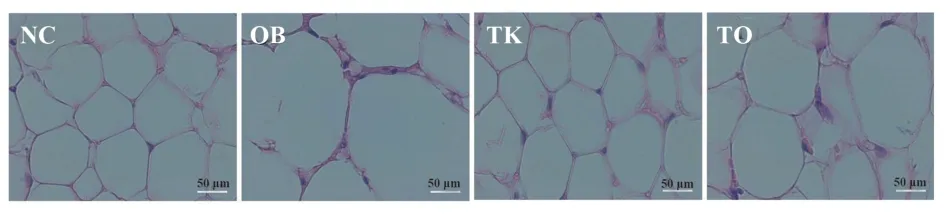
图2 各组小鼠16周后附睾脂肪组织形态变化(HE染色,×400)Fig.2 Morphological changes of epididymal adipose tissue among different groups after 16 weeks in mice(HE staining,×400)
2.4TLR4基因敲除降低高脂饮食诱导的肥胖小鼠脂肪组织TLR4、MyD88表达,增加p-AMPKα蛋白表达16周后,Western blot结果显示,各组总AMPKα表达差异无统计学意义,与NC组相比,OB组小鼠脂肪 组织TLR4、MyD88表达明 显增 加(P<0.01),p-AMPKα蛋白表达明显减少(P<0.05)。TK组小鼠MyD88蛋白明显减少(P<0.01),p-AMPKα蛋白表达明显增加(P<0.05);与OB组相比,TO组小鼠脂肪组 织TLR4、MyD88表 达 明 显 减 少(P<0.01),p-AMPKα表达明显增加(P<0.05,图3)。
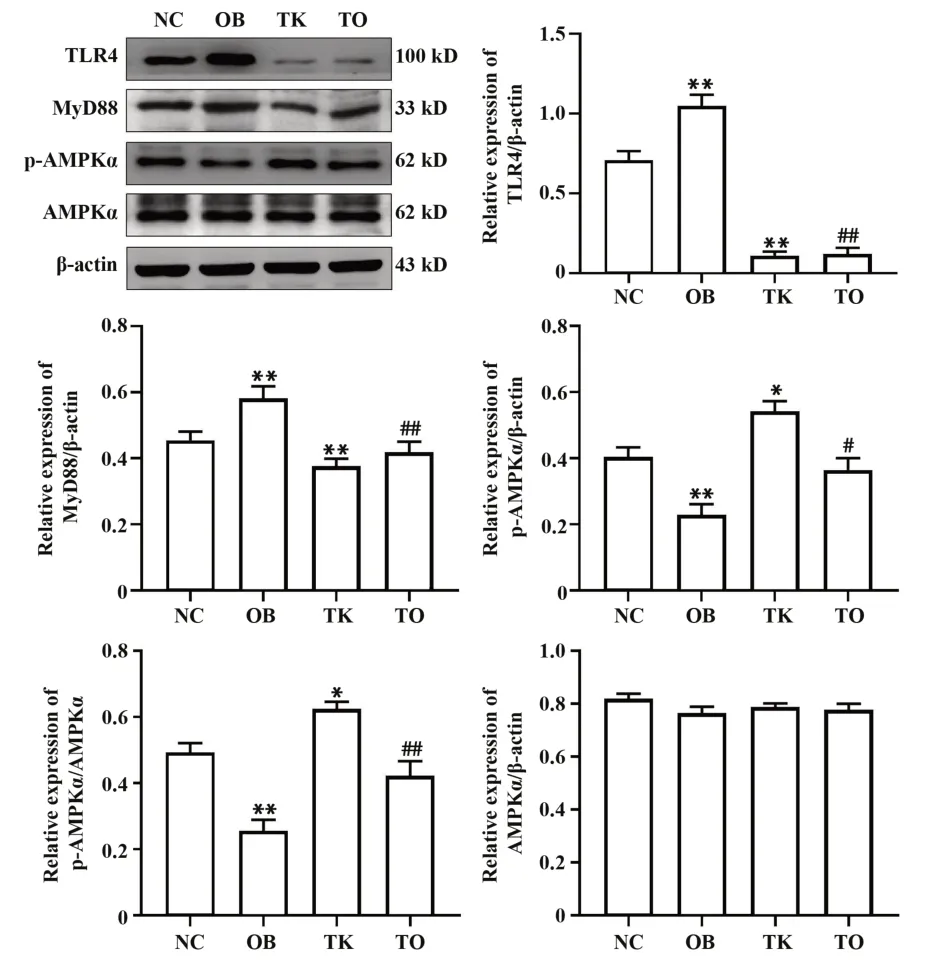
图3 各 组 小 鼠16周 后TLR4、MyD88、p-AMPKα和AMPKα蛋白表达Fig.3 Expressions of TLR4,MyD88,p-AMPKα and AMPKα among different groups after 16 weeks in mice
2.5TLR4基因敲除缓解高脂饮食诱导的肥胖小鼠慢性炎症反应16周后,NC组相比,OB组小鼠血清MCP-1、IL-6和TNF-α表达明显上升(P<0.01),IL-10表达明显降低(P<0.05),TK组小鼠血清MCP-1、IL-6和TNF-α水平显著降低(P<0.01,P<0.05),IL-10表达明显升高(P<0.01);与OB组相比,TO组小鼠血清MCP-1、IL-6和TNF-α表达明显降低(P<0.01),IL-10表达显著升高(P<0.01,图4)。
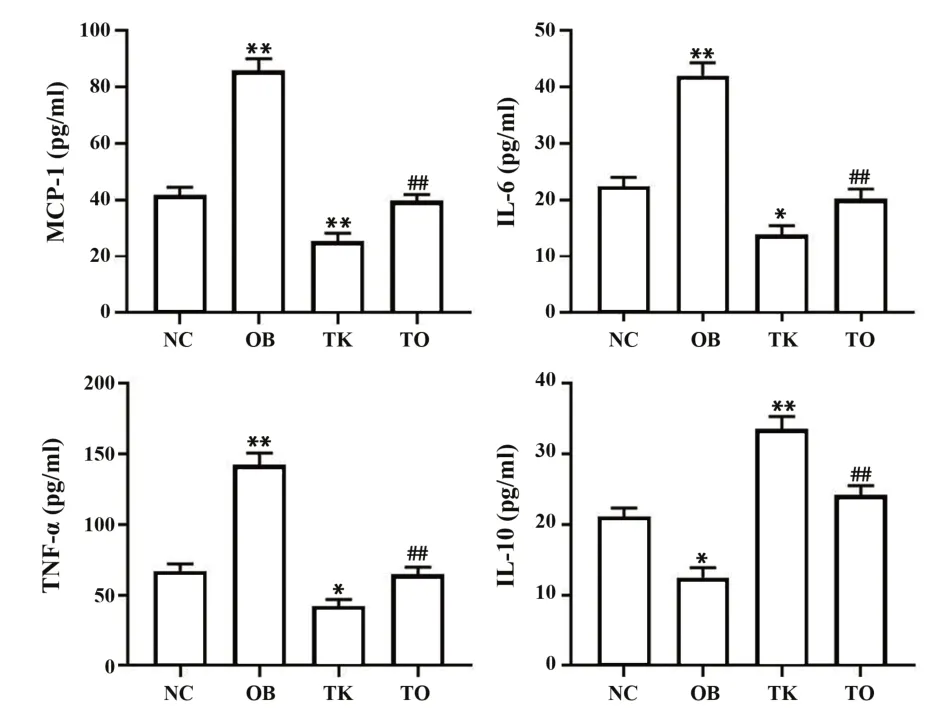
图4 各组小鼠16周后炎症指标变化Fig.4 Changes of inflammatory indexes among different groups after 16 weeks in mice
2.6TLR4基因敲除降低高脂饮食诱导的肥胖小鼠脂肪细胞凋亡水平16周后,Western blot结果显示,与NC组相比,OB组小鼠脂肪组织Bax蛋白表达明显增加(P<0.01),Bcl-2蛋白表达明显降低(P<0.05),TK组小鼠Bax蛋白明显减少(P<0.05),Bcl-2蛋白表达明显增加(P<0.05);与OB组相比,TO组小鼠脂肪组织Bax表达明显减少(P<0.01),Bcl-2表达明显增加(P<0.05,图5)。
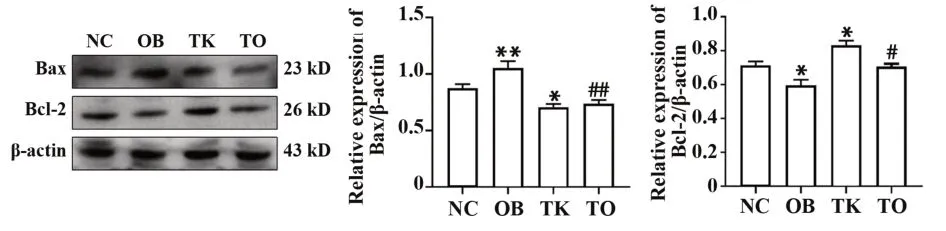
图5 各组小鼠16周后Bax和Bcl-2蛋白表达Fig.5 Expressions of Bax and Bcl-2 among different groups after 16 weeks in mice
3 讨论
肥胖作为高血压、糖尿病等慢性病的主要危险因素,对社会居民健康状态造成严重威胁[13-14]。因此深入探索肥胖的可能病理机制对临床抗肥胖药物开发具有现实指导意义。本研究首次证实了TLR4可通过MyD88依赖的AMPK通路调节高脂诱导的肥胖小鼠脂肪组织慢性炎症和细胞凋亡。
1993年,HOTAMISLIGIL等[15]首次发现肥胖动物模型体内脂肪组织TNF-α分泌增加进而将肥胖与炎症密切相关联,近年越来越多有关肥胖的研究均集中在免疫炎症领域,肥胖作为慢性炎症性疾病的观点已得到共识。因此,认识免疫炎症与代谢的关系可能为临床治疗肥胖提供方向。脂肪组织巨噬细胞(adipose tissue macrophages,ATM)是肥胖动物体内诱导脂肪组织慢性炎症的最主要炎症细胞,主要分为促炎经典活化型(M1型)和抗炎替代活化型(M2型)[16]。前者可通过分泌炎症细胞因子(如IL-6、TNF-α)和趋化因子(如MCP-1)等促进脂肪组织炎症反应进程,诱导胰岛素抵抗,但过表达MCP-1又会促进ATM聚集,刺激M2向M1型转换,诱导炎症级联放大效应,M2型巨噬细胞可分泌IL-10抑制炎症反应[17-18]。因此,抑制肥胖机体脂肪组织促炎因子释放和促进抗炎因子分泌可有效缓解慢性炎症诱导的机体组织损害,阻碍肥胖导致的一系列慢性病发生。本研究显示,相比于正常饲料喂养小鼠,高脂诱导的肥胖小鼠脂肪细胞明显增大,分泌更多的IL-6、TNF-α和MCP-1等炎症因子,诱导脂肪组织炎症反应,进一步证实了肥胖与脂肪组织慢性炎症的关联。
TLR4是一种与免疫或炎症性疾病关系密切的模式识别受体,主要在淋巴细胞、巨噬细胞、内皮细胞及心肌细胞等细胞中表达。肥胖机体血清FFA明显增多,FFA可刺激脂肪组织TLR4样受体进而层层激活下游炎症因子表达。MyD88是一种髓样蛋白分子,也是TLRs通路最重要的一种接头蛋白,除TLR3外,MyD88参与了TLRs家族其他所有成员介导的炎症信号转导[19]。激活的TLR4能够活化下游信号因子MyD88促进炎症因子释放,触发正向免疫炎症反应[3-6],与本研究结果一致。AMPK作为重要的细胞代谢感受器,研究显示AMPK在肥胖诱导的脂肪组织炎症中发挥重要作用,活化后的AMPK可促进M1型巨噬细胞向M2型转化,减少炎症因子释放,促进抗炎因子分泌,进而有效发挥抗炎效应[7,9-10]。既往研究证实TLR4与AMPK存在一定联系,WANG等[20]研究显示,AMPK作为TLR4的信号下游分子参与2型糖尿病脂质代谢及胰岛素抵抗调节。SORAYA等[21-22]发现短期和长期二甲双胍治疗可通过有效抑制TLR4/MyD88活性上调磷酸化AMPKα表达进而抑制心肌梗死导致的心功能不全,改善心功能,JING等[23]的体外实验也证明TLR4/MyD88抑制可缓解硫辛酸诱导的AMPK下调。此外,课题组近期研究也证实TLR4基因敲除可通过激活肥胖小鼠骨骼肌组织AMPK磷酸化减少脂肪酸合成,增强脂肪酸β-氧化,进而影响骨骼肌能量代谢及血脂代谢水平[24]。可见TLR4/MyD88抑制可通过正向调控AMPK活性参与炎症反应调节。本研究显示,磷酸化的AMPKα在高脂喂养组小鼠中表达明显下降,TLR4基因敲除后,磷酸化的AMPKα表达明显上升,同时伴随促炎因子MCP-1、IL-6和TNF-α表达明显减少和抑炎因子IL-10明显增多,以及促凋亡相关蛋白Bax表达明显降低。可见TLR4/MyD88可通过AMPK蛋白参与高脂诱导的肥胖小鼠慢性炎症及凋亡水平调控,这一发现为临床发掘有效抗肥胖药物提供了新思路。但本研究的不足之处在于缺乏体外相关细胞实验的佐证。因此,课题组后续将会选择肥胖模型细胞,借助TLR4基因敲除和转染等实验进一步证实。

