牛膝-白芍对肝阳上亢型帕金森病小鼠脑组织氧化应激的影响Δ
荣华,张静艳,刘京,张晓杰#(.黑龙江中医药大学基础医学院,哈尔滨 50040;.齐齐哈尔医学院病理学院,黑龙江 齐齐哈尔 6006)
帕金森病(Parkinson’s disease,PD)是一种中枢神经系统退行性疾病,多发于中老年人群,常伴有运动缺陷症状,黑质致密部多巴胺能神经元的丢失以及路易小体的形成是该疾病的典型病理特征[1]。目前,除首选外源性补充多巴胺来治疗PD外,中医药防治PD具有独特优势[2]。中医学认为PD病机以肝肾为本,肝风内动为标[3]。震颤和身体摇动是中医藏象学说中肝风内动的病理表现,肝阳上亢证是PD的主要证型,治以补肾柔肝、潜阳熄风[4]。以往研究采用单一的PD病理学模型,这很难体现抗PD中药病证兼顾的作用特点。
镇肝熄风汤为《医学衷中参西录》中的经典方剂,在治疗肝阳上亢型PD中有着显著效果[5],但是其复方成分繁多,药味之间关系作用复杂,研究难度较大。牛膝-白芍作为镇肝熄风汤的核心药对,在治疗PD的方剂中出现较多,牛膝补益肝肾、引火下行,白芍养血濡筋、缓急止痉,两药成对,可奏补肾柔肝、潜阳熄风之功[6]。本课题组前期研究结果提示,在体外实验中牛膝和白芍的有效成分可抑制氧化应激的发生,对多巴胺能神经元具有协同增效的保护作用[7]。基于此,本研究采用病证结合的动物模型,探讨牛膝-白芍药对对肝阳上亢型PD小鼠脑组织氧化应激的影响,旨在为该药对治疗PD的机制研究提供参考。
1 材料
1.1 主要仪器
本研究所用主要仪器有Stratagene Mx3005P型实时荧光定量PCR仪(美国Agilent公司),ELX800型全自动酶标仪(美国BioTek公司),JY-ZY2型转移电泳槽、JYCZ1型单垂直电泳槽(北京君意东方电泳设备有限公司),CKX41型倒置显微镜(日本Olympus公司),HT7800型透射电子显微镜(日本Hitachi公司)等。
1.2 主要药品与试剂
附子、牛膝、白芍饮片(批号分别为000001294、001001502、001001168)均购于北京同仁堂(亳州)饮片有限责任公司,经齐齐哈尔医学院医药科学研究院李晓明副研究员鉴定均为真品。1-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP,批号M0896)购于美国Sigma公司;兔源酪氨酸羟化酶(tyrosine hydroxylase,TH)抗体(批号J5248)购于美国Santa Cruz公司;兔源硫氧还蛋白还原酶1(thioredoxin reductase 1,Trxr1)、核纤层蛋白B(lamin B)、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体(批号分别为 1、1345S、2118S)均购于美国Cell Signaling Technology公司;兔源硫氧还蛋白互作蛋白(thioredoxin interacting protein,Txnip)、核因子 E2相关因子 2(nuclear factorerythroid 2-related factor 2,Nrf2)抗体(批号分别为ab188865、ab137550)均购于英国Abcam公司;生物素标记的山羊抗兔免疫球蛋白G(IgG)二抗、SP免疫组化法试剂盒(批号分别为00051405、0011404)均购于北京康为世纪生物科技有限公司;总抗氧化能力(total antioxidant capacity,T-AOC)检测试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)活性检测试剂盒及丙二醛(malondialdehyde,MDA)含量检测试剂盒(批号分别为BC1315、BC0170、BC0020)均购于北京索莱宝科技有限公司;引物由生工生物工程(上海)股份有限公司设计,具体见表1。

表1 Nrf 2等引物序列和扩增产物片段长度
1.3 动物
C57BL/6雄性小鼠,共60只,3月龄,体质量(25±2)g,由南京大学-南京生物医药研究院提供,动物生产许可证号为SCXF(苏)2015-0001。本实验方案经齐齐哈尔医学院伦理委员会审查批准,批件号为(齐)伦审〔2021〕127号。
2 方法
2.1 药液的制备
分别取附子、牛膝、白芍饮片,按照传统煎药法制备附子、牛膝、白芍、牛膝-白芍药对煎液,质量浓度分别为0.20、0.33、0.17、0.50 g/mL(以生药量计,下同)。镇肝熄风汤参考文献[8]制备,质量浓度为1.67 g/mL,于4℃保存备用。
2.2 动物分组、造模及给药
将小鼠随机分为正常对照组、模型组、镇肝熄风汤组(25 g/kg)、牛膝组(4.5 g/kg)、白芍组(2.3 g/kg)及牛膝-白芍药对组(6.8 g/kg),每组10只。除正常对照组外,其他组采用附子煎液(4 g/kg)灌胃给药4周复制肝阳上亢型小鼠模型;附子灌胃结束后,腹腔注射MPTP(25 mg/kg)7 d,复制肝阳上亢型PD小鼠模型。在每次注射MPTP1 h后,除正常对照组和模型组小鼠灌胃生理盐水外,其余各组小鼠分别灌胃对应药液,在MPTP腹腔注射7 d后,继续给予7 d,给药剂量参考文献[9]设置。
2.3 小鼠行为学检测
2.3.1 易激惹程度评分 参考文献[10],造模结束后,对小鼠易激惹程度进行评分。Ⅰ级:捉持颈部时尖叫、惊跳;Ⅱ级:捉持颈部时咬人;Ⅲ级:提尾时尖叫、惊跳甚至咬人或与同笼小鼠频繁打斗;上述情况不明显为0级。
2.3.2 麻痹震颤评分 参考文献[11],造模结束后,对小鼠麻痹震颤进行评分。0分:与正常小鼠相似,无任何症状;1分:出现竖毛、弓背、间断性细小震颤,但活动自如;2分:出现吞咽频繁,频繁性震颤,后肢张开,颤尾,活动逐渐受限;3分:出现流涎,持续性震颤,四肢僵硬,活动受限;4分:因全身麻痹而死亡。
2.3.3 悬挂实验评分 参考文献[12],造模结束后,将各组小鼠倒置悬挂在长为30 cm、高为25 cm的铁丝上,将两前爪置于铁丝中点处,而后放开小鼠,如小鼠双后爪抓住铁丝则得0分,如小鼠后爪反复抓取铁丝且可间断抓握则得0.5分,如小鼠单只后爪抓握铁丝则得1分,如小鼠双后爪均不能抓握铁丝则得2分,检测时间为2 min。
2.3.4 游泳实验评分 参考文献[13],造模结束后,将各组小鼠放置于40 cm×30 cm×20 cm规格的水箱中,水温为(25±2)℃,水深为15 cm,记录小鼠3 min内的漂浮时间。评分标准为:漂浮0~30 s,记0分;漂浮31~90 s,记1分;漂浮91~150 s,记2分;漂浮151~180 s,记3分。
2.4 小鼠脑黑质神经元的超微结构观察
药物干预结束后,每组随机取5只小鼠,处死后,冰上快速取小鼠脑黑质,大小约1 mm3,将脑黑质置于2.5%戊二醛溶液中4℃固定过夜,乙醇、丙酮梯度脱水,环氧丙酮、环氧树脂浸透,环氧树脂包埋,制备半薄切片和超薄切片,进行双重染色,于透射电子显微镜下观察小鼠脑黑质神经元的超微结构变化。
2.5 小鼠脑黑质区TH阳性神经元的检测
采用SP免疫组化法进行检测。取“2.4”项下脑黑质适量,固定于4%多聚甲醛溶液中,4℃保存72 h,脱水浸蜡后进行石蜡包埋,制备冠状切片,脱蜡、水化处理后,抗原修复,滴加TH抗体(稀释比例为1∶100),孵育过夜;磷酸盐缓冲液漂洗后滴加二抗孵育10 min,DAB工作液显色后经苏木精复染,清水充分清洗反蓝,中性树胶封片。在显微镜下观察小鼠脑黑质区TH阳性神经元的表达情况,采集图片,使用Image-Pro Plus 6.0软件计算平均光密度(平均光密度值越高表示TH阳性神经元表达越强)。
2.6 小鼠脑黑质相关氧化应激指标的检测
采用生物化学法进行检测。取剩余5只小鼠,处死后,冰上快速取小鼠脑黑质,与“2.4”项下脑黑质合并,并滴加预冷的生理盐水制备组织匀浆液,低温离心后取上清液,依据相关试剂盒说明书测定T-AOC、MDA的含量及SOD活性。
2.7 小鼠脑黑质中Nrf2、Trxr1和Txnip mRNA表达的检测
采用实时荧光定量PCR法进行检测。取“2.6”项下脑黑质适量,使用Trizol试剂提取脑黑质总RNA,反转录合成cDNA,以cDNA为模板进行PCR扩增。PCR反应体系为:cDNA模版2 μL,dNTP溶液1.6 μL,上、下游引物各 0.8 μL,BeyoTaq Buffer 2 μL,BeyoTaq DNA Polymerase 0.1 μL,加双蒸水至20 μL。PCR反应条件为:95℃预变性4 min;95℃变性20 s,60℃退火30 s,72 ℃延伸30 s,共40个循环。采用2-ΔΔCt法计算Nrf2、Trxr1和Txnip mRNA的相对表达量。
2.8 小鼠脑黑质中Nrf2、Trxr1和Txnip蛋白表达的检测
采用Western blot法进行检测。取“2.6”项下脑黑质适量,提取各组小鼠脑黑质总蛋白,用BCA法检测蛋白含量,将蛋白变性后经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离,转膜,封闭,加入Nrf2、Trxr1、Txnip、lamin B和GAPDH抗体(稀释比例均为1∶1 000),4℃过夜;加入生物素标记的IgG二抗(稀释比例为1∶1 000),于室温下孵育2 h,TBST洗膜后进行ECL化学发光反应,使用Image J软件对免疫印迹条带进行密度扫描。以Nrf2与内参蛋白lamin B,Trxr1、Txnip与内参蛋白GAPDH灰度值的比值表示Nrf2、Trxr1和Txnip蛋白的表达水平。
2.9 统计学分析
使用SPSS 20.0软件进行统计分析。计量资料以±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,等级资料采用Ridit分析,检验水准α=0.05。
3 结果
3.1 牛膝-白芍药对对肝阳上亢型PD小鼠易激惹程度的影响
与正常对照组比较,模型组小鼠性情暴躁,易激惹程度Ⅱ、Ⅲ级小鼠只数显著增加(P<0.05);与模型组比较,各给药组易激惹程度Ⅰ级小鼠只数均增加,Ⅱ、Ⅲ级小鼠只数均减少,大部分组别均有统计学差异(P<0.05);牛膝-白芍药对组易激惹程度Ⅰ、Ⅱ、Ⅲ级小鼠只数与镇肝熄风汤组、牛膝组、白芍组比较差异均无统计学意义(P>0.05)。结果见表2。

表2 各组小鼠行为学检测结果
3.2 牛膝-白芍药对对肝阳上亢型PD小鼠麻痹震颤水平的影响
与正常对照组比较,模型组小鼠麻痹震颤情况严重,得分显著升高(P<0.05);与模型组比较,各给药组小鼠麻痹震颤情况均有不同程度改善,得分均显著降低(P<0.05);牛膝-白芍药对组小鼠得分均显著低于牛膝组、白芍组(P<0.05),与镇肝熄风汤组比较差异无统计学意义(P>0.05)。结果见表2。
3.3 牛膝-白芍药对对肝阳上亢型PD小鼠悬挂实验和游泳实验评分的影响
与正常对照组比较,模型组小鼠悬挂实验和游泳实验得分均显著升高(P<0.05);与模型组比较,各给药组小鼠悬挂实验和游泳实验得分均显著降低(P<0.05);牛膝-白芍药对组小鼠得分均显著低于牛膝组、白芍组(P<0.05),与镇肝熄风汤组比较差异无统计学意义(P>0.05)。结果见表2。
3.4 牛膝-白芍药对对肝阳上亢型PD小鼠脑黑质神经元超微结构的影响
正常对照组小鼠脑黑质神经元细胞核清晰可见,游离核糖体丰富,线粒体结构清晰,内质网结构正常。模型组小鼠脑黑质神经元细胞核固缩,核周隙增宽,线粒体肿胀,游离核糖体减少,内质网扩张。与模型组比较,镇肝熄风汤组小鼠脑黑质神经元细胞核形态较规则,细胞器结构较完好;牛膝组和白芍组小鼠脑黑质核固缩减轻不明显;牛膝-白芍药对组小鼠脑黑质核固缩减轻,细胞器结构逐渐恢复。结果见图1(图中箭头指向细胞核变化部位)。

图1 各组小鼠脑黑质神经元超微结构图(×13 000)
3.5 牛膝-白芍药对对肝阳上亢型PD小鼠脑黑质区TH阳性神经元表达的影响
与正常对照组比较,模型组小鼠脑黑质区TH阳性神经元表达水平显著降低(P<0.05);与模型组比较,各给药组小鼠脑黑质区TH阳性神经元表达水平均显著升高(P<0.05);牛膝-白芍药对组小鼠脑黑质区TH阳性神经元表达水平均显著高于牛膝组、白芍组(P<0.05),与镇肝熄风汤组比较差异无统计学意义(P>0.05)。结果见表3。
表3 各组小鼠脑黑质区TH阳性神经元表达结果(±s,n=5)
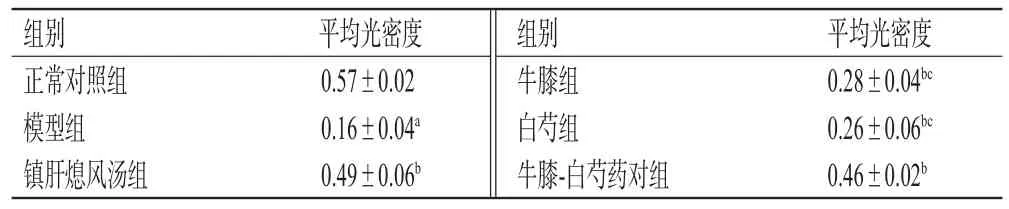
表3 各组小鼠脑黑质区TH阳性神经元表达结果(±s,n=5)
a:与正常对照组比较,P<0.05;b:与模型组比较,P<0.05;c:与牛膝-白芍药对组比较,P<0.05
平均光密度0.28±0.04bc 0.26±0.06bc 0.46±0.02b组别正常对照组模型组镇肝熄风汤组平均光密度0.57±0.02 0.16±0.04a 0.49±0.06b组别牛膝组白芍组牛膝-白芍药对组
3.6 牛膝-白芍药对对肝阳上亢型PD小鼠脑黑质氧化应激指标的影响
与正常对照组比较,模型组小鼠脑黑质中T-AOC和SOD表达水平均显著降低,MDA表达水平显著升高(P<0.05);与模型组比较,各给药组(除白芍组外)小鼠脑黑质中T-AOC和SOD表达水平均显著升高,MDA表达水平均显著降低(P<0.05);牛膝-白芍药对组小鼠脑黑质中T-AOC和SOD表达水平均显著高于牛膝组、白芍组,MDA表达水平均显著低于牛膝组、白芍组(P<0.05),上述指标与镇肝熄风汤组比较差异均无统计学意义(P>0.05)。结果见表4。
表4 各组小鼠脑黑质氧化应激指标结果(±s,n=10)

表4 各组小鼠脑黑质氧化应激指标结果(±s,n=10)
a:与正常对照组比较,P<0.05;b:与模型组比较,P<0.05;c:与牛膝-白芍药对组比较,P<0.05
MDA/(mol/mg)7.12±1.53 17.28±5.24a 9.61±1.26b 13.44±3.21bc 15.47±5.10c 10.07±2.54b组别正常对照组模型组镇肝熄风汤组牛膝组白芍组牛膝-白芍药对组T-AOC/(mol/mg)1.75±0.24 0.52±0.10a 1.38±0.35b 0.81±0.33bc 0.60±0.17c 1.34±0.28b SOD/%100.00 35.24±13.26a 69.09±8.41b 50.21±10.63bc 41.24±7.15c 68.96±6.38b
3.7 牛膝-白芍药对对肝阳上亢型PD小鼠脑黑质中Nrf2、Trxr1、Txnip mRNA和蛋白表达的影响
与正常对照组比较,模型组小鼠脑黑质中Nrf2、Trxr1 mRNA相对表达量和蛋白表达水平差异均无统计学意义(P>0.05),Txnip mRNA相对表达量和蛋白表达水平均显著升高(P<0.05);与模型组比较,各给药组小鼠脑黑质中Nrf2、Trxr1 mRNA相对表达量和蛋白表达水平均显著升高,Txnip mRNA相对表达量和蛋白表达水平均显著降低(P<0.05);牛膝-白芍药对组小鼠脑黑质中Nrf2、Trxr1 mRNA相对表达量和蛋白表达水平均显著高于牛膝组、白芍组,Txnip mRNA相对表达量和蛋白表达水平均显著低于牛膝组、白芍组(P<0.05),上述指标与镇肝熄风汤组比较差异均无统计学意义(P>0.05)。结果见表5、图2。
表5 各组小鼠脑黑质中Nrf2、Trxr1、Txnip mRNA和蛋白表达结果(±s,n=5)
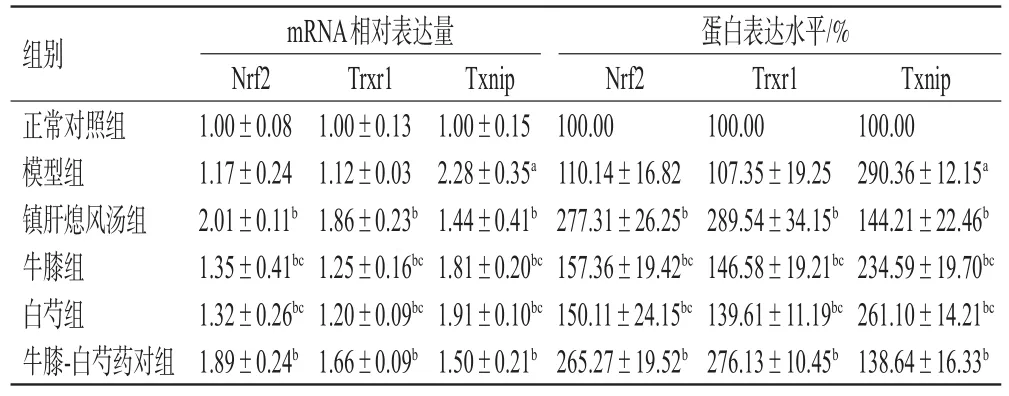
表5 各组小鼠脑黑质中Nrf2、Trxr1、Txnip mRNA和蛋白表达结果(±s,n=5)
a:与正常对照组比较,P<0.05;b:与模型组比较,P<0.05;c:与牛膝-白芍药对组比较,P<0.05
组别正常对照组模型组镇肝熄风汤组牛膝组白芍组牛膝-白芍药对组mRNA相对表达量Nrf2 1.00±0.08 1.17±0.24 2.01±0.11b 1.35±0.41bc 1.32±0.26bc 1.89±0.24b Trxr1 1.00±0.13 1.12±0.03 1.86±0.23b 1.25±0.16bc 1.20±0.09bc 1.66±0.09b Txnip 1.00±0.15 2.28±0.35a 1.44±0.41b 1.81±0.20bc 1.91±0.10bc 1.50±0.21b蛋白表达水平/%Nrf2 100.00 110.14±16.82 277.31±26.25b 157.36±19.42bc 150.11±24.15bc 265.27±19.52b Trxr1 100.00 107.35±19.25 289.54±34.15b 146.58±19.21bc 139.61±11.19bc 276.13±10.45b Txnip 100.00 290.36±12.15a 144.21±22.46b 234.59±19.70bc 261.10±14.21bc 138.64±16.33b
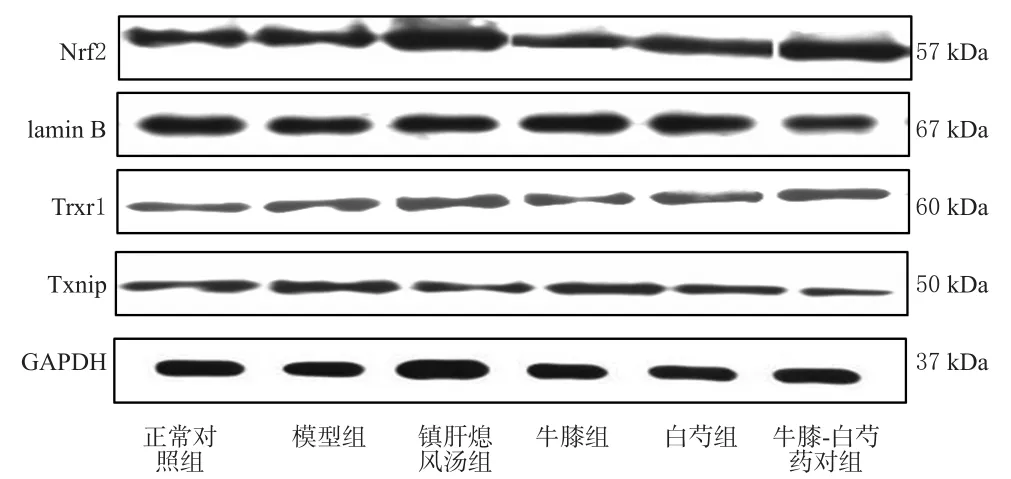
图2 各组小鼠脑黑质中Nrf2、Trxr1、Txnip蛋白表达电泳图
4 讨论
中医学认为PD属于“颤证”范畴,早在《黄帝内经》就有“诸风掉眩、皆属于肝”的描述[14]。肝阳上亢是PD常见证候,附子味辛干,大热,久用耗伤精血,夺肝肾之阴而使肝肾阴虚,阴不潜阳而肝阳偏亢,因此灌服附子可复制肝阳上亢模型[15]。MPTP可引起灵长类和啮齿类动物脑黑质和纹状体区多巴胺能神经元死亡,这与PD的病理改变类似[16]。本研究采用附子煎液联合MPTP诱导复制肝阳上亢型PD小鼠模型,用于考察牛膝-白芍药对PD的干预作用,充分体现了中医辨病与辨证结合的特色。
临床研究报道,镇肝熄风汤防治肝阳上亢型PD效果明显[17],但是中药复方复杂,导致中医方剂内涵实质难以被揭示。药对是方剂组成的最小单位,也是方剂配伍的精华与核心所在。牛膝-白芍是镇肝熄风汤的核心药对:牛膝补益肝肾、引火下行,在抗氧化及免疫调节方面有一定功效;白芍养血濡筋、缓急止痉,有较好的神经保护及抗炎作用[18],两药联用起到与镇肝熄风汤相似的抗PD作用和“镇肝熄风”作用。TH作为检测多巴胺能神经元的金标准,可以反映出神经元的位置和数量,用来判断MPTP诱导的PD模型的严重程度[19]。本研究发现,与模型组比较,牛膝-白芍药对能够显著改善模型小鼠易激惹的程度,减轻麻痹震颤现象,增加小鼠悬挂和游泳的时间,增加小鼠脑黑质区TH阳性神经元表达水平,对细胞核的超微结构变化所有改善,且牛膝-白芍药对的效果强于牛膝、白芍单味药材,与镇肝熄风汤的效果相近。
有关报道阐述,氧化应激损伤是导致PD等诸多神经退行性疾病发病的关键因素[20]。T-AOC、SOD和MDA是反映氧化应激的常用检测指标,能够表达抗氧化损伤的能力及氧化损伤的程度[21]。本研究发现,与正常对照组比较,肝阳上亢型PD小鼠脑黑质中T-AOC和SOD的表达水平均显著降低,而MDA表达水平显著升高,说明模型小鼠脑氧化损伤程度较高;而各给药组可抑制肝阳上亢型PD小鼠发生氧化应激,且牛膝-白芍药对的效果强于牛膝、白芍单味药材,与镇肝熄风汤的效果相近。
Nrf2是调节氧化应激反应的关键因子,能够激活内源性抗氧化应答,是抗氧化还原的中枢调节者[22]。Trxr1具有调节氧化还原、激活转录因子和防治PD等多种生物活性,Nrf2可直接与Trxr1启动子区域的抗氧化反应元件结合从而促进Trxr1表达[23]。Txnip是氧化应激效应途径中的一个关键调控蛋白,过度表达时可使细胞更易发生氧化应激甚至凋亡[24]。在本研究中发现,肝阳上亢型PD小鼠脑黑质中Nrf2和Trxr1表达水平与正常对照组比较均无显著差异,Txnip表达升高,而牛膝-白芍药对可上调肝阳上亢型PD小鼠脑黑质中Nrf2、Trxr1的表达水平,下调负反馈因子Txnip的表达水平,这说明牛膝-白芍药对可调控上述因子的表达,从而起到抗PD的作用。
综上所述,牛膝-白芍药对具有改善肝阳上亢型小鼠PD样行为的作用,可能以Nrf2为靶点抑制肝阳上亢型PD小鼠脑组织氧化应激水平,对脑部神经起到保护作用,且效果优于牛膝、白芍单味药材,能够发挥与组方相当的补肾柔肝、潜阳熄风的功效。

