桔小实蝇体内三种重要生长激素及其相互影响研究
吴怡蓓
(铜仁学院 贵州铜仁 554300)
桔小实蝇(Bactrocera dorsalisHendel)属双翅目实蝇科果实蝇属[1],又名针蜂等,原产于日本九州,在我国最先发现于云贵高原,是危害性极高的国家二类检疫性害虫。近年来,桔小实蝇在我国西南区域大面积爆发,引发惨重的经济亏损,成为相关领域研究的“新宠”。对桔小实蝇的防控目前仍然主要采用化学药物防控手段,然而由于长期不规范地大范围使用杀虫剂,使其产生了强抗药性,只得加大用药量。为了缓解此类恶性循环,需要加快绿色试剂的研制。目前,对桔小实蝇的研究已经从单学科独立研究深入到多学科交叉并辅以多种技术,防控切入点从外部环境转移至害虫的内环境,其中生长发育所需的重要激素成为研究首选[2]。
蜕皮激素(molting hormone, MH),在昆虫体内受脑神经分泌到血淋巴的PTTH的调节与控制,存储于中肠、马氏管和脂肪体等组织中,能通过一定途径诱导细胞程序化死亡和自噬而调节蜕皮、决定虫体的大小和形态变化,并使组织细胞更新、产生新功能,当保幼激素浓度为零时,可加快幼虫的内部器官的功能分化,发生变态,成虫蜕皮,被广泛应用于化妆品、药物保健、病虫害防治、养殖业等[3-5]。蜕皮激素能够诱导幼虫周期性蜕皮和化蛹,除了促进成虫翅的发育和分化外,对成虫繁殖、滞育及胚后发育等也起着调节作用,并能刺激其脑细胞的增生和卵黄蛋白的合成[6]。保幼激素(juvenile hormone, JH),具有维持幼虫体征,保持前胸腺,影响昆虫生殖的作用。JH作为幼虫变态发育为成虫的“开关”,不同变态发育类型虫体转变时激素浓度不同,在脑激素的主导下,再联合蜕皮激素一同发挥作用,共同调控昆虫生殖代谢、催化反应,甚至联合昆虫的类胰岛素及其通路对寿命进行调控[7]。胰岛素(insulin, INS)对机体的正常 生长繁殖、新陈代谢、动作行为等过程具有不可替代的调节作用[8],其信号位点处于保幼激素前,需要与其他激素联合发生连锁反应以达到调节目的[9]。相关研究表明,胰岛素与蜕皮激素和保幼激素及其相关受体间存在相互作用关系,彼此间相互影响,联合调节昆虫的生长发育[10]。放眼未来,昆虫的内源激素能在病虫害防控的实际操作中展现出巨大的优势和开发潜能。
1 材料与方法
1.1 研究材料
本研究所用桔小实蝇均使用合作单位西南大学昆虫生态分子实验室人工饲养种群。
1.2 处理方法
通过鲜榨的橙汁引导适龄雌虫产卵,收集卵置于流水下清洗干净,随机选取足量完整的卵在保鲜膜上孵化0.25 d。将孵化时间内孵出的幼虫转移至人工饲养环境。在台式显微镜下,手持桔小实蝇5日龄幼虫,将配制好的三种激素(INS、JH以及MH)母液500 ng分别于倒数第3腹节背面节间处注射进入幼虫体内,以加入染料的缓冲液(ddH2O)作为对照。注射完后将幼虫重新放入含幼虫饲料的培养皿中,放置于人工气候箱中饲养,温度为(27±0.5)℃,相对湿度为(70±5)%,无光照。激素注射后第1 h、4 h、8 h、12 h观察,并随机挑取6头幼虫,快速投入液氮中,保存于-80 ℃,每组样品3次重复。
1.3 数据处理
数据整理使用Microsoft office Excel软件完成,数据由MxPro 4.01导出,采用2-ΔΔCT方法进行分析[11]。数据利用SPSS软件进行单因素方差分析(ANOVA,LSD)或独立样本t测验,对激素表达水平进行差异显著性分析(P<0.05)。
2 结果与分析
2.1 桔小实蝇幼虫体内三种重要生长激素滴度测定
2.1.1 桔小实蝇幼虫体内INS滴度
将100 µg/mL的INS母液分别稀释1.25倍、2.5倍、5倍、10倍、20倍后,通过高效液相色谱仪对六组标准液进行进样分析得出多峰色谱图,不同实验浓度的第一个小峰到最后一个小峰均出现在17 min~18 min间,主峰靠近18 min,说明INS溶液的出峰时间与主峰出现时间重合,均在18 min左右。使用Microsoft office Excel绘制标准曲线如图1(a)所示,推算出峰面积与浓度的关系为y=7.9623x+9.1758,其R2值为0.9982。
收集不同虫龄桔小实蝇幼虫,利用HPLC技术测定幼虫体内INS的滴度,结果显示,INS在桔小实蝇的整个幼虫时期均有表达,且滴度变化相对平稳,只有在L5阶段有显著的升高,平均滴度为18.489 38 ng/g,其余时期其滴度均无显著性差异。
2.1.2 桔小实蝇幼虫体内JH滴度
将100 µg/mL的JH-Ⅲ母液分别稀释1.25倍、2.5倍、5倍、10倍、20倍后,通过高效液相色谱仪对六组标准液进行进样分析得出多峰色谱图,不同实验浓度的第一个小峰到最后一个小峰均出现在11 min~13 min间,主峰靠近11 min,说明JH-Ⅲ溶液的出峰时间与主峰出现时间重合,均在11 min左右。使用Microsoft office Excel绘制标准曲线如图1(b)所示,推算出峰面积与浓度的关系为y=8.1949x+9.6512,其R2值为0.9984。
收集不同虫龄桔小实蝇幼虫,利用HPLC技术测定幼虫体内JH的滴度,结果显示,JH在桔小实蝇的整个幼虫时期均有表达,且滴度变化相对较大。其中,在L3阶段JH滴度水平达到最高值27.953 94 ng/g,显著高于其他时期,随后逐渐降低。
2.1.3 桔小实蝇幼虫体内MH滴度
将100 µg/mL的MH母液分别稀释1.25倍、2.5倍、5倍、10倍、20倍后,通过高效液相色谱仪对六组标准液进行进样分析得出多峰色谱图,不同实验浓度的第一个小峰到最后一个小峰均出现在20 min~21 min间,主峰靠近21 min,说明MH溶液的出峰时间与主峰出现时间重合,均在21 min左右。使用Microsoft office Excel绘制标准曲线如图1(c)所示,推算出峰面积与浓度的关系为y=9.9623x+9.5872,其R2值为0.9937。
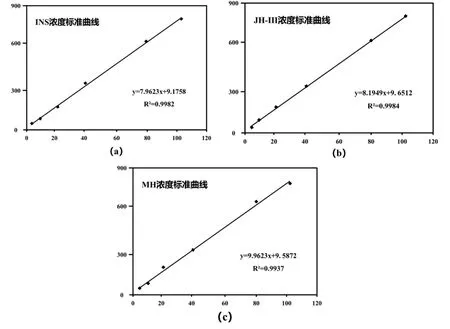
图1 三种激素滴度标准曲线
收集不同虫龄桔小实蝇幼虫,利用HPLC技术测定幼虫体内MH的滴度,结果显示,MH在桔小实蝇的整个幼虫时期均有表达,滴度变化相对平稳,只有在L3与L5阶段有显著性差异,其余时期其滴度均无显著性差异。
2.1.4 桔小实蝇幼虫体内三种重要生长激素滴度水平相互关系
分析上述实验数据,绘制出桔小实蝇体内三种重要生长激素滴度水平的相互关系图如图2。数据结果表明,INS、JH、MH三种激素在桔小实蝇的整个幼虫时期均有表达,其中INS与MH的滴度变化相对平稳,只有在L3与L5阶段有显著性差异,其余时期其滴度均无显著性差异;JH的滴度变化相对较大,在L3阶段滴度水平显著高于其他时期,其后逐渐降低。在桔小实蝇L1阶段,JH的滴度水平为18.980 59 ng/g,显著高于MH的13.767 76 ng/g,两者与同时期桔小实蝇体内INS滴度水平没有显著性差异。L3阶段,桔小实蝇体内INS与MH滴度水平均为12.733 18 ng/g,而同时期JH滴度水平为27.953 94 ng/g,显著高于INS和MH滴度水平。L5及L7时期,三种激素均保持较高量表达,滴度水平之间不存在显著性差异。
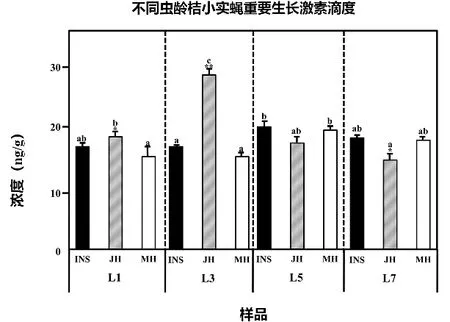
图2 不同虫龄桔小实蝇幼虫三种生长激素滴度
由此可以推出,INS、JH、MH三种激素在桔小实蝇从卵孵化后到化蛹前的生长发育阶段均发挥重要作用,且相互间存在动态关系。
2.2 桔小实蝇幼虫体内三种重要生长激素之间的相互影响
根据上述结果,选择利用三种生长激素表达量相对较高的L5时期的桔小实蝇幼虫开展三种生长激素间的相互影响研究。
对桔小实蝇5日龄幼虫注射500 ng INS母液,利用HPLC技术检测12 h后幼虫体内JH、MH两种激素的滴度水平。结果如图3(a)所示,注射INS母液后,JH、MH两种激素的滴度水平均显著升高,说明胰岛素能促进蜕皮激素和保幼激素的分泌,调控桔小实蝇生长发育。
对桔小实蝇5日龄幼虫注射500 ng JH母液,利用HPLC技术检测12 h后幼虫体内INS、MH两种激素的滴度水平。结果如图3(b)所示,注射JH母液后,INS滴度水平显著升高,而MH滴度水平显著下降,说明保幼激素能促进胰岛素的分泌同时抑制蜕皮激素的分泌,从而影响桔小实蝇的生长发育。
对桔小实蝇5日龄幼虫注射500 ng MH母液,利用HPLC技术检测12 h后幼虫体内INS、JH两种激素的滴度水平。结果如图3(c)所示,注射MH母液后,INS滴度水平下降但不显著,而JH滴度水平显著下降,说明蜕皮激素能抑制保幼激素的分泌,从而影响桔小实蝇的生长发育。

图3 一种激素处理后其他激素滴度水平变化
3 讨论
变态类昆虫成虫体型大小决定于化蛹前的营养和激素水平,并且在幼虫期和若虫期其生长速度很快。根据数据推断出桔小实蝇虫卵孵化为幼虫后的前3 d里,幼虫处于最虚弱状态,会出现一次蜕皮高峰期,迫切需要生理生化过程为其生长发育提供“建材”以提升自己的生存机会。此时JH占据主导地位,联合INS促进幼虫的生殖代谢,促进卵巢成熟,同时将脂肪体中的卵黄转化为蛋白,成为营养素的固着载体,提高免疫力的同时进一步加强生理调节,是幼虫变态发育为成虫质变所需的物质积累。此时,较低浓度的MH促进了组织细胞的生长和增殖,INS的液相色谱图上出现小峰时,意味着表皮细胞开始启动基因编码程序使之从幼虫向蛹转化。
依据上述结果可以发现,桔小实蝇幼虫第1 d~3 d是其幼虫生长过程中营养累积的关键时期。因此,在该阶段需要大量JH的作用来维持幼虫身体形态的稳定性,所以JH含量显著高于其他生长激素。虫卵孵化后的5 d~8 d,三种激素滴度水平基本持平,有了一定的JH基础后,昆虫的体积增大,对能量的需求也同步开始增大,导致其对INS和MH的需求增大,随着新陈代谢的加快,更新自身的细胞、组织,从而维持自身的生命活力。
在昆虫生长发育过程中,由于不同发育阶段需要完成的生长任务不同,体内激素水平也会不一致。桔小实蝇幼虫体内胰岛素、蜕皮激素、保幼激素在其生长发育过程中均扮演者重要角色,三者之间能够相互促进、相互抑制,通过互相影响来维持桔小实蝇幼虫期生长发育的稳定性,满足其生长发育过程中的不同需求,从而保证其正常生长。昆虫的激素会借助体液、淋巴等调控其生活[2],激素作用的研究因而不可规避。本研究采用HPLC技术对不同虫龄的桔小实蝇幼虫体内的INS、JH、MH的滴度进行测定,结果显示,三种激素在整个幼虫期均发挥了作用,彼此间相互影响。INS和MH呈渐进式变化,而JH在L3阶段发生跳跃式变化,含量显著升高,与钱明惠等(2006)对双斑恩蚜小蜂体内激素变化探究结果[8]的趋势一致,说明能量转换、组织细胞的更新换代、虫体的营养积累需要INS、MH的持续作用;在L3阶段幼虫的形态发育和翅型的分化进程大大加快,与张琼秀等(2008)使用三种外源激素类似物对不同阶段白背飞虱翅型处理的最佳阶段[12]结果相同。由MH与JH的含量变化可知,低浓度的MH可以促进JH的合成,高浓度的MH会抑制JH的合成,JH与MH一同维护前胸腺正常运行并承受神经内部的分泌系统释放的应激压力[13],咽侧体受蜕皮激素刺激后会分泌出保幼激素在烟草天蛾中已经被证实。
4 展望
本研究最终得出INS、JH和MH在桔小实蝇生长发育中扮演着重要角色,发挥着不同作用。此前的研究也证实,蜕皮激素和保幼激素能通过各自的信号通路作用于靶细胞推动相应蛋白的合成,其研究成果已被广泛应用于经济昆虫的增产增收上,而对于其调控却还是存在着难以攻克的技术壁垒[14]。探索昆虫激素不仅为昆虫和激素的理论体系添砖加瓦,而且在农业害虫防治的实际应用方面显示出巨大的优越性和潜力,能够促进新型生物农药与制剂的进一步研发,并为持续防控害虫提供新的思路和方法。
5 结语
本实验发现INS与MH以及JH与MH间均存在协同作用,但目前对桔小实蝇的重要内源激素,如胰岛素、保幼激素类似物、蜕皮激素等的系统研究尚少,内在机制如JH和MH参与其形态发育时调控昆虫翅型分化等的机制还未被揭露,有待深入研究以切断虫害发生地的延伸。

