医疗器械不良事件统计分析系统研究
许海弦
(山东省卫生健康委员会医疗管理服务中心,山东 济南 250014)
医疗器械是现代化医学不可缺少的内容,主要应用在患者的诊断及治疗等医疗工作中,是医疗科技研究领域的重要手段。但是医疗器械与市场中的普通器械不同,在上市后所导致的不良事件数量与危害是巨大的。为此,针对医疗器械不良事件统计分析系统进行研究,明确导致医疗器械不良事件的原因以及事件监测等内容,分析统计系统的开发工具、了解系统功能、开展开发设想,有助于为医疗器械不良事件提供充分的理论依据,推动医疗器械安全性的不断提升。
1 医疗器械不良事件统计的含义及案例
1.1 含义
医疗器械的不良事件所指的是,在获得上市许可的合格器械使用中所出现的或者可能出现的所有与使用效果预期无关的有害事件。在事件中包含了多种严重性损害,例如对患者机体造成永久性损害,以及永久性破坏等。
医疗器械的不良事件产生因素较为复杂,包含了器械性能,以及功能故障等等。同时,在器械研究中出现研究范围局限也是不良事件发生的重要因素。医疗器械的不良事件监测通过对不良事件进行收集、记录、分析以及评价等内容,进行全过程的监控。最早的概念出自于欧洲,与大部分医疗器械警戒内涵相同,所以不良事件的监测还包括了上市后的风险管理等内容。
1.2 医疗事故案例分析
案例一:2001年佩戴角膜塑形镜,俗称OK镜的部分患者,出现角膜炎、视觉模糊等问题,患者症状严重的情况下,出现角膜穿孔与眼球受损等问题。经过国家有关部门的调查,加强了对OK镜的管理,并制定下发了有关管理规定。案例二:奥美定,聚丙烯酰胺水凝胶,俗称人造脂肪,外观为透明果冻质地液态物质。在1999年注册医疗器械。此后主要用在医美整容行业,作为隆乳、隆臀等手术的填充材料。聚丙烯酰胺水凝胶,是一种化学合成物,且构成的单体物质含有剧毒,但是作为化合物被人体所接触无毒。据我国药品不良反应监测中心统计数据,在2002~2005年末,已收到出现不良反应的报告183例,经过相关公司审批,存在严重的违规现象。经过相关处理,已经纳入医疗器械相关“管理办法”中。
结合近年来数据来看,在2019年我国的医疗器械不良事件统计系统接收到相关报告超过39万份。其中经济企业的占比最高,我国的注册基层用户数量呈现逐年递增的趋势,经济企业占据报告总数的90%以上。其中,二类医疗器械的风险最高,根据医疗器械的管理类别统计分析,在2019年涉及Ⅲ类型风险的报告占据总比超过30%。而Ⅱ类型报告占据总比超过40%。据统计,其中注射、护理和防护类型的医疗器械属风险最高类别。在医疗报告中,前五名为注射、护理和防护型器械、医用诊疗和监护器械,以及物理治疗器械、临床检验器械、呼吸、麻醉器械等。
2 医疗器械不良事件产生的因素
2020年,我国药品不良反应监测中心所接收的相关不良事件报告里,包含了Ⅲ类型医疗器所有的报告总计178.308份占据报告总数的33.2%;包含Ⅱ类型医疗器械的报告242.457份,占报告总数的45.23%;包含Ⅰ类型医疗器械的报告46,995份,占报告总数的8.77%。面对如此庞大的医疗器械不良事件率,要充分分析医疗器械的不良事件影响因素,才能全面明确统计系统开发、功能及统计的背景,为医疗器械研究提供优化路径。
2.1 医疗器械上市前研究的局限性
医疗器械较为特殊,因牵涉到人身安全等问题,所以需要在上市后才能彻底投入临床的使用。在上市前,医疗器械会经过系统性的安全评价,包含化学、物理、生物、临床等多方面的评价。当前的生物学试验主要是经过动物模型实验,但是动物与人类的机体功能存在着很大的差异性,动物体内出现的组织反应可能并不会发生在人类身上,虽然经过医学证实为最好的材料,但是因为个体差异,也会产生不同的反应。临床评价存在对象窄、例数少等特点,并且设计和实际应用可能存在着差异性,并出现定位不准确、适用人群不同等多种问题。
2.2 医疗器械的风险种类分析
产品的固有风险可分为设计因素、材料因素、临床应用因素等,详细内容如下:
(1)设计风险:结合实际情况来看,因为设计所导致的缺陷,问题而产生的不良事件所占据的总比例较小。主要原因在于,医疗器械在研发期间出现供给过于一致,所设计的内容与临床的医学要求不符合,并且在研发过程中定位不够严谨、明确等,从而导致出现难以回避的设计问题。
(2)材料因素:医疗器械等很多材料选自于工业材料,所以会出现那一平面的生物相容性、微生物污染以及化学残留的问题。
(3)临床应用因素:主要体现在医疗器械的协同以及手术操作期间发生,还有应用人群特殊等问题,并且与医生器械操作流程密切相关。
(4)医疗器械出现故障及损坏:主要表现在医疗器械出现故障或损坏,不能满足预期要求。
(5)使用说明相关因素:主要表现为,说明书出现错误、遗漏、缺陷等问题,或者在操作医疗器械中没有按照说明书的要求进行操作,从而出现不良事件。这种因素所引发的医疗器械不良事件占据总事件的大比例。
(6)器械管理不当:器械管理包含了医疗器械的采购、定期维护。目前我国各级医院存在“重购轻护”的现象。很多医院医疗的设备出现程序质控不严谨、执行不明确等问题。
(7)客观因素:所指的是难以避免的因素,包含了电击、雷击以及停电等多种因素,不仅会对医疗器械完成损坏,出现较大的风险,还会对病患产生安全威胁。
3 医疗不良事件统计分析系统开发工具
医疗器械不良事件内容较为复杂,所导致的事故种类较多,并且一旦发生可能会造成难以挽回的局面,所导致的事件特点和器械使用效果无关联性。一般情况下,虽然器械上市前会开展严格的审批及测试,但是并不等同于所有器械都不会产生安全隐患,及时的监测不良事件,是医疗器械质量管控的重要环节。通过分析应用程序、数据库,来了解系统开发工具,能够有效提升医疗不良事件系统的使用质量。思考到在线不良事件上报系统导出数据的表格连接便捷性,采用Office中的数据库软件Server、Access等。数据导入中,在使用系统进行医疗器械不良事件统计前,需要先进行相关数据的导入。依据原有的数据不同,在导入方式存在一定的差异性。(1)针对线上报的互联网不良事件报告,通过进入相关系统进行查询,并下载数据表格。在完成后将表格数据导入在Access数据库中。(2)通过纸质报告上报相关不良事件,采取手工的方式将相应的数据填入到库中,还可以通过系统的新增功能完成模块。
4 医疗不良事件统计系统功能分析
4.1 基本知识
在系统中,主要用在医院对上报的医疗器械不良事件开展统计、分析、查询(详见图1功能模块介绍)。
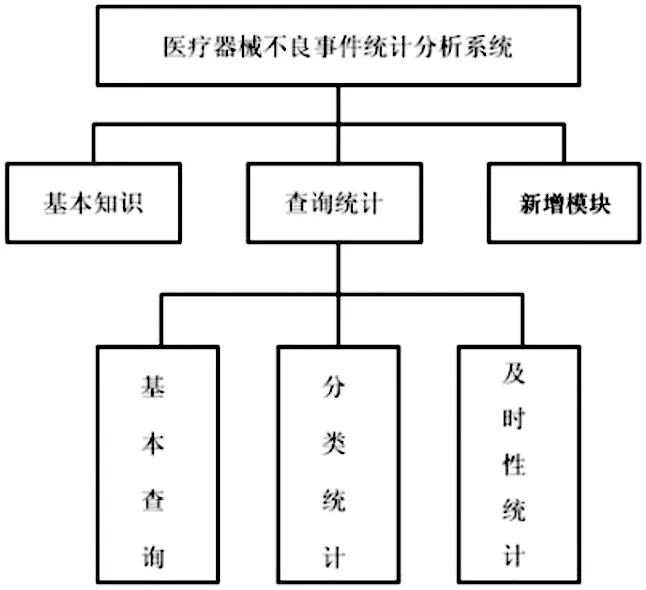
图1 功能模块介绍
用户在软件的界面选择相应的功能按钮即可进入相应的模块。模块主要存放于不良事件的基础知识,例如,报告、定义原则等,便于使用者观看详情。
4.2 查询统计模块
操作者在系统中按照搜索条件属于内容,如年份及类别等,然后点击查询按钮,即可根据相关条件在数据库中搜索到需求的内容。这一模块中,还包含了两个模块,为分类统计模块与及时统计模块,具体内容如下:
分类统计模块能够为操作人员提供便利的查询条件,并为人员呈现出不良事件在规定期限内发生的频率,并帮助人员明确具体事件内容,为监管人员提供了充分的措施制定参考,有效预防此类事件的发生。在实际操作中,需要利用分类统计的操作,对内容进行查询,例如器械产品的“分类、类别”条目等,并借助百分比的形式为人员呈现出来,人员可以根据百分比例明确事件发生的频率。当不良事件发生到一定的频率时,要根据事件的级别来开展内容上报(详见图2依据产品分类统计界面)。及时性的统计模块方便操作者进行不良事件的有效监督,确保及时对不良事件做出相应的分析和处理措施。经过系统处理,对事件发生的时间开展汇总,从而构成报表。
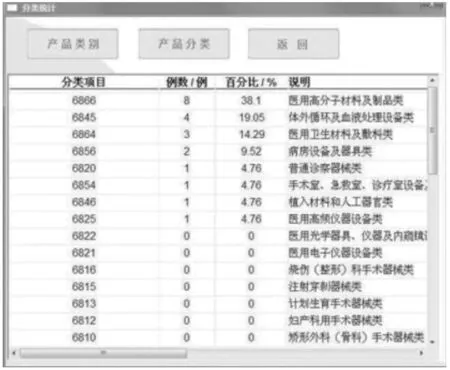
图2 依据产品分类统计界面
4.3 新增模块
这一模块的设计主要为了满足纸质报告的需求,让操作人员把纸质的报告内容传输到系统的数据库内,从而满足报告需求。
4.4 开发设想
为了提升器械监管水平,在系统研究中要坚持创新,完善相关内容,来开发出带有风险预警功能及PDCA功能的模块。其中的风险预警功能通过项目、权重以及发生频率系数这三项内容对事件中的某些字段进行计算;而PDCA的循环功能包含了结合流程进行汇总,根据实际情况生成相应的PDCA报告,其中包含了事件的报告,以及处理意见等多种内容,充分加强医疗器械不良事件监测,并为人员后续的处理措施、管理方法提供优化方向,提升医疗器械不良事件的监管水平。
5 医疗器械不良事件统计现状建议
结合以上研究调查来看,医疗器械不良事件的影响因素较多,在应用系统进行统计后,要充分明确我国当前医疗器械存在的问题,并通过统计内容分析不良事件现状,如存在法规不完善、缺乏审批制度的问题,还存在多方对医疗器械不良事件认识不足的问题,在开展医疗器械不良事件评价技术中存在的局限性较强,收获信息的渠道不健全等。通过提出相关完善建议,可以为我国医疗器械不良事件统计提供充分的条件。
5.1 完善相关法规,加强审批制度
首先,在完善法规方面,建议将较为完善的措施写入相关“管理办法”中,如果发现医疗器械不良事件隐瞒不报的行为,将采取一定的惩罚措施。其次,加强审批制度,改进产品改进后上市的流程维内托,参照美国PMA的产品改进后制度,企业提供充分的理由及补充验证即可上市。再次,完善医疗器械的监管制度,建立透明公开的器械不良事件数据库,为大众提供查询渠道,并对不存在或存在不良事件的企业进行一一记录,并构建产品评价。
5.2 加强宣传力度,提升多方认识
借助发放宣传读物、培训等方式,提升部分人员意识,加强对不良事件监督的认识。提升人员自律性,从而加强建立诚信体系,引导企业及医疗机构完善不良事件的上报机制。同时,结合当前不良事件评价的技术来看,难度较大,所以建议生产企业指派专业人员进行不良事件的定期统计监督,不定期进行医务人员的沟通交流,降低事件评估的技术难度,科学评价事件发生的因素,并结合具体预警信息进行产品的改进创新。
6 结语
本文从分析医疗器械不良事件产生的因素、医疗器械不良事件统计的含义,以及报告和统计工作出发,充分研究当前医疗不良事件的监管现状,并分析医疗不良事件统计分析系统的开发工具,为事件的统计提供详细的内容。同时,针对不良事件统计系统功能进行分析结合实际操作为操作人员提供明确具体的内容,从而提高医疗器械不良事件的统计水平。医疗器械不良事件统计分析系统是现代化医疗不可缺少的重要内容,通过开发出带有风险预警功能及PDCA功能的模块,能够有效完善系统内容,为医疗器械监管提供重要参考。

