水-土壤环境中抗生素污染现状及吸附行为研究进展
卫承芳,李佳乐,*,孙占学,董一慧,向令,周永康,向行
1.东华理工大学核资源与环境国家重点实验室,南昌 330013
2.东华理工大学水资源与环境工程学院,南昌 330013
抗生素是由微生物通过二次代谢自然合成或者从工业中人工合成的有机物质,能抑制其他微生物的生长或代谢活性甚至使其代谢、死亡[1]。抗生素经过废水处理、农业灌溉和污泥处理后排放到土壤中,不断累积[2-3]。且此类药物在畜禽养殖过程中具有使用量大、机体利用率低、降解周期长的特点,在自然环境中残留风险大。水和土壤是自然环境中不可或缺的因素。其中,地表水和地下水是水环境的重要组成部分。土壤环境一般指地球陆地表面的土壤圈层。沉积物与土壤指代的范围不同,但沉积物可向土壤演化,所以以下将沉积物相关内容划到土壤环境进行论述。
近年来,在水和土壤环境中频繁检测到抗生素。在2005—2016年期间,中国的7条主要河流和4个海域的水体和沉积物样本中共检测出94种抗生素,抗生素的残留给人类和生态环境带来了巨大威胁[4]。其中,磺胺类(sulfonamides,SAs)、四环素类(tetracyclines,TCs)、大环内酯类(macrolides,MLs)和氟喹诺酮类(fluoroquinolones,FQs)是中国消费量最大的四大类抗生素,常用于畜牧养殖以及临床医疗,在水-土壤环境中经常被检测到[5-6]。对位于我国北部的白洋淀进行调查,研究抗生素在其水体、沉积物和生物群中的存在和分布情况可知,SAs在水中浓度为0.86~1 563 ng·L-1,是水中的主要抗生素;FQs在沉积物和水生植物中浓度较高,含量分别为65.5~1 166 μg·kg-1和8.37~6 532 μg·kg-1;FQs和MLs在水生动物和鸟类中检出频率较高,含量分别为17.8~167 μg·kg-1和低于检测限值至182 μg·kg-1[7]。对位于我国南部的珠江口进行调查,分析位于珠江口的珠海市河流和沿岸水体及沉积物样品中的抗生素,发现诺氟沙星、大观霉素和硫酸链霉素在水体和沉积物中的浓度较高,分别为32.8~537 ng·L-1和2.48~444 ng·g-1,检出率较高,为100%;珠江三角洲海水养殖区收集的水样中检测出磺胺甲噁唑(SMX)、甲氧苄啶(TMP)、中氟哌酸(NFX)、氟嗪酸(OFX)、环磷酰胺(CTX)和链霉素(STM)等6种抗生素,各采样点的CTX水平较低,但其检出率高达100%,SMX、TMP和NXF的检出率约为50%[8-9]。地表水中的抗生素通过侧向补给进入地下水和土壤,在水-土壤环境中迁移[10]。尽管经过处理后进入环境中的抗生素浓度很低,但少量、持续的排放仍会对人类健康和生态环境造成威胁。人类或兽类多种类、多剂量地使用抗生素会造成城市水系统中相关抗生素抗性基因的严重污染,威胁到城市用水安全和水环境的生态安全[11]。抗生素在水和沉积物中的残留可能会对食物链造成潜在风险,包括抑制土壤分解的能力、对水生生物造成影响,促进细菌抗性基因的发展等[12-13]。我国高度重视水-土壤环境中的抗生素污染问题,农业农村部发布一系列针对滥用抗生素专项整治的公告,污染控制已刻不容缓。
近年来,许多学者对抗生素在水体、沉积物和土壤中的分布情况进行了研究。但是,关于水-土壤环境大体系中的抗生素研究相对较少。随着社会的发展,抗生素的检测技术和环境风险分析手段都得到了提高,这有利于研究抗生素在环境中的归趋问题。因此,有必要回顾、归纳、总结近年来该领域的文献。本文主要论述了水-土壤环境中抗生素的来源、使用现状和污染现状,对水-土壤环境中抗生素的吸附行为进行了分析,重点讨论了金属离子、pH、有机质和分子结构对抗生素吸附的影响机理。
1 水-土壤环境中的抗生素(Antibiotics in the water-soil environment)
1.1 来源(Source)
(1)医用。据世界卫生组织调查,我国住院患者抗生素药物使用率高达80%,医用抗生素是目前抗生素的最主要污染源之一[15]。医用抗生素主要通过以下方式进入水-土壤环境:在生物体中未能被吸收而伴随着粪便和尿液被排入环境;含有抗生素的医疗废物以及医疗器械未被合理处置;药物科研机构以及生产机构生产废水的排放[16]。
(2)畜禽养殖业。与居住区和工业区不同,流域的农业区是河流中抗生素污染的主要来源[17-18]。为了预防和治疗动物疾病以提高生长生产效率,抗生素被广泛应用于畜牧业和水产养殖业,这也是环境中重要污染来源之一[19]。畜禽养殖业中抗生素的长期使用不仅会导致抗生素残留在水-土壤环境中,还会产生耐药基因,而由于耐药基因的影响,农户会加大抗生素药物的使用量以及延长使用周期,这会导致更多的抗生素被残留在环境中。
(3)污水/废水。生物体只能吸收小部分抗生素,大多数用于人类和畜禽的抗生素会通过生物体以粪便和尿液的形式进入到污水处理厂或者直接进入水环境、土壤环境。现有的污水处理技术难以完全去除污水中的抗生素,大部分抗生素将被排入水环境中,地表水与地下水都将受到污染[14,19]。
1.2 使用现状(Status of use)
2013年抗生素在中国总使用量为162 000 t,其中用于人类自身的占总使用量的48%[5]。在中国,约有97 000t抗生素用于养殖业,为年总产量的46.1%,SAs、TCs、FQs、MLs和β-内酰胺类等五大类抗生素在华东地区消耗量最大,西北地区消耗量最小[20-21]。中国与美国SAs和TCs抗生素的使用量相当,但高于意大利和法国等欧洲国家,中国的人均抗生素用量更高,例如,德国(2001年)、波兰(2000年)、西班牙(2003年)、瑞典(2005年)和瑞士(2000年)罗红霉素的人均使用量分别为75.2、53.0、9.3、1.6和20.4 mg,而中国(2000年)的人均使用量高达135 mg[20-21]。在美国、欧洲和亚洲的部分地区,兽用抗生素普遍使用以及施用化肥等农业行为促使抗生素出现在地下水中[22-23]。
随着社会的发展,抗生素的使用量不断增加。2000年,低收入、中等收入以及高收入的国家抗生素消费量类似;2015年,低收入和中等收入国家抗生素消费总量是高收入国家抗生素消费总量的2.5倍,预计在2030年包含抗生素在内的抗菌药年总使用量将达到236 757 t[24-25]。从抗菌药物的限定日剂量(DDDs)来看,全球抗生素消费量在2000—2015年间从211亿DDDs增长到348亿DDDs,提高了65%,其中,印度从32亿DDDs增长到65亿DDDs,提高了103%;中国从23亿DDDs增长到42亿DDDs,提高了79%;巴基斯坦从8亿DDDs增长到13亿DDDs,提高了65%[25]。
第一,学生切实体会生活,获取一手资料。钟启泉教授曾经说过“要想让学生学好语言,用好语言,那就得首先让他们有思想、有情感。否则,就只能是陈词滥调或无病呻吟”。怎样让学生成为感情丰富的人,最好的办法就是老师有目的地启发学生感知生活,快乐地投入到生活之中,那么生活自然会回馈你真实的情感,是无法被人代替的,因为同一件事,不同的人会有不同的体会,这就是你自己的一手宝贵资源,再加上老师的写作技巧,有心的学生可以从这些一手资料中悟出深刻的人生哲理,从而进行“生活写作”。
根据抗生素的污染情况,各国针对抗生素规范使用制定了相应的法律法规。2003年9月22日,欧洲议会和理事会关于动物营养添加剂的(EC)第1831/2003号条例规定,2006年起禁止将抗生素作为饲料添加剂使用[26]。澳大利亚对喹诺酮类药物使用进行限制[27],美国2014年起禁止使用促生长类抗生素,2017年起禁止使用预防类兽用抗生素[28]。中国农业农村部2018年启动实施兽用抗菌药使用减量化行动;2020年发布第194号和246号公告,实施药物饲料添加剂退出行动,中国饲料中全面禁止添加抗生素;2021年发布的1号文件中做出了在2021—2023年对水产养殖用兽药、饲料和饲料添加剂相关违法行为进行专项整治的决定。
1.3 污染现状(Pollution situation)
抗生素进入土壤后,易发生微生物转化、光降解、地表径流、淋溶、植物吸收、吸附/解吸或固存,从而导致抗生素在水-土壤环境中迁移[29]。抗生素中存在的一个或多个如氨基、羟基或羰基等亲水性极性官能团,易与水结合形成水合物,而加速抗生素从包气带土壤向地下水的渗透[30]。沉积物作为抗生素在水环境中的“储存库”,水环境中的抗生素可通过分配作用进入沉积物,也可在环境条件改变时重新释放进入水体[31]。
在2012—2019年期间,对中国的黄浦江、三峡库区、北部湾沿海地区、广州和北京,并对葡萄牙、肯尼亚、西班牙和巴基斯坦等其他国家进行抗生素污染调查,采样后测定土壤、沉积物、地表水和地下水中不同抗生素的浓度,结果如表1和表2所示。
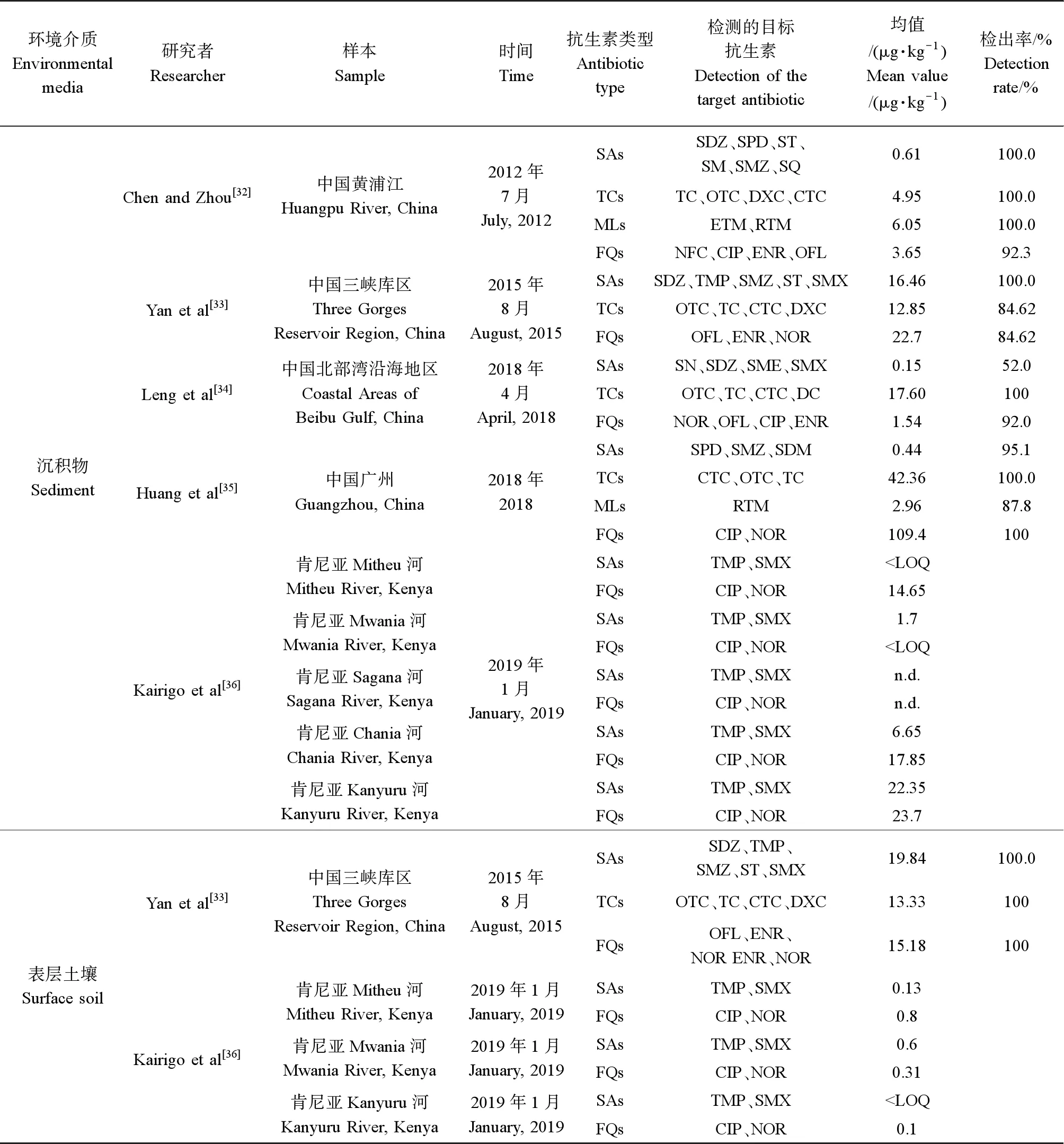
表1 土壤环境中抗生素的浓度Table 1 Concentrations of antibiotics in soil environment

表2 水环境中抗生素的浓度Table 2 Concentrations of antibiotics in water environment
在土壤环境中,沉积物和表层土壤是抗生素重要储存场所之一。沉积物和表层土壤是2种不同但可以相互转化的环境介质。表层土壤在水的冲刷作用下进入自然水体后形成沉积物中的一部分,而沉积物被露出水面经人工或自然作用后又可形成土壤。
沉积物体系复杂,含有粘土矿物、金属氧化物和有机质等多种组分,是抗生素在水体中迁移吸附的重要环境介质[37]。沉积物对各类抗生素有不同程度的吸附能力,浓度均在μg·kg-1级别。在黄浦江沉积物中检出的单类抗生素浓度均值范围为0.61~6.05 μg·kg-1,含量较低但检出率较高;在三峡水库沉积物中检出的单类抗生素浓度均值范围为12.85~22.7 μg·kg-1,含量与检出率都比黄浦江的样本高,这可能与城市化水平有关;在北部湾沉积物中检出的单类抗生素浓度均值范围为0.15~17.60 μg·kg-1,其中TCs含量最高,这可能是因为北部湾海域养殖业发达,广泛使用TCs兽药;在广州内陆河流沉积物中检出的单类抗生素浓度均值范围为0.66~42.36 μg·kg-1,TCs和FQs含量远高于SAs和MLs,这可能与饮食习惯以及城市化水平有关,其中TCs和FQs被广泛用于养殖业,在禽肉类产品中多有残留[38]。
在肯尼亚3个地区的4条河流沉积物中检出的单类抗生素浓度均值范围为n.d.~23.7 μg·kg-1,其中多种抗生素未检出。不同国家不同地区沉积物中检测出来的抗生素残留程度相差较大,这与当地的城市发展水平以及抗生素使用习惯有一定的关系。
随着畜禽养殖业的发展,抗生素通过不同途径源源不断进入到土壤,残留在土壤中的抗生素不断迁移、转化和累积。中国是一个农业大国,从表层土壤中抗生素检出率以及含量上可以发现,农业生产过程中使用的抗生素会残留在土壤中。不同国家、地区抗生素残留水平不同,肯尼亚表层土壤中抗生素的含量极低,而我国三峡库区表层土壤中检出的TCs、SAs和FQs含量远高于肯尼亚几个地区的表层土壤的抗生素含量。导致这种结果的原因可能是畜禽种类、抗生素使用习惯以及环境差异等。
随着抗生素使用量与排放量的提高,水环境中的抗生素不断积累。国内外地表水存在不同程度抗生素污染,水中抗生素的残留水平是由多种因素造成的,包括抗生素的消费模式、污水处理厂的规模和不同的处理技术。不平衡的区域发展也致抗生素残留水平空间分布存在明显差异。我国黄浦江和三峡水库以及广州几个河流抗生素残留量略高,污染水平远高于葡萄牙和肯尼亚;肯尼亚几个地区各类抗生素污染水平极低,除SAs类略高外,其他抗生素几乎都未检出。SAs是在地表水中检出浓度以及检出率相对较高的一种抗生素。
地下水是人类日常生产生活中必不可少的资源。相对于地表水来说,地下水存储在地下含水层中,不易受到直接的污染。事实上,在地下水中发现了包括抗生素在内的许多污染物,在上述这几个地区和国家,西班牙未检出TCs,我国北京未检出MLs,巴基斯坦TCs、SAs、MLs和FQs均有检出,单类抗生素浓度均值范围在0.3~68.36 ng·L-1之间,这表明地下水是水环境中潜在的抗生素储备库。对比不同地区地下水中抗生素残留情况,发现地下水中残留的抗生素种类较多,但不同地区同种类抗生素浓度不同,成分分布存在明显地区差异,可能与该地区抗生素的消费水平有关,如FQs和SAs分别是我国北方和南方地区的主要抗菌药物。抗生素在地下水中的发生和分布等环境行为一定程度上反映了当地的人类行为。
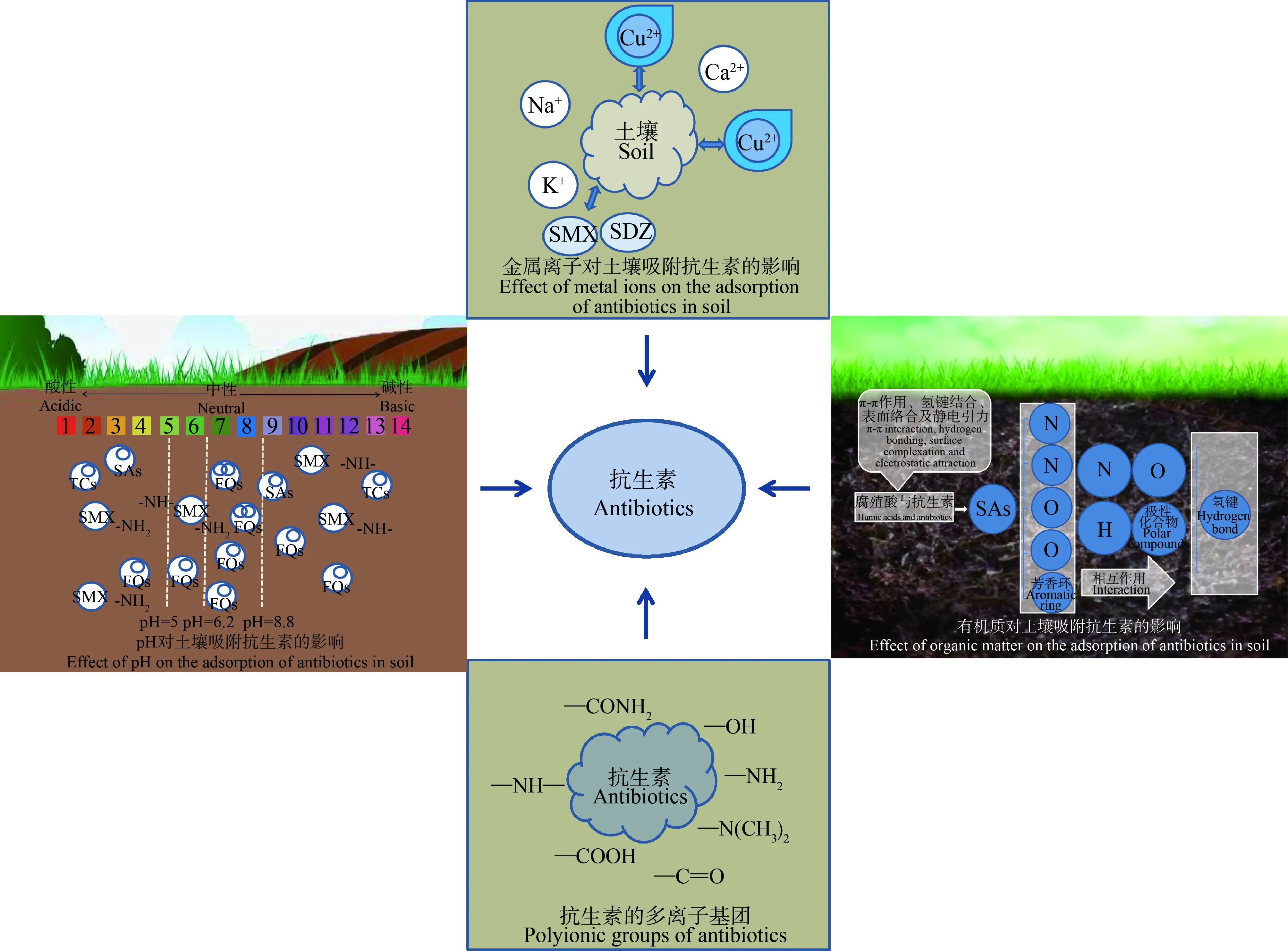
通过样本比对可知,在土壤环境中,MLs的残留浓度在2.96~6.05 μg·kg-1之间,残留水平最低;FQs的残留浓度在n.d.~109.4 μg·kg-1,残留水平最高,但MLs与FQs残留浓度的中位数相当;此外,SAs的残留浓度与中位数均比TCs的小。在水环境中,这几类抗生素残留浓度从低到高分别为SAs 对比几大类抗生素在水环境和土壤环境中的残留水平不难发现:SAs在水环境和土壤环境中均有残留且更容易在水环境中残留,原因可能是其具有良好的化学稳定性和环境迁移能力,不易被降解。TCs具有良好的水溶性、光解特性和较高的辛醇-水分配系数(Kow),容易被沉积物或土壤吸附。TCs的亲水性和低挥发性决定了其在水环境中具有显著的持久性,稳定的化学性质使其在环境中长期存在、累积以及扩散[43-44]。FQs自身性质稳定,半衰期长,比其他类抗生素具有更强的土壤蓄积能力和持久性,在水环境中被频繁检出,排入水-土壤环境中的FQs主要通过光解降解,受水中溶解性物质、pH以及光敏剂等因素影响,降解慢[45-47]。MLs在水环境中具有较高的生物可降解性,吸附到沉积物中之后很难迁移到深层沉积物中,可能是因其具有较高的衰减速率[48-49]。 使用后未被吸收的抗生素通常会以未经转化的原始形式进入到水和土壤环境中,部分亲和力较强的抗生素可被稳定吸附在土壤颗粒表面,而较难被吸附在土壤上的抗生素容易在渗透作用或地表径流的作用下进入水环境中[31,50]。 SAs、TCs、MLs和FQs等典型抗生素在不同介质中存在不同的吸附特性。SAs属于亲水性物质,吸附势较低,在土壤中具有很高的流动性,施入土壤后会迅速迁移,最终进入地表水和地下水中[51-52]。TCs属于疏水性有机物,除进行离子交换外,还通过包括金属架桥与cation-π作用在内的表面络合机制在活性污泥上进行吸附[53]。MLs多为碱性亲脂性化合物,吸附能力较弱,易通过渗滤作用进入水环境[54-55]。FQs是具有强配位体氟原子、羰基、氨基以及离子交换羧基的两性化合物,能以不同方式与土壤相互作用,在土壤中具有较强的吸附能力[56]。 分子结构、疏水性、极性、极化率和空间结构等抗生素的性质和土壤类型、土壤pH、共存离子、土壤有机质和土壤中存在的金属离子等土壤的基本性质对抗生素在土壤中的吸附行为有很大影响,在吸附过程中直接或间接影响其在土壤中的降解和生物利用度[57-58]。其中,金属离子、pH、有机质和抗生素分子结构是土壤吸附抗生素的基本影响因素,以下将从这4个方面对其进行分析,其对土壤中抗生素吸附行为的影响如图1所示。 图1 金属离子、pH、有机质和抗生素分子结构对土壤吸附抗生素的影响Fig. 1 Effects of metal ions,pH,organic matter and molecular structure of antibiotics on the adsorption of antibiotics in soil 2.2.1 金属离子对土壤吸附抗生素的影响(Effect of metal ions on the adsorption of antibiotics in soil) 抗生素是具有多个可电离的官能团的极性化合物。重金属可以催化抗生素的氧化,起到络合剂的作用,导致自由态的金属离子和抗生素减少,使抗生素保留在土壤中[2,59]。与抗生素不同,重金属不会被降解,只会长期存在于环境中。金属离子可能会抑制或增强抗生素在土壤中的吸附。多价金属离子和抗生素之间存在相同官能团的竞争,或通过阳离子的水化层干扰,或屏蔽吸附剂中的疏水和亲水位点,从而抑制抗生素的吸附[60-61]。金属离子可以通过阳离子-抗生素络合、静电吸引和外球络合增加抗生素的吸附[62-64]。 Cu和Zn会改变抗生素的吸附位点,导致土壤中抗生素含量受到影响,Cu和Zn的存在会增加土壤对四环素的吸附量[65-67]。Cu2+的水化反应强烈,会与水分子络合形成致密水化层,从而与有机物直接竞争吸附剂表面积,使有机污染物的吸附能力降低[68]。有研究表明,Cu2+在土壤中发生的水化反应强烈,Cu2+离子被水分子包围后寄生在致密水的水化层中,与磺胺甲噁唑和磺胺嘧啶争夺土壤疏水吸附区,从而抑制其在土壤上的吸附[69]。在pH>5.62时的吸附过程中,磺胺甲噁唑的负电荷被中和后与Cu2+形成络合物,中性和阳离子分子含量增加,带正电的磺胺甲噁唑和Cu2+竞争同一带负电的吸附部位,使磺胺甲噁唑的吸附能力提高[69]。粘土对阳离子物质有很高的吸附亲和力,土壤中存在的金属离子如Na+、K+和Ca2+等通过竞争性相互作用,对TCs在蒙脱石和高岭石等粘土矿物上的吸附产生负面影响[70-71]。离子强度较高时,随着盐浓度的增加,磺胺异噁唑溶解度会降低,土壤对磺胺异噁唑的吸附变大[72]。离子强度增加后土壤表面的质子和Al3+被Ca2+取代,pH略有下降,带负电荷的磺胺异噁唑向中性形式移动,这种中性形式比阴离子形式吸附得更强烈[72]。 2.2.2 pH对土壤吸附抗生素的影响(Effect of pH on the adsorption of antibiotics in soil) 抗生素在不同pH下呈现不同状态。在土壤等天然吸附剂中,SAs会以阳离子、阴离子或中性形式出现。如磺胺甲噁唑带有呈碱性的氨基(—NH2)和呈酸性的亚氨基(—NH—)使其具有2个解离常数(pKa),在不同pH值下能够以阳离子、两性离子和阴离子的形态存在[73-74]。pH值高于5.0时,SAs的阴离子会与土壤成分的负电荷发生强烈的静电斥力而导致吸附量减少;pH值较低时,SAs以阳离子形式与土壤中的阳离子交换,导致土壤对SAs的吸附增强[72]。随着pH值的增加,SAs从阳离子形态向中性和阴离子形态转变,带正电荷和中性电荷的SAs离子与表面带负电荷的土壤矿物静电结合[75]。pH小于第二离解常数时,SAs的非离子化性质决定了其吸附行为的主要机制是疏水分配[76]。 FQs是既含有酸性基团又含有碱性基团的双质子分子,可能以阳离子、两性离子、中性和阴离子的形式存在于环境中[77]。FQs的羧基和氨基上的正负表面电位将FQs电荷定位为两性离子或中性形式,从而影响FQs的溶解性和吸附,如FQs以中性形式出现时,在水和其他极性溶剂中较难溶;以两性离子形式出现时,在极性溶剂中更易溶[77-80]。FQs在不同pH溶液中的存在形式大致相同,都具有羧基(—COOH)和哌嗪基团2个质子结合位点,有2个pKa值分别为6.2和8.8,当pH TCs具有三羰基酰胺、酚二酮和二甲胺3个质子结合位点、具有3个pKa值。当pH 具有碱性叔胺结构的MLs富含氨基或羟基,是弱碱类抗生素。此类抗生素易受pH的影响,如罗红霉素(RTM)具有氨基这一质子结合位点,pKa值为8.8,当pH<8.8时,反应性降低[86-87]。 2.2.3 有机质对土壤吸附抗生素的影响(Effect of organic matter on the adsorption of antibiotics in soil) 通过动植物残渣的不完全分解和降解后经过一系列化学过程而产生的腐殖酸,广泛分布于土壤、水和水沉积物中,是自然界中有机物的主要成分,也是环境污染物重要的络合剂、吸附剂或氧化还原剂[88-94]。 腐殖质以腐殖酸为代表,当抗生素接触到腐殖酸上具有的苯环骨架和丰富的含氧官能团时,可以以共存形式构成多介质体系,使迁移转化形势变得复杂。水环境中的腐殖酸来源可分为:通过植物、微生物在水体本身进行腐烂的内部来源和土壤、动植物的有机物残留物被微生物分解后进入水环境中的外部来源[95-97]。腐殖酸对抗生素的吸附主要涉及π-π作用、氢键结合、表面络合和静电引力等机制,范德华力、孔洞填塞和表面沉积等物理性质会促进其吸附作用[98]。 SAs对土壤的吸附,受土壤有机质含量及其在不同粒级之间的不均匀性即土壤有机质组成的影响[99]。如,腐殖酸高程度暴露且凹凸不平的表面、颗粒间松散结合的形态特征和多孔结构为以菌胶团为主的微生物菌群提供了栖息场所,这促进了磺胺甲噁唑的吸附[88,98]。在与土壤有机质分子体系的相互作用中,SAs上的2N原子、2O原子和1个芳香环等5个带负电荷的物质(相互作用中心上带电的N、O和H原子)与极性化合物相互作用后形成1个或2个氢键,芳香环上的电子密度与非极性化合物相互作用;非极性相互作用中心以分散相互作用为主;结合强度会随着土壤供水量的增加而降低[99]。其他抗生素如四环素,其极性官能团和腐殖质官能团的带电官能团之间同时相互作用会导致腐殖质对四环素的高吸附[100]。 2.2.4 分子结构对土壤吸附抗生素的影响(Effect of molecular structure on the adsorption of antibiotics in soil) 抗生素主要通过范德华力、氢键作用等分子间作用力与土壤颗粒表面的吸附位点结合,土壤中有机质等物质可以与抗生素分子中的醛、羧基和氢键等官能团发生吸附或者络合反应从而导致抗生素的微生物生长抑制潜力下降[98,101-102]。其中,抗生素的分子结构决定了它们的疏水性、极性、极化率和空间结构等物理化学性质,其分子结构上不同的官能团和取代基会使它们在土壤中表现出不同的吸附行为[3,98,102-104]。 目前,水-土壤环境中有关抗生素的报道仍局限于单一的表层认识,今后的研究应从以下几个方面展开。 (1)目前对抗生素污染的研究多是单一横向或纵向。对抗生素在水-土壤环境中的吸附机理和规律研究有必要横纵结合,以建立抗生素在水-土生态系统中的吸附迁移模型。 (2)自然环境中,各种因素相互作用影响抗生素的吸附行为,在实验室中难以模拟这种复杂的情境。应开展水-土壤环境中包含抗生素在内的有机混合污染研究,为水-土生态系统污染防治方案提供支撑。 (3)有关抗生素环境风险的研究大多有特定的对象、范围,比如污水处理厂周边的水,农田土壤以及畜禽养殖厂、垃圾填埋厂等周边土壤等。可积累特定研究对象的基础数据,建立快速检测系统和分析评判机制,以建立抗生素在水-土壤环境中的评价预警体系。2 水-土壤环境中抗生素的吸附行为(Adsorption behavior of antibiotics in the water-soil environment)
2.1 抗生素的吸附行为(Adsorption behavior of antibiotics)
2.2 抗生素吸附行为的影响因素(Factors influencing antibiotic adsorption behavior)

3 研究展望(Research Prospect)

