基于铁死亡基因的口腔鳞癌预后模型开发和验证
吕浩东 梁青青 张远 赵庆 金玉琴 王天丛 窦昭婧 季骏
口腔癌作为最常见的头颈部恶性肿瘤,2020 年全球诊断超过35 万例,死亡人数超过17.5 万[1],其中口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)占比超过90%[2]。尽管OSCC的诊断和治疗有所改善,但5年生存率仅为60%左右[3],因此有必要寻找新的生存预测指标以便更好的进行临床决策。铁死亡是一种新型的铁依赖性细胞死亡方式,尽管2012 年才被发现并命名[4],但学者们逐渐发现它与肿瘤有着密不可分的关系。研究表明,铁死亡与包括结直肠癌[5]、乳腺癌[6]等在内的多种癌症预后相关,然而目前铁死亡及其相关基因在OSCC预后中的作用尚不完全清楚。本研究通过生物信息学的方法建立一个新的铁死亡相关基因(ferroptosis-related genes,FRGs)模型并验证其预测能力。
1 材料与方法
1.1 数据采集
从癌症基因组图谱(TCGA)数据库(https://portal.gdc.cancer.gov/)及GEO数据库(数据集:GSE27020)中收集OSCC患者的RNA-seq和临床资料;基于铁死亡数据库(http://www.zhounan.org/ferrdb/)共得到382 个FRGs。
1.2 生物信息学分析
对OSCC患者的RNA-seq进行LOG2转换分析,使用R软件(4.1.2版)LIMMA包筛选差异表达的FRGs 并聚类分析。使用单因素和多因素COX回归分析确定与OSCC患者预后相关的FRGs,用于后续预后模型构建。
1.3 FRGs预后模型的构建与验证
根据回归分析结果,合并每个FRGs的风险回归系数和风险比,建立风险评分公式,从而得到预后模型,计算公式如下:
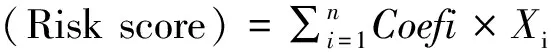
Coef代表FRGs的风险回归系数,X代表FRGs表达水平。基于该公式计算每位患者的风险评分,并根据风险评分的中位数将OSCC患者分为高风险组和低风险组。紧接着使用生存分析比较高低风险组OSCC患者的总生存率(overall survival,OS),受试者工作特征曲线(receiver operating characteristic,ROC)用于研究模型预测的准确性。通过单因素和多因素COX回归分析,探究风险评分在预测患者预后中的作用。
1.4 统计学分析
对于符合正态分布的基因表达数据使用非配对的学生t检验,而非正态分布的则使用Wilcox秩和检验。所有统计分析均使用R软件(版本4.1.2),P<0.05被认为差异有统计学意义。
2 结 果
2.1 筛选差异表达FRGs
从TCGA下载OSCC患者的RNA-seq中,共提取了245 个FRGs的表达值。按照FDR<0.05以及|log2(fold change)|>1/2的标准进行筛选,与非肿瘤组织对比,在OSCC组织中表达量下调基因有17 个,上调基因有44 个(图1)。
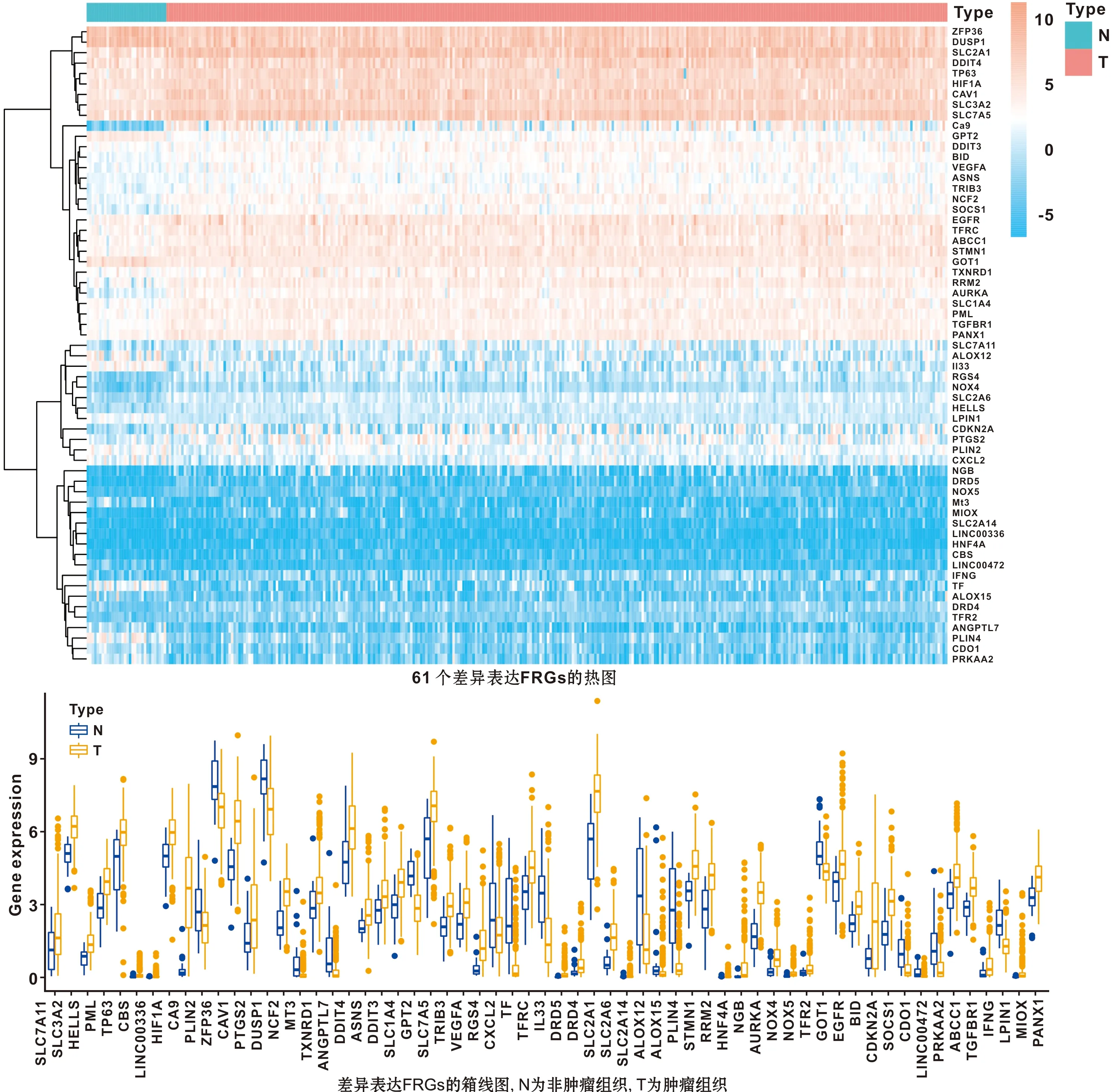
图1 差异表达的FRGs
2.2 预后模型的构建与验证
使用单因素和多因素COX回归分析61 个差异表达的FRGs,共得到3 个与预后显著相关的FRGs(图2A),然后构建预后模型。根据FRGs表达水平和风险回归系数,计算每位OSCC患者的风险评分。
风险评分=DDIT4表达量×0.002 725+AURKA表达量×0.027 942+GOT1表达量×0.020 395。
随后的生存分析结果表明,高风险组OS显著低于低风险组(P<0.001)(图2B)。ROC曲线显示1、3、5 年OS的AUC(areas under the curve)值分别是0.737、0.717和0.733(图2C),说明预后模型对于OSCC患者预后具有比较准确的预测能力。

图2 预后模型的构建及验证
2.3 风险评分可作为OSCC的独立预后因素
根据风险评分对OSCC患者进行排序, 用热图显示3 个FRGs在高低风险组之间的表达差异(图3A),结果表明DDIT4、AURKA、GOT1在高风险组中表达量均显著上升。进一步分析患者的生存状态,结果可见高风险组患者生存状态较差,死亡可能性比低风险组患者大(图3B~C)。结合患者临床参数,采用单因素COX回归分析可见年龄、性别、分级、肿瘤分期和风险评分均有显著差异(图3D),进一步多因素COX回归分析表明风险评分可以作为OSCC独立预后因素(图3E)(HR=2.134,95%CI=1.524-2.988)。总之,预后模型对预测OSCC患者预后的准确性已得到证实。
图3 风险评分是OSCC患者的独立预后因素
2.4 评估风险评分与临床参数的关系
接着,进行临床病理分析以探讨临床参数与风险评分之间的关系(图4A~G)。结果显示,风险评分与生存状态(P<0.001)、分级(P<0.01)、肿瘤分期(P<0.001)和T分期(P<0.001)显著有关,而与N分期、性别和年龄无关。通过绘制多因素独立ROC曲线来评估风险评分与其他临床参数预测能力的差异,如图4H,风险评分的AUC值为0.737,明显高于年龄、性别、分级、肿瘤分期、T分期、N分期的AUC值。随后,绘制T、N分期和风险评分联合ROC曲线(图4I),联合曲线AUC值为0.781,明显高于单独的风险评分以及任何一种临床参数的AUC值。这些结果表明,风险评分不仅比其他临床参数更能准确预测OSCC患者预后,还是TNM分期的有益补充手段。
2.5 预后模型外部验证
使用相同的风险评分公式计算GEO数据库中GSE27020数据集每个患者的风险评分,作为预后模型的外部验证。如前所述,根据风险评分的中位数将数据集中所有患者分为高低风险两组。生存曲线确如预期,高风险组OS显著低于低风险组(P<0.05),这一结果再次证实了预后模型的预测能力(图5A)。ROC曲线显示1、3、5 年OS的AUC值分别是0.719、0.697和0.671,也证明了该模型具有良好的预测预后能力(图5B)。遗憾的是由于缺乏性别、肿瘤T、N分期等临床资料,无法对其他临床参数进行ROC分析。这些验证性实验证实了本研究构建的预后模型在预测OSCC患者预后方面的突出能力。
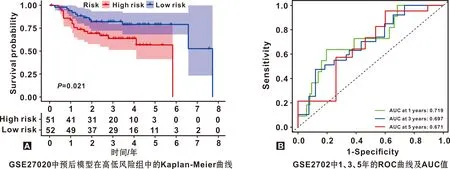
图5 FRGs预后模型在GEO数据集的验证
3 讨 论
作为细胞死亡的一种新类型,铁死亡的生化标志物和形态学特征与凋亡、坏死和自噬有着显著的不同[7],因此探究铁死亡在肿瘤中的作用也逐渐成为研究热点。据报道,在OSCC中一些铁死亡相关基因如SLC7A11[8], GPX4[9]影响着疾病的进展。但在OSCC中的研究也仅限于此,铁死亡在OSCC进展及预后中的作用尚不清楚。TCGA和GEO等大型数据库为学者们探索疾病发生发展提供了有效途径,二者目前在OSCC研究中已广泛应用[10-11]。在本研究中,利用TCGA和GEO数据库通过生物信息学方法探讨了铁死亡相关基因在OSCC预后中的作用。构建预后风险模型,并对模型的准确性进行验证。一系列结果表明根据预后模型得到的风险评分是一项有效的OSCC发生发展评价指标,对于预测OSCC患者预后具有较高准确性。
本文构建的预后模型包括3 个FRGs(DDIT4、AURKA、GOT1)。其中DDIT4(DNA损伤诱导转录物4),是在2002年第一次被发现[12]。近年来,学者们逐渐发现DDIT4可能作为癌基因在包括卵巢癌[13]、胃癌[14]、急性白血病[15]等在内的多种癌症中起到关键作用。AURKA在预后模型中具有最高正风险回归系数,全称为Aurora 激酶 A,属于丝氨酸/苏氨酸激酶家族。据报道在非小细胞肺癌、结直肠癌、卵巢癌、膀胱癌、胃癌等其他实体瘤[16-17]中具有重要的预后价值。除此之外,也有研究表明AURKA与放化疗敏感性有关[18-19]。GOT1(谷氨酸草酰乙酸转氨酶 1)于1950年首次发现[20],其大量存在于肝脏中并作为诊断肝脏疾病的重要生化指标应用于临床,同时还参与了对大脑神经元的保护[21]。此外,它在促进肿瘤细胞增殖和维持细胞氧化还原平衡方面也发挥着重要作用。鉴于 GOT1 是癌细胞中谷氨酰胺代谢的关键点,学者们开始探索GOT1在肿瘤中的作用并且发现其表达量在多种恶性肿瘤中上调[22-23]。可见,DDIT4、AURKA和GOT1是癌症治疗的潜在靶点,可提供重要的预后价值。但遗憾的是,目前仅有DDIT4在OSCC中有相应的研究[24],其余的FRGs在OSCC中尚没有很好的研究,有关它们在OSCC中的生物学功能也尚未见报道。
综上所述,本研究基于铁死亡相关基因构建了一个新的预后模型,可用于预测OSCC患者预后,并通过GEO数据库的独立队列进行了验证。为铁死亡在OSCC临床预后中的研究提供了一个新的见解,还应进一步探索该模型在临床决策中的应用,以验证本研究结果的有效性。

