基于整合药理学和转录组学的天龙咳喘灵抗特发性肺动脉高压可行性分析及作用机制
林范杰,李东蕾,林肯,陈少琪,卢文菊
1.呼吸疾病国家重点实验室,国家呼吸系统疾病临床医学研究中心,广州呼吸健康研究院,广州医科大学附属第一医院,广东 广州 510030;2.广州医科大学,广东 广州 510030
特发性肺动脉高压(idiopathic pulmonary arterial hypertension,IPAH)是一种罕见的肺血管增殖性疾病,病理特征为丛状病变、肺小动脉原位血栓形成及肺动脉平滑肌细胞(PASMCs)过度增殖与抗凋亡,最终可演变为右心衰竭。IPAH起病隐匿,临床表现多以疲劳、虚弱、呼吸短促、心绞痛和晕厥为主。结合现代医学理论,中医认为IPAH的关键病机在于心阳虚衰,病性证素主要为气滞、痰阻和血瘀,证型主要为大气下陷证、血瘀证、心气虚证和肺气虚证。但针对其辨证施治的医案记载甚少,缺乏易推广的中医疗法。另外,IPAH目前尚无法治愈。因此,寻找有效的抗IPAH药物具有重要意义。
天龙咳喘灵是国家级名老中医邱志楠教授根据“温肾化痰、活血逐瘀”学术理念研发的制剂,在肺病的基础实验与临床试验中已取得显著成效。天龙咳喘灵由10味药组成,方中熟附子有振奋肾中元阳,复其气化卫外之能;青天葵兼治痰瘀热,消痰解毒化瘀又不伤阴血耗气;炙麻黄、款冬花温肺平喘,擅治久咳久喘;法半夏温化痰饮、燥湿降逆;五味子敛肺而滋肾;鱼腥草、黄芩清肺泻火,清热燥湿;芥子、细辛温肺平喘,祛伏寒利肺。药理学研究表明,天龙咳喘灵能够显著提高慢性低氧性肺动脉高压大鼠血浆一氧化氮(NO)含量和一氧化氮合成酶(NOS)活力,减轻肺动脉内皮细胞的损伤,降低肺动脉压力。此外,还能抑制哮喘小鼠肺组织高表达的磷酸化信号转导及转录激活子3蛋白分子,而该分子可作为转录因子启动某些与血管平滑肌增生肥大相关基因的表达。可见,天龙咳喘灵的功效与IPAH疾病特点相契合,显示天龙咳喘灵用于抗IPAH具有研究价值和开发潜力。因此,本研究采用整合药理学和转录组学技术系统性探究天龙咳喘灵抗IPAH的可能作用机制,为IPAH的临床治疗提供依据。
1 资料与方法
1.1 天龙咳喘灵活性成分获取与筛选
通过TCMSP(https://tcmsp-e.com/)检索半夏、款冬花、附子、鱼腥草、北五味子、黄芩、芥子、细辛和麻黄的化合物信息,以口服生物利用度(OB)≥30%和类药性(DL)≥0.18为条件筛选药物活性成分。因TCMSP未收录青天葵,故利用本草组鉴(HERB,http://herb.ac.cn/)数据库获取青天葵的活性成分。
1.2 天龙咳喘灵活性成分靶点预测
通过HERB数据库获取每个活性成分对应的靶点信息;利用PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/)获取各活性成分的简化分子线性输入规范(simplified molecular-input line-entry system,SMILES)并依次导入SwissTargetPrediction数据库(http://www.swisstargetprediction.ch/)进行靶点预测,选择物种为“Homo sapiens”,以Probability≥0.5的靶点蛋白作为活性成分作用的靶点。两者进行合并、去重,通过UniProt数据库(https://www.uniprot.org/)对靶点蛋白名称进行标准化。
1.3 疾病靶点收集
以“idiopathic pulmonary arterial hypertension”为关键词,检索GeneCards(https://www.genecards.org/)、DisGeNET(https://www.disgenet.org/)数据库,所得结果合并、去除重复,将筛选出的靶点基因名称通过UniProt数据库进行规范。
1.4 药物-成分-疾病-靶点网络构建及分析
利用OmicShare平台(https://www.omicshare.com/)绘制天龙咳喘灵活性成分靶点和IPAH靶点的维恩图,存在交集的共同靶点可能是天龙咳喘灵抗IPAH的关键靶点。将天龙咳喘灵及其药味名、疾病名、关键靶点及对应的活性成分导入Cytoscape3.8.0软件,构建药物-成分-疾病-靶点网络并进行网络拓扑学分析,设置参数以节点大小反映其度值大小。
1.5 蛋白相互作用网络构建及分析
将关键靶点导入STRING数据库(https://stringdb.org/)构建蛋白相互作用(PPI)网络,设置蛋白种属为“Homo sapiens”,最低相互作用阈值为“highest confidence”(0.900)。将PPI网络导入Cytoscape3.8.0软件进行网络拓扑学分析,设置参数以节点大小和颜色深浅反映其度值大小,以边的粗细反映结合率评分高低。
1.6 GO和KEGG通路富集分析
采用R clusterProfiler 3.16.1软件对关键靶点进行GO和KEGG通路富集分析。GO富集分析包括生物过程(biological process,BP)、分子功能(molecular function,MF)和细胞组分(cellular component,CC)三部分,保留校正后的值(.adjust)<0.01的结果;通过KEGG通路富集分析以确定关键靶点的作用通路,保留.adjust<0.01的结果。
1.7 分子对接验证
将所有核心成分与核心靶点进行分子对接,并用临床治疗IPAH的靶向药物依前列醇、西地那非和波生坦进行对照。首先通过PubChem数据库获得各核心成分的SDF文件,依次导入殷赋云计算平台(https://cloud.yinfotek.com/console/)的“小工具-准备化合物结构”进行加氢、加电荷和MMFF94力场下能量优化。利用AutoDockTools1.5.6软件依次检测可旋转键的数目,纳入可旋转键数<10的核心成分进行对接。对于核心靶点,首先利用RCSB PDB数据库(http://www.rcsb.org/pdb)依次获得PDB文件,蛋白种属设置为“Homo sapiens”,实验方法选择X射线衍射,筛选综合分辨率、得分最高的蛋白结构,并导入殷赋云计算平台的“小工具-处理PDB结构”对蛋白质进行隐藏溶剂、去水和去配体。经AutoDockTools1.5.6软件处理后,将核心成分和核心靶点导入AutoDock4.2.6进行分子对接,采用拉马克遗传算法对二者的最佳结合位点进行预测,设置初始种群数为150、能量评定最大次数为2500 000、对接的构象数目为50个,其他参数选择默认值。以结合能作为评价指标,使用PyMOL2.4软件对构象进行可视化及氢键绘制。靶向药物的处理流程同上。
1.8 核心靶点的微阵列芯片验证
为检验核心靶点可靠性,以“idiopathic pulmonary arterial hypertension”为关键词,检索美国国立生物技术信息中心(NCBI)的GEO数据库(https://www.ncbi.nlm.nih.gov/geo/),筛选IPAH相关的微阵列芯片数据集。数据采用Robust-Multi-Array(RMA)方法进行背景矫正和log标准化处理。使用R PCAtools 2.5.15进行主成分分析并进行可视化,检查样本聚类的一致性。然后利用GEO2R在线平台(https://www.ncbi.nlm.nih.gov/geo/geo2r/)筛选IPAH样本的差异表达基因(DEGs),筛选阈值为.adjust<0.05和|log2FC|>1,利用R EnhanceVolcano 1.6.0绘制火山图。最后将DEGs与核心靶点取交集,验证上述分析的准确性。
1.9 xCell评分估计和相关性分析
使用R xCell 1.1.0进行评分,估计数据集中IPAH组与对照组之间64种免疫细胞和基质细胞类型的丰度。使用R ggplot23.3.5和R ggpubr 0.4.0绘制箱线图,以可视化2组之间所有细胞类型丰度的差异。采用克鲁斯卡尔-沃利斯检验(Kruskal-Wallis test)进行显著性检验,<0.05表示差异有统计学意义,再根据Travaglini等人类肺部细胞图谱筛选差异细胞类型。然后使用R ggstatsplot 0.9.0对核心靶点和差异细胞类型进行Spearman相关性分析并进行显著性检验,<0.05表示差异有统计学意义。
2 结果
2.1 天龙咳喘灵活性成分
通过TCMSP数据库检索并筛选得到除青天葵外天龙咳喘灵的活性成分,分别为半夏13个、款冬花22个、附子21个、鱼腥草7个、北五味子8个、黄芩36个、芥子3个、细辛8个和麻黄23个。通过HERB数据库获得青天葵活性成分33个。两者合并、去重后得到160个活性成分,部分活性成分基本信息见表1。
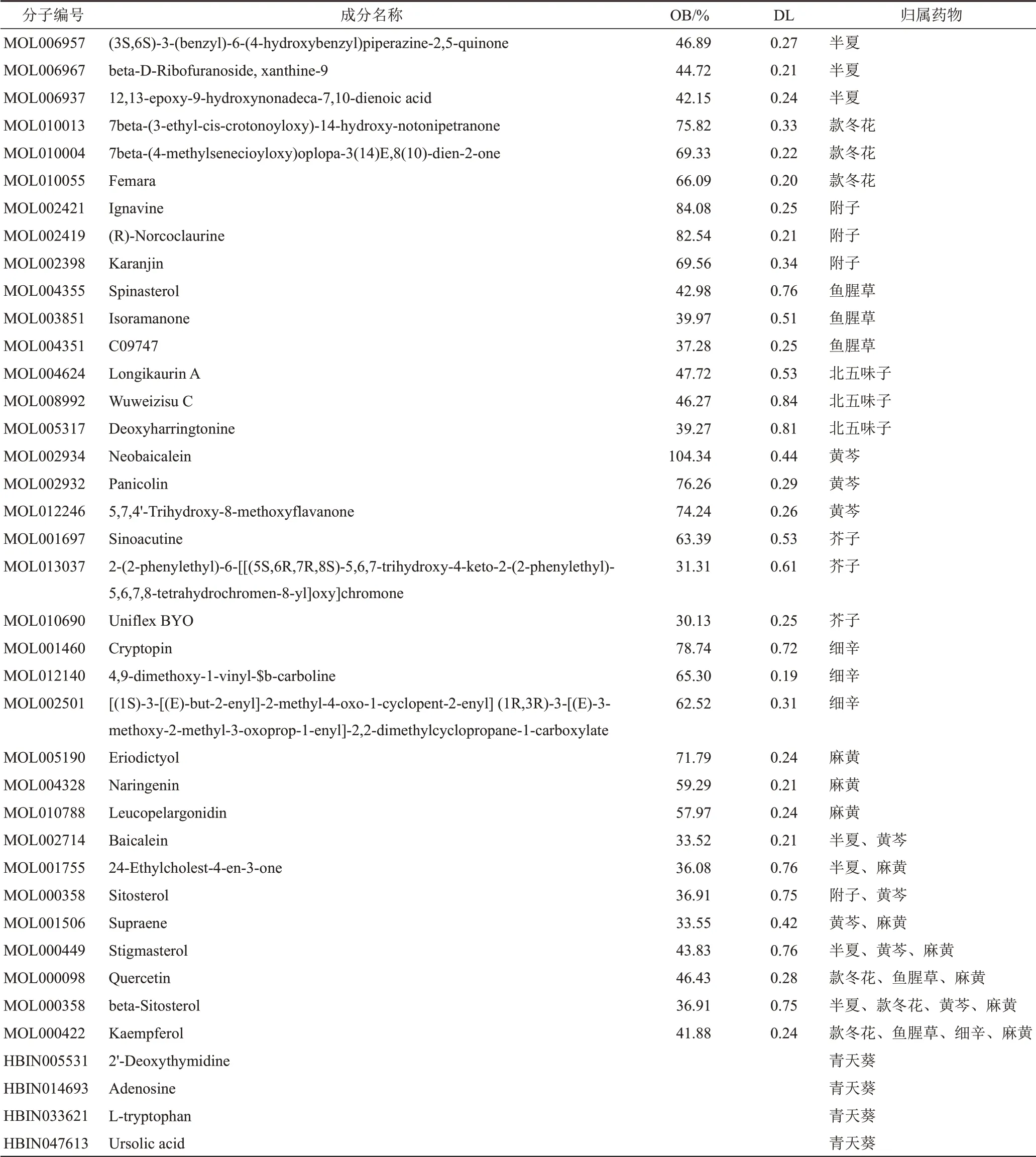
表1 天龙咳喘灵部分活性成分基本信息
2.2 药物-成分-疾病-靶点网络
160个活性成分通过HERB、SwissTargetPrediction数据库查找到潜在关联靶点957个,通过GeneCards、DisGeNET数据库检索出IPAH相关靶点86个,将药物活性成分靶点与疾病靶点取交集,获得38个共同靶点,即天龙咳喘灵抗IPAH的关键靶点,维恩图见图1。利用Cytoscape3.8.0软件构建药物-成分-疾病-靶点网络,见图2。

图1 天龙咳喘灵活性成分、天龙咳喘灵与IPAH共同靶点维恩图

图2 天龙咳喘灵抗IPAH药物-成分-疾病-靶点网络
该网络由121个节点(1个疾病名、1个药物名、10个药味名、71个活性成分和38个关键靶点)和294条边组成。将109个节点和214条边(除去疾病名、药物名、药味名和相连成分的边)纳入网络拓扑学分析。所有活性成分平均度值为4.07,高于均值的活性成分有9个,将其作为天龙咳喘灵抗IPAH的核心成分;所有靶点平均度值为3.93,高于均值的靶点有13个。核心成分及筛选后的靶点见表2。

表2 天龙咳喘灵抗IPAH药物-成分-疾病-靶点网络拓扑学分析
2.3 蛋白相互作用网络和核心靶点
将38个关键靶点导入STRING数据库构建PPI网络,见图3。该网络包括32个节点和75条边(其中6个靶点不连接其他蛋白,故不显示)。经Cytoscape3.8.0软件网络拓扑学分析,各节点的平均度值为4.69,平均介数为0.05,平均接近中心性为0.46,平均最短路径长度为2.34。度值、介数、接近中心性均高于均值且平均最短路径长度低于均值的靶点共有3个,见表3。综合表2、表3,PTGS2、NOS2、ADRB2和VEGFA可能是天龙咳喘灵抗IPAH的核心靶点。
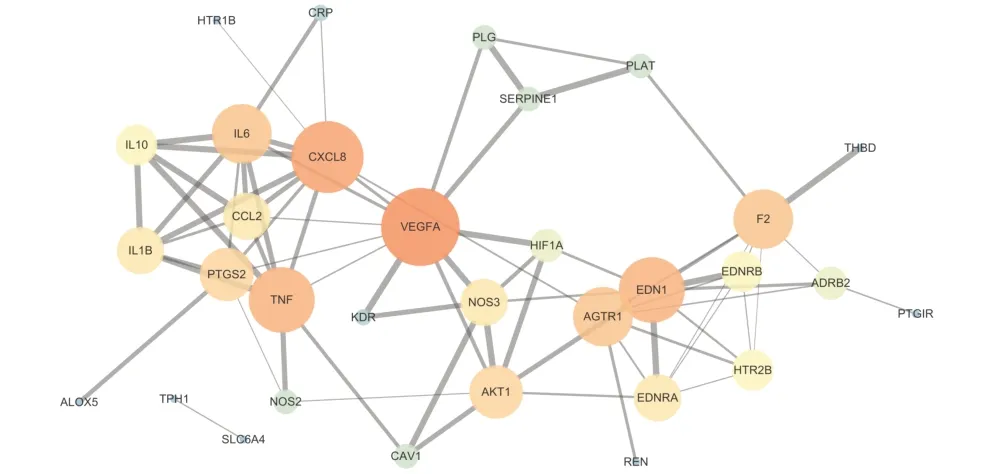
图3 天龙咳喘灵抗IPAH关键靶点PPI网络
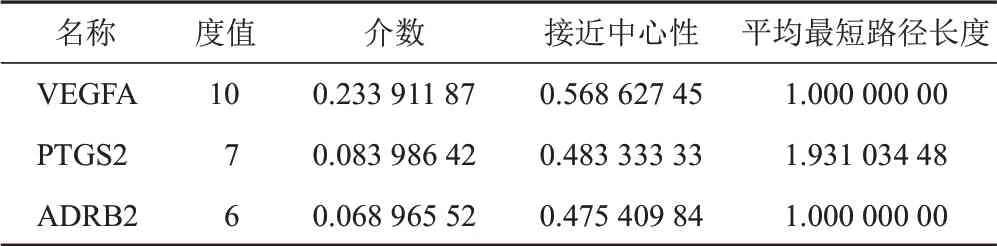
表3 天龙咳喘灵抗IPAH PPI网络关键靶点基本信息
2.4 GO富集分析
38个关键靶点GO富集分析得到958个显著富集条目(.adjust<0.01),其中BP条目925个,涉及循环系统中的血管过程、管径调节、血管直径调节等;CC条目11个,涉及膜筏、膜微区、小窝等;MF条目22个,涉及细胞因子活性、受体配体活性、细胞因子受体结合等。根据.adjust值从小到大选取前10位BP、MF、CC条目绘制气泡图,见图4。
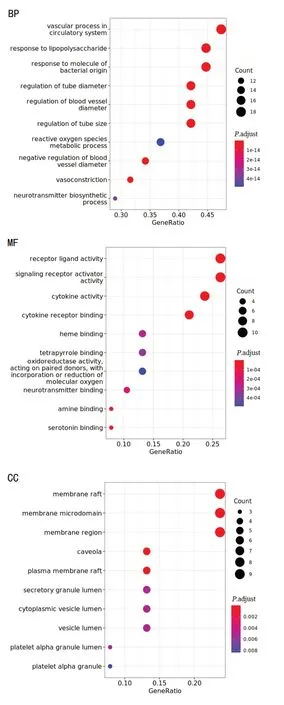
图4 天龙咳喘灵抗IPAH关键靶点GO功能富集分析
2.5 KEGG通路富集分析
38个关键靶点显著富集在48条通路上(.adjust<0.01)。根据.adjust值从小到大选取前10条通路,见图5。主要通路有糖尿病并发症AGE-RAGE信号通路、血流剪切应力与动脉粥样硬化、HIF-1信号通路、TNF信号通路和钙信号通路等,提示天龙咳喘灵通过作用于多条通路发挥治疗IPAH的作用。
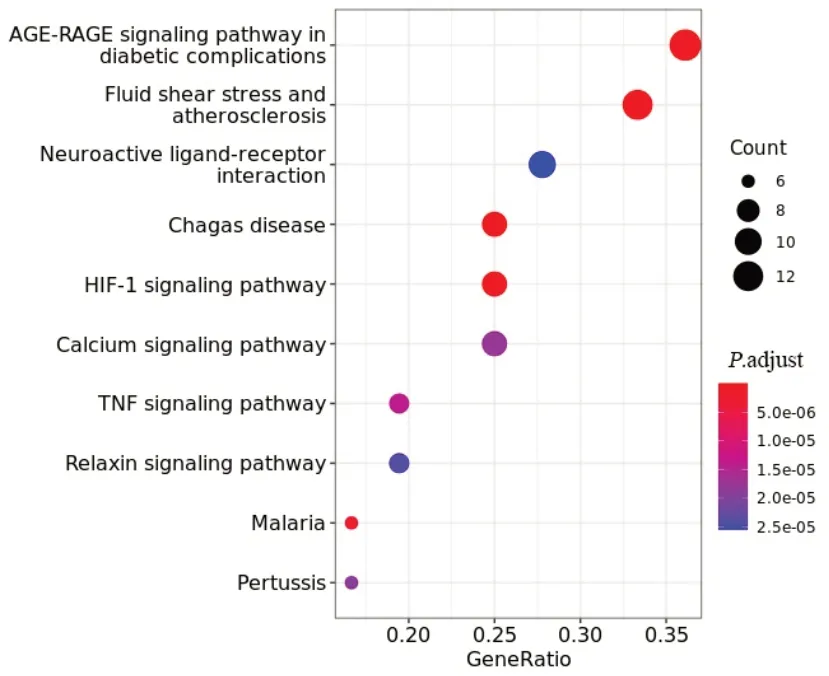
图5 天龙咳喘灵抗IPAH关键靶点KEGG通路富集分析
2.6 分子对接验证
核心成分、靶向药物与核心靶点分子对接结果见表4。一般认为,受体蛋白与配体结合能≤0 kcal/mol提示二者存在自发结合,结合能≤-5 kcal/mol时可能具有较好的结合活性。分子对接结果显示,核心成分与核心靶点几乎均可自发结合,其中PTGS2与槲皮素、木犀草素、2"-脱氧胸苷、熊果酸、山柰酚、汉黄芩素和隐品碱的结合能均小于-5 kcal/mol;NOS2与木犀草素、熊果酸、山柰酚、汉黄芩素和隐品碱的结合能均小于-5 kcal/mol;ADRB2与槲皮素、木犀草素、熊果酸和隐品碱的结合能均小于-5 kcal/mol;VEGFA与熊果酸和隐品碱的结合能均小于-5 kcal/mol。熊果酸与各核心靶点的平均结合能最小,表明熊果酸与核心靶点的结合活性最好,且优于依前列醇、西地那非和波生坦的结合活性。分子对接模式见图6,显示熊果酸与核心靶点受体蛋白周围分子通过氢键等范德华力形成较为稳定的构象。
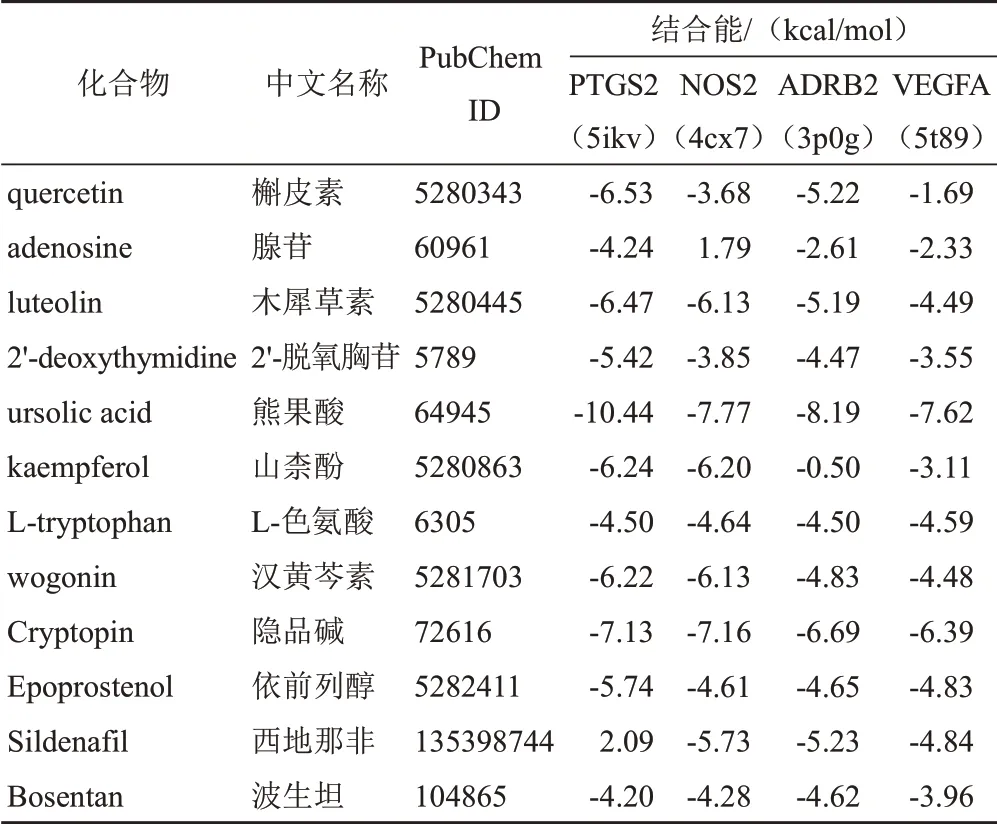
表4 天龙咳喘灵抗IPAH核心成分、靶向药物与核心靶点分子对接结果
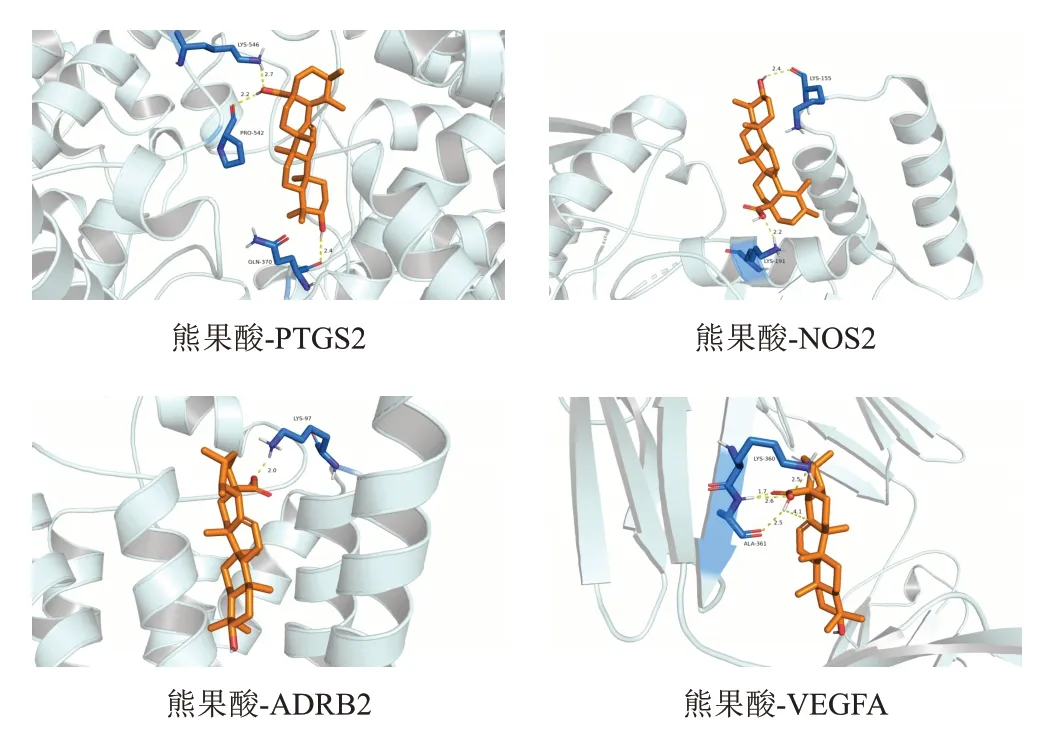
图6 熊果酸与核心靶点分子对接模式
2.7 核心靶点微阵列芯片验证结果
最终选定微阵列芯片数据集GSE130391。该数据集基于GPL570 Affymetrix Human Genome U133 Plus 2.0阵列平台,包含4例IPAH患者和4名健康人肺动脉的RNA样本,主成分分析结果见图7,4例IPAH患者与4名健康人的基因表达谱区分度良好,可保证后续差异表达分析的准确性。最终筛选得到DEGs共2469个,其中表达上调1361个、下调1108个,组间差异火山图见图8。DEGs与核心靶点取交集后得到2个交集基因,分别为PTGS2和VEGFA,表明上述分析可靠。

图7 IPAH数据集样本主成分分析
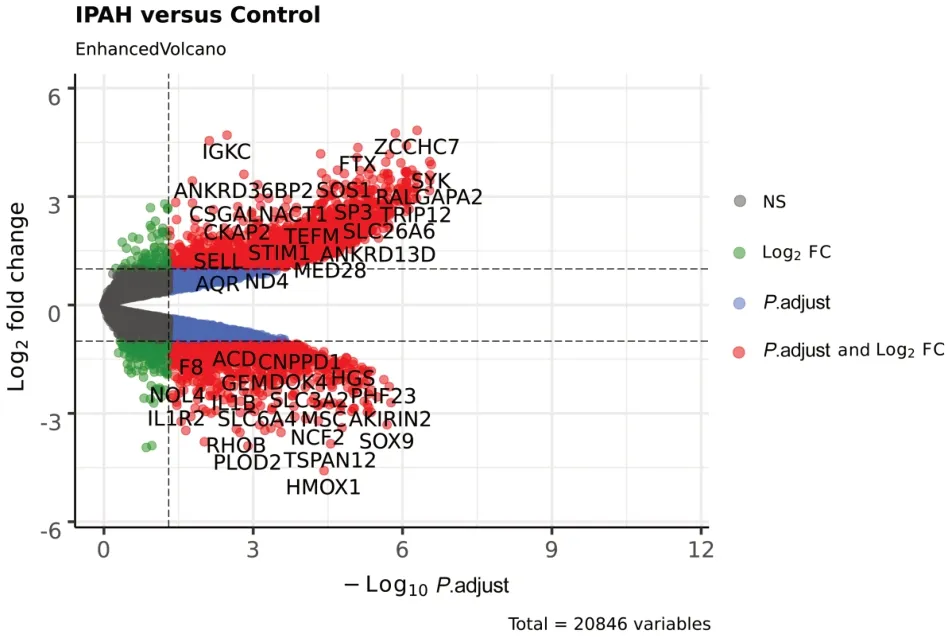
图8 IPAH数据集样本DEGs火山图
2.8 xCell评分估计结果
IPAH组与对照组之间64种免疫细胞和基质细胞类型的丰度差异见图9。组间共有27种细胞类型差异有统计学意义(<0.05),再根据人类肺部细胞图谱进一步筛选差异细胞类型,保留上皮细胞(Epithelial cells)、CD8阳性T细胞(CD8+T cells)、B细胞(B cells)、树突状细胞(DC)、内皮细胞(Endothelial cells)、CD8阳性幼稚T细胞(CD8+naive T cells)、CD4阳性幼稚T细胞(CD4+naive T cells)、CD4阳性效应记忆型T细胞(CD4+Tem)、浆细胞(Plasma cells)、自然杀伤T细胞(NKT)、周细胞(Pericytes)和M1型巨噬细胞(Macrophages M1)12种细胞类型作为最终的差异细胞类型。

图9 IPAH数据集样本64种细胞类型丰度箱线图
2.9 核心靶点与差异细胞类型相关性分析
相关性分析结果表明,PTGS2与自然杀伤T细胞(=0.74,=0.037)、树突状细胞(=0.74,=0.037)、上皮细胞(=0.74,=0.037)、周细胞(=0.71,=0.047)呈正相关,与CD4阳性效应记忆型T细胞(=-0.85,=0.007)、B细胞(=-0.79,=0.027)、CD8阳性T细胞(=-0.57,=0.037)、CD4阳性幼稚T细胞(=-0.74,=0.037)呈负相关。VEGFA与B细胞(=-0.86,=0.007)和CD4阳性效应记忆型T细胞(=-0.80,=0.017)呈负相关,而ADRB2、NOS2与所有差异细胞类型无相关性。
3 讨论
天龙咳喘灵针对肺系疾病病机特点,以“温肾化痰活血”为核心理念,治疗IPAH患者气虚不固、血行不畅、湿邪阻滞等病证,对改善血管功能障碍、血栓形成等病理表现具有潜在功效。由于天龙咳喘灵多成分、多靶点、多通路的作用特点,需借助高通量测序技术、计算机辅助技术、药物相关数据库等多学科交叉的基础上对药物的作用机制进行多维度探索。因此,本研究基于整合药理学和转录组学的方法对天龙咳喘灵抗IPAH进行可行性分析并探讨其作用机制。
通过网络药理学和分子对接发现,天龙咳喘灵中抗IPAH相关的核心成分共9个,其中与核心靶点结合活性最好且优于对照药物的是熊果酸。熊果酸存在于青天葵中,具有抗炎、抗肿瘤血管生成、抗氧化及降血压等多种药理作用。同时,熊果酸可改善阿霉素处理小鼠的左心室缩短率和左心室射血分数,提高NO水平,抑制活性氧生成,减少心肌细胞凋亡。此外,熊果酸还可以通过调节过氧化物酶体增殖物激活受体α依赖的脂肪酸代谢抑制野百合碱处理大鼠的右心功能障碍与重构、心肌肥大、纤维化和心肌细胞凋亡。NO缺乏与右心衰竭均为IPAH的病理特征,表明熊果酸具有抗IPAH潜在功效。除熊果酸外,青天葵中的2"-脱氧胸苷和L-色氨酸作为核心成分均可与核心靶点稳定结合。而青天葵作为天龙咳喘灵的君药,高度提示天龙咳喘灵抗IPAH存在较大的可行性。
通过药物-成分-疾病-靶点网络和PPI网络分析,从38个疾病靶点中筛选出4个核心靶点PTGS2、NOS2、ADRB2和VEGFA。PTGS2可将花生四烯酸代谢成特定的前列腺素(PG)产物,研究表明该基因在病理条件下起到双刃剑作用,一方面刺激促炎细胞因子产生而加重炎症反应,另一方面促进具有心血管保护作用的前列环素产生,或增加肺血管内皮细胞中PGE2的合成以维持血管微环境稳态,甚至纯合敲除PTGS2小鼠在慢性缺氧条件下产生更严重的肺动脉高压(PAH),提示该基因在PAH的发生发展中起到关键作用。NOS2通过半胱氨酸蛋白酶-1激活后可以产生大量NO,而过量的NO会引起氧化应激,最终导致肺动脉和右心重塑。ADRB2编码β肾上腺素能受体,研究表明其信号转导作用在PAH中呈现阶段性变化:活化的β肾上腺素能受体在病程早期对右心室具有保护作用,并可能通过促进M2型巨噬细胞的募集改善肺血管重构,对PAH的治疗具有潜在益处。而在病程晚期则可能激活β-AR-G-PKA/CaMKⅡ信号通路而促进右心重塑和心肌细胞凋亡增加,最终导致右心衰竭。VEGFA是血管内皮生长因子家族的成员,能够促进血管内皮细胞增殖和血管生成,通过PI3K/AKT信号通路抑制血管内皮细胞凋亡,维持内皮细胞的活性,有助于肺部受损微血管再生和防止现有血管丢失,延缓PAH的发生发展。
鉴于核心靶点与IPAH关联的研究较少,因此借助xCell评估和相关性分析发现,PTGS2与自然杀伤T细胞、树突状细胞、上皮细胞和周细胞呈显著正相关,与CD4阳性效应记忆型T细胞、B细胞、CD8阳性T细胞和CD4阳性幼稚T细胞呈负相关,VEGFA与B细胞和CD4阳性效应记忆型T细胞呈显著负相关。研究表明CD4阳性效应记忆型T细胞、CD8阳性T细胞、CD4阳性幼稚T细胞、B细胞和树突状细胞在IPAH的病程进展中起重要作用;IPAH患者体内免疫紊乱,存在自身免疫病理损伤,可能是自然杀伤T细胞缺乏的主要因素;PAH患者周细胞功能缺陷可导致肺血管再生障碍。因此,我们推测PTGS2通过升高自然杀伤T细胞、树突状细胞和周细胞,或减少CD4阳性效应记忆型T细胞、CD8阳性T细胞、CD4阳性幼稚T细胞、B细胞,VEGFA通过减少B细胞和CD4阳性效应记忆型T细胞参与IPAH的发生发展。以上假设还需进一步研究来阐明核心靶点和免疫细胞及其他细胞类型之间复杂的相互作用。
GO富集分析表明,天龙咳喘灵抗IPAH可能通过调节血管的多种生理功能、能量代谢过程,涉及神经递质、血红素、不同细胞组分的蛋白质等多种物质发挥疗效。KEGG通路富集分析表明,天龙咳喘灵抗IPAH可能主要涉及糖尿病并发症AGE-RAGE信号通路、血流剪切应力与动脉粥样硬化、HIF-1信号通路、钙信号通路等。血流剪切应力是内皮细胞稳态的关键因素,当内皮细胞稳态失衡会导致丛状病变、慢性炎症细胞浸润和肺动脉原位血栓形成等IPAH特征性病理改变,因此可以通过调节血流剪切应力来改善内皮细胞功能障碍。缺氧诱导因子(HIF)-1α是应答缺氧应激的关键蛋白,有研究表明,在人肺动脉平滑肌细胞中使用siRNA敲除HIF-1α可以增加miRNA-543的表达,从而上调内皮素-1(ET-1)的表达。ET-1通过细胞膜上的ET-1受体直接作用于人PASMCs,增加肺动脉血管张力。另外,在IPAH患者的上皮细胞中HIF-1α显著表达,刺激血管和红细胞的生成。PASMCs胞浆内游离Ca浓度的增加也是促使血管收缩和刺激肺动脉平滑肌肥厚的重要因素,已有研究证实,急性血管反应试验阳性的IPAH患者受益于钙通道阻滞剂,因此调节钙信号通路对治疗IPAH具有重要意义。可以看出,天龙咳喘灵可能通过IPAH的关键信号通路来发挥治疗作用。
综上所述,本研究通过整合药理学和转录组学预测了天龙咳喘灵抗IPAH的核心成分及核心靶点的潜在作用机制,提示天龙咳喘灵可能通过熊果酸等活性成分靶向PTGS2、NOS2、ADRB2和VEGFA基因,调节B细胞、树突状细胞、CD8阳性T细胞、CD4阳性幼稚T细胞等细胞类型,调控血流剪切应力与动脉粥样硬化、HIF-1信号通路、钙信号通路等多条通路发挥治疗作用,可为后续天龙咳喘灵抗IPAH的药理学研究和临床试验提供理论依据和丰富线索。

