凋落物及氮添加对针阔叶林土壤氮和水解氨基酸的影响①
廖从梅,王梦思,马红亮*,高 人,尹云锋
凋落物及氮添加对针阔叶林土壤氮和水解氨基酸的影响①
廖从梅1,2,王梦思1,2,马红亮1,2*,高 人1,2,尹云锋1,2
(1 福建师范大学湿润亚热带山地生态国家重点实验室培育基地,福州 350007;2 福建师范大学地理科学学院,福州 350007)
为探究凋落物对森林土壤氮的影响及氮沉降的调节,本研究以亚热带天然阔叶林(罗浮栲林)和人工针叶林(杉木林)2种林型土壤和凋落物为对象,分别设置土壤(对照)、土壤+凋落物(3倍添加)、土壤+氮(120 mg/kg)、土壤+凋落物(3倍添加)+氮(120 mg/kg) 4种处理,每种处理设置3个重复,进行为期一年的室内模拟淋溶试验,分析土壤可溶性氮和物理分级后各粒径土壤水解氨基酸变化。结果表明:与对照比较,阔叶林土壤添加凋落物处理增加土壤铵态氮和游离氨基酸,而降低硝态氮含量;氮添加降低针叶林土壤氨态氮,增加硝态氮含量,但是增加阔叶林土壤铵态氮和游离氨基酸;凋落物添加的情况下,氮添加显著增加阔叶林土壤硝态氮含量。土壤的各粒径组分分布比例差异显著,氮添加倾向于降低针叶林土壤大粒径、增加小粒径分配比例,而阔叶林相反。针叶林土壤添加凋落物显著增加土壤粒径组分2 000 ~ 250 μm、20 ~ 2 μm、<2 μm水解氨基酸含量;氮添加增加针叶林全土、2 000 ~ 250 μm和20 ~ 2 μm粒径水解氨基酸含量;在凋落物添加或氮添加情况下,氮添加或凋落物显著降低全土、250 ~ 53 μm、53 ~ 20 μm粒径水解氨基酸含量。而凋落物和氮添加对阔叶林土壤水解氨基酸含量的影响基本上相反。可见,不同土壤粒径组分水解氨基酸(作为可矿化氮)响应凋落物和氮添加处理的差异,有望作为揭示针阔叶林可溶性氮变化的指标。
森林土壤;可溶性碳氮;水解氨基酸;物理分级
大气氮沉降在过去一个世纪增加了3 倍~ 5倍,并将继续增加,这可能会对陆地生态系统的生物地球化学循环产生深远的影响[1]。20世纪80年代以来,中国氮沉降的增加及其对生态系统的影响一直是人们关注的问题。Chen等[2]研究表明,氮添加并没有显著改变常绿阔叶林土壤全氮的浓度;Fan等[3]发现,长期施氮肥(近40 a)后不利于土壤氮素固定;而武星魁等[4]认为,长期施高量氮肥土壤有机氮素矿化和硝化速率显著降低。由此可见,氮沉降对土壤氮循环机制尚未明晰,有待进一步探究。土壤有机氮由多种氮化合物组成,从高分子量多酚结合的氮到低分子量氨基酸[5],而氨基酸是凋落物归还土壤过程中有机氮分解的重要产物,因其具有更高的周转率,可以被土壤微生物快速地利用和矿化[6]。因此,氮沉降对土壤活性氮组分的影响与全氮相比可能更明显。综上,氮沉降对土壤氮的影响,可能与氨基酸氮库的变化有关。
地上凋落物及其分解是氮输入土壤的主要方式,凋落物可以改变土壤中氮的获得、损失或保留量[7]。Xu等[8]在整合分析中发现,温带及亚热带森林凋落物添加对矿质土壤全氮无显著影响;而Miao等[7]发现,针阔混交林凋落物不改变土壤全氮含量,却强烈地改变了有效氮的含量。凋落物还可通过改变土壤团聚体结构及氮的分布来影响土壤氮含量[9]。另外,不同类型生态系统凋落物对土壤氮循环的影响也有所差异。例如,亚热带森林凋落物分解促进土壤总硝态氮固定[10],而热带森林中添加枯枝落叶增加了硝态氮的迁移率[11]。不同性质的有机物输入也会影响土壤硝态氮变化[12]。已有研究发现,氮沉降可促进人工杉木林凋落物分解[13]、抑制米高肉桂凋落叶分解[14],甚至有模型研究报道氮添加先促进后减缓凋落物的分解[15]。Kiikkilä等[16]还发现氮添加使银桦和挪威云杉凋落物先分解物质影响后期阶段分解物的性质,从而改变凋落物分解动态。由此可见,凋落物对土壤氮的影响可能会因氮沉降而发生变化。土壤有机质(SOM)可分为由相对未分解的轻质碎片组成的颗粒有机物(POM)和主要由微生物分解产物形成的矿物结合有机物(MAOM)[17-18]。一般而言,POM不稳定且周转快,而MAOM较稳定且周转慢,氮沉降和凋落物分解对它们的影响可能会大不相同。本研究选择性质不同的针叶林和阔叶林,探究氮和凋落物添加对亚热带森林土壤可溶性氮的影响,以及不同粒径土壤水解氨基酸的响应差异,从凋落物输入和氮添加影响的角度,阐明它们在土壤氮变化中的作用和关系,以期为进一步研究氮沉降影响土壤氮循环机理提供理论基础。
1 材料与方法
1.1 研究区概况和样品采集
研究地区位于福建省建瓯市万木林自然保护区(27°03′N,118°09′E),为研究中亚热带不同植被类型土壤对氮沉降和凋落物分解的响应,本研究选取了保护区内以罗浮栲(,CAF)为优势种的天然林和以杉木(,CUL)为优势种的人工林为对象。
各林分特征及样地基本概况详见参考文献[19]。于2018年12月末在每个样地上、中、下坡取3个样点,采集0 ~ 20 cm土壤作为土壤样品,挑除石头、根系以及凋落物,充分混匀后,用自封袋将新鲜土壤样品密封于4 ℃ 保存。同时利用环刀采取原状土以测定土壤饱和持水量( water holding capacity,WHC)。凋落物样品来自各林分凋落物隔离样地,凋落物采用尼龙网隔离,网上凋落物每隔1 ~ 2月清理一次,保证凋落物为新进完整的凋落物。同时为保证凋落物性质一致,采取一次性收集齐凋落物样品。土壤基本理化性质采用常规分析法[20]测定,试验培养土壤和凋落物基本性质见表1。
1.2 试验设计
试验共设置4个处理:土壤(S,对照)、土壤表面覆盖凋落物(LS)、土壤添加氮 (NS) 、土壤表面添加氮和凋落物(NLS),凋落物按照野外采集枝叶比例混合添加。野外采集的土壤样品,去除碎石根系等杂物,过8 mm筛,置于350 ml注射器中(采用60目尼龙网和玻璃棉铺垫底部防止土壤颗粒渗漏),土壤体积为196.35 cm3。根据土壤容重计算出所需土壤干重,针叶林为235.62 g,阔叶林为196.35 g。凋落物剪碎成约1 cm碎片后,均匀平铺于土壤表面。根据野外单位面积年凋落物现存量[21]来确定凋落物添加量为12.5 g/kg土(以干重计),3倍添加凋落物为针叶林2.84 g、阔叶林3.87 g。土壤水分条件调整至60% 饱和持水量(60% WHC),预培养20 d。根据样地年平均降雨量(1 673.3 mm)计算淋溶水量,在培养期间,氮以NH4Cl中的N计,每次淋溶水量为110 ml,培养期间、预培养后共设置5次淋溶(第0、60、120、180、220天)。在正式培养的第1天开始第一次淋溶。氮添加量针叶林为18.85 mg、阔叶林为15.71 mg,之后4次淋溶的氮添加量均为针叶林2.36 mg、阔叶林1.96 mg,总施氮量为120 mg/kg。在培养期间,通过称重法保持土壤水分恒定,根据培养时间设计每次加水量和加水次数,共淋溶5次,每次淋溶之后待土壤水分下降至60% WHC以下再行调整,含水量维持在60% WHC。温度设置为25 ℃,为期培养365 d。培养结束后,一部分全土壤测定铵态氮、硝态氮、游离氨基酸;其余的土壤进行物理分级,得到的各粒径土壤用于测定水解氨基酸总量。

表1 试验土壤和凋落物基本性质
注:表中小写字母不同表示不同林分土壤样品之间差异显著(<0.05),大写字母不同表示不同林分凋落物样品间差异显著(<0.05)。数值为平均值±标准差(=3),下同。
1.3 试验方法
1.3.1 土壤分级 将培养结束后的土壤进行物理分级,方法如图1所示[22-23],即将自然风干后的全土壤进行干筛、超声分散、湿筛、离心得到相应粒径的土壤颗粒。分级结束后,将各粒径土壤样品进行冷冻干燥,装入自封袋,置于干燥器存放,便于进一步分析。
1.3.2 测定方法 培养前的土壤含水量用烘干法测定;土壤容重和饱和持水量用环刀法测定;土壤全碳、全氮含量用碳氮元素分析仪(Elemantar vario MAX CN,德国)测定;土壤铵态氮和硝态氮采用0.5 mol/L K2SO4(水土质量比为 5︰1)浸提,振荡30 min (250 r/min),离心10 min(4 000 r/min),过滤后连续流动分析仪(SKALAR SAN++,荷兰)测定;游离氨基酸用茚三酮比色法测定[24]。培养结束后,对土壤进行物理分级的各个粒径土壤水解氨基酸用6 mol/L HCl在105 ℃下水解24 h后,pH调至中性,用茚三酮比色法测定。
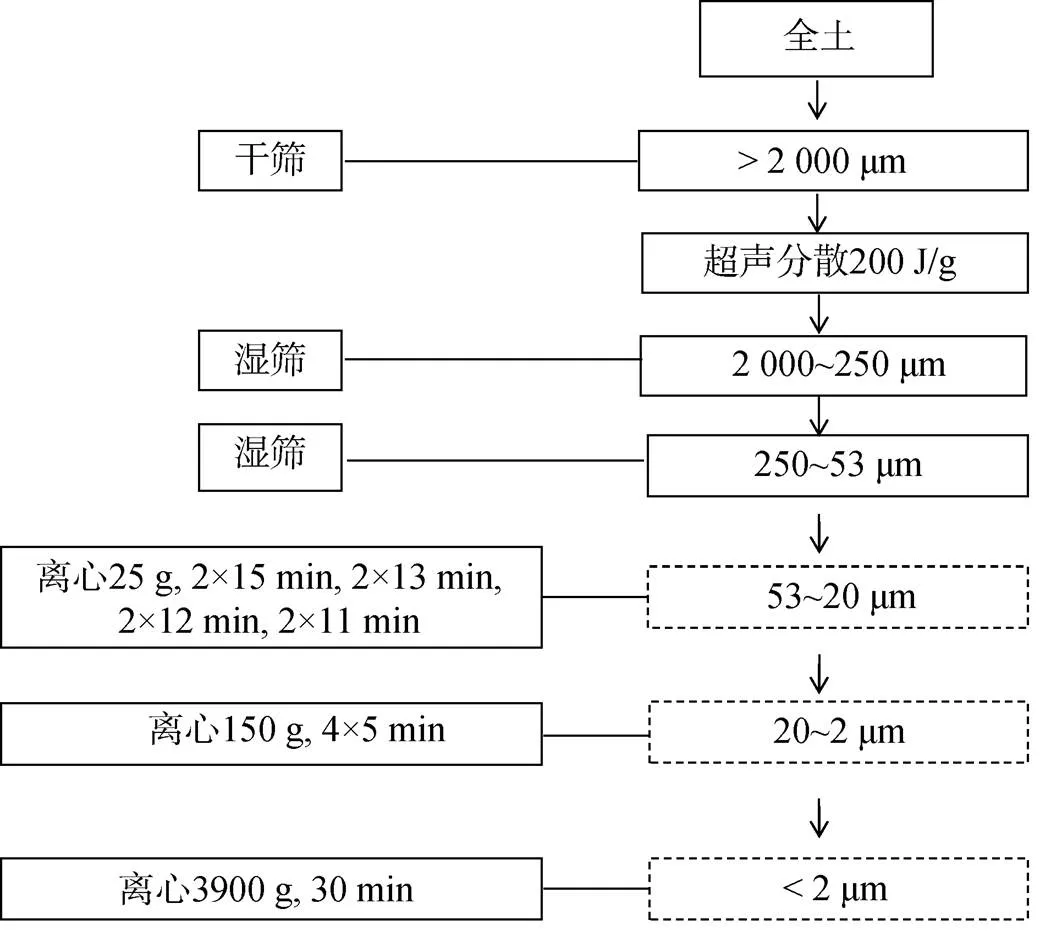
图1 土壤物理分级方案
1.4 数据处理
采用Excel 2016和Origin 9.0软件对数据进行统计分析和作图,运用SPSS 24.0通过单因素方差分析(one-way ANOVA)和最小显著性差异法(LSD)分析各指标在处理间的差异显著性(α=0.05),运用双因素方差分析(two-way ANOVA)统计凋落物和施氮及其交互作用对各指标的影响,运用三因素方差分析(three way ANOVA)统计氮、凋落物及土壤物理分级组分三者交互作用对土壤水解氨基酸的影响。所有数据均为平均值±标准差。
2 结果与分析
2.1 凋落物和氮添加对两种林型土壤可溶性氮的影响
由图2A可知,与S比较,NS处理针叶林土壤铵态氮含量显著降低了18.4%,硝态氮含量显著上升39.2%,游离氨基酸含量仅降低8.1%;与LS处理相比,NLS处理铵态氮含量降低了10.8%,而硝态氮含量显著升高33.3%,游离氨基酸含量显著降低12.0%。方差分析(表2)显示,对于针叶林土壤,仅氮添加对铵态氮和硝态氮有显著影响(<0.01)。
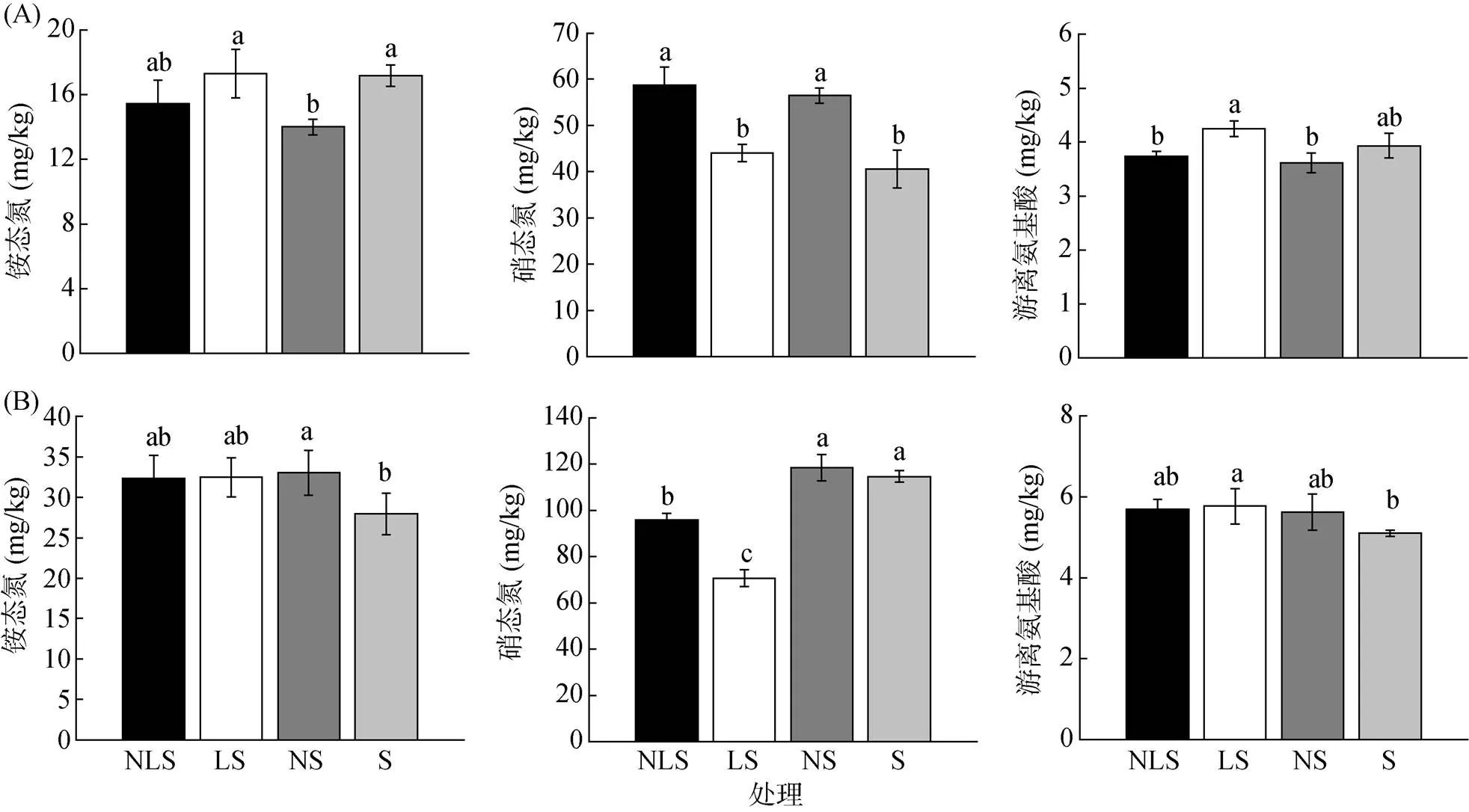
(图中小写字母不同表示处理间差异显著(P<0.05))
对于阔叶林土壤(图2B),与S处理相比,LS处理铵态氮含量增加16.1%,而硝态氮含量显著降低38.4%,游离氨基酸含量显著增加13.1%;与NS相比,NLS处理的硝态氮含量显著降低19%。NS处理较S处理铵态氮含量显著增加18.1%,游离氨基酸含量增加10.2%;与LS处理比较,NLS处理硝态氮含量显著增加35.6%。方差分析(表2)显示,氮、凋落物添加及其交互作用在阔叶林土壤仅对硝态氮的影响显著(<0.05)。
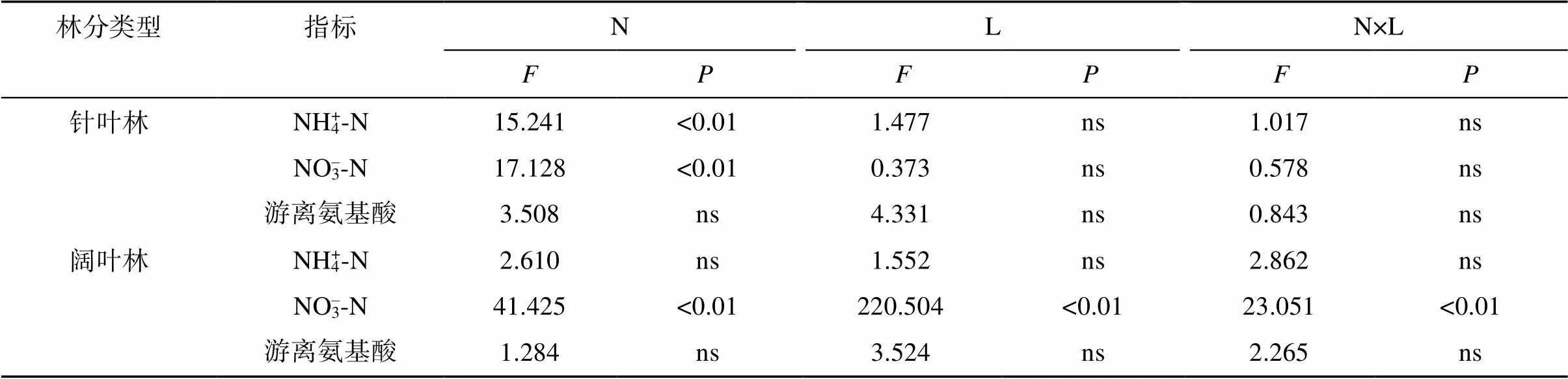
表2 氮和凋落物添加对针叶林、阔叶林中不同可溶性氮的双因素方差分析
注:N表示氮添加;L表示凋落物添加。<0.01表示因素对不同可溶性氮的影响显著,ns表示因素对不同可溶性氮的影响不显著。
2.2 凋落物和氮添加对两种林型土壤不同粒径质量分配的影响
对土壤进行物理分级,回收率为95%,分级发现>2 000 μm、2 000 ~ 250 μm和53 ~ 20 μm组分分配比例最高,均超过20%,且两个林分土壤的各粒径分布比例差异显著(表3)。在凋落物添加的情况下,氮添加降低针叶林土壤 >2 000 μm,增加53 ~ 20 μm和 <2 μm组分比例;氮添加增加阔叶林土壤2 000 ~ 250 μm,降低20 ~ 2 μm组分比例;与S处理比较,NS降低阔叶林土壤 <2 μm比例。
2.3 凋落物和氮添加对两种林型土壤不同粒径水解氨基酸的影响
由图3可知,与S处理相比,针叶林中添加凋落物的LS处理分别显著增加土壤粒径组分2 000 ~ 250 μm、20 ~ 2 μm、<2 μm水解氨基酸含量24.2%、31.4% 和60%,分别显著降低250 ~ 53 μm、53 ~ 20 μm组分水解氨基酸含量48.5%、23.8%;与NS相比,NLS处理分别显著降低全土、250 ~ 53 μm、53 ~ 20 μm、20 ~ 2 μm水解氨基酸含量53.8%、50.3%、41.9% 和38.1%,分别显著增加土壤组分>2 000 μm、<2 μm 水解氨基酸含量126.2% 和45.8%。全土中,NS处理水解氨基酸含量最高,较S处理显著增加了57.3%;在土壤粒径组分2 000 ~ 250 μm和20 ~ 2 μm则分别显著增加50.9% 和81.7%;然而,>2 000 μm、250 ~ 53 μm和<2 μm中分别显著降低29.6%、39.3% 和38.9%。与LS处理相比,全土NLS处理水解氨基酸含量显著降低30.8%;在土壤组分250 ~ 53 μm、53 ~ 20 μm、<2 μm分别显著降低41.3%、28.1%、44.3%;而对于>2 000 μm则显著增加59.4%。
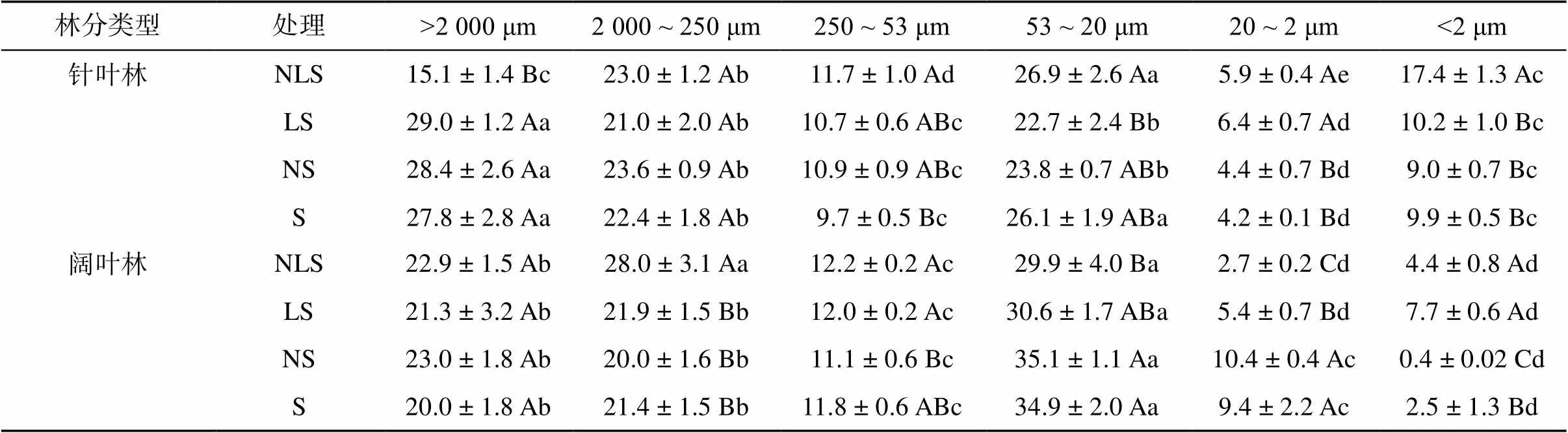
表3 针叶林和阔叶林不同处理土壤各粒径颗粒比例(%)
注:表中大写字母不同表示同一土壤粒径组分不同处理间差异显著(<0.05),小写字母不同表示同一处理土壤不同粒径组分间差异显著(<0.05)。

(图中大写字母不同表示同一土壤粒径组分不同处理间差异显著(P<0.05),小写字母不同表示同一处理不同土壤粒径组分间差异显著(P<0.05),下图同)
由图4可以看出,阔叶林中添加凋落物LS处理与S处理相比,2 000 ~ 250 μm、<2 μm粒径组分显著下降76.8%、86.2%,其余组分则显著增加25.4% ~ 210.1%;与NS相比较,NLS处理显著增加全土水解氨基酸106.1%,除>2 000 μm和250 ~ 53 μm外各个粒径组分均显著降低。与S处理相比,全土、2 000 ~ 250 μm和<2 μm的水解氨基酸在NS处理分别显著下降34.3%、12.2% 和33.2%;而>2 000 μm、53 ~ 20 μm、20 ~ 2 μm组分分别显著上升49.2%、230.5%和68.5%。与LS相比,NLS处理水解氨基酸在全土、>2 000 μm、2 000 ~ 250 μm显著增加23.1%、33.4%和38.6%;而在250 ~ 53 μm、53 ~ 20 μm、20 ~ 2 μm分别显著下降65.3%、25% 和52.5%。方差分析(表4)显示,只有氮添加的影响不显著,只因氮对各粒径组分影响趋势不同造成的。
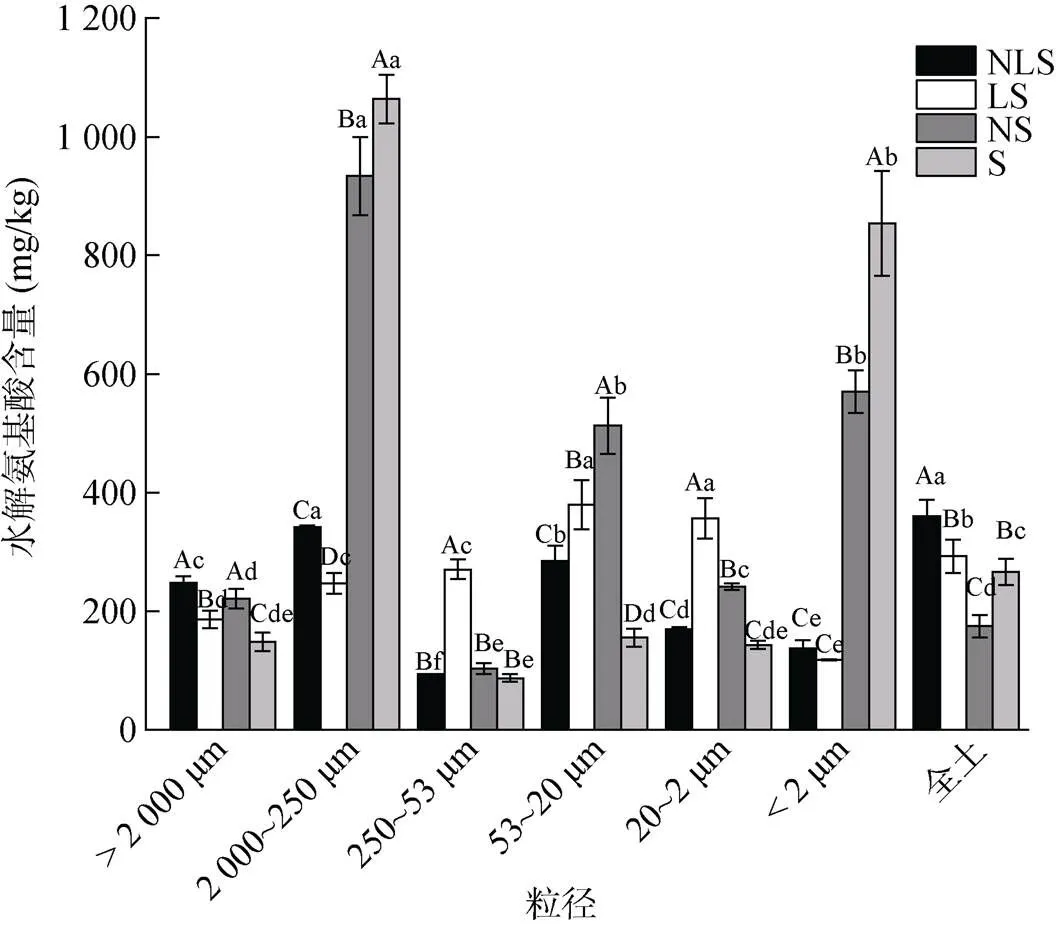
图4 不同处理条件下阔叶林土壤物理组分水解氨基酸含量

表4 氮和凋落物添加对针叶林和阔叶林土壤水解氨基酸的三因素方差分析
注:N表示氮添加,L表示凋落物添加,F表示土壤物理组分;<0.01表示因素对土壤水解氨基酸的影响显著,ns 表示因素影响不显著。
3 讨论
3.1 凋落物添加对土壤氮及水解氨基酸的影响
本研究发现凋落物添加仅对阔叶林土壤有显著影响。研究显示,凋落物中的可溶性物质可以作为土壤矿物质氮素的源和库[25],是养分归还土壤最主要的途径,故凋落物对于氮素的动态[26]以及土壤有机质分解和微生物活性[27]等过程有着重要的影响。本研究中,阔叶林土壤中凋落物添加降低土壤硝态氮,一方面可能是阔叶林土壤较高的可溶性有机碳,固定更多的硝态氮[10, 28];另一方面可能主要与可矿化的水解氨基酸降低有关,且主要与水解氨基酸含量最高的2 000 ~ 250 μm,和<2 μm粒径组分有关。有研究认为MAOM不是土壤中微生物的主要氮来源[11],但本研究中凋落物对水解氨基酸影响的差异性说明阔叶林土壤MAOM氮是可以矿化的。虽然碳添加也降低针叶林土壤无机氮[28],但针叶林凋落物分解较慢,释放较少的碳不足以影响针叶林土壤无机氮。相似的研究表明,凋落物分解促进阔叶林总硝态氮固定,但对针叶林没有影响[10]。针叶林凋落物对水解氨基酸的影响主要从2 000 ~ 250 μm粒径组分开始,有的粒径组分增加,有的降低,且针阔叶林土壤粒径组分变化规律相反。虽然氨基酸可快速参与氮循环,是潜在的快速氮供应库[29],但其对微生物的可达性和解聚性控制着土壤系统中氮的循环过程[30]以及氮供应或长期氮储存。而针叶林土壤不同粒径组分水解氨基酸对凋落物添加不一致的响应,可能导致其凋落物对土壤无机氮整体影响不显著。
3.2 氮添加对土壤氮及水解氨基酸的影响
本研究发现,氮添加促进硝化作用而降低针叶林土壤铵态氮,这与氮沉降显著提高了净硝化速率[31]的结果一致。但是Zhao等[32]研究显示铵态氮添加并没有增加酸性森林土壤硝化作用。这与在本研究过程中因淋溶损失了大量硝态氮,而氨氮添加后又有利于硝化作用有关。有研究指出,氮沉降处理产生的激发效应促进了土壤有机物的矿化,加速土壤养分的释放[33]。水解氨基酸可表示氮矿化潜势[34],NS处理提高针叶林全土壤水解氨基酸含量,表明可矿化氮增加,从而推动土壤硝化。从土壤粒径组分看,主要是2 000 ~ 250 μm和20 ~ 2 μm粒径的贡献,其他粒径组分的水解氨基酸降低。由于在酸性针叶林土壤异养硝化是NO3–-N产生主要机理,而阔叶林不是[35];虽然针叶林土壤游离氨基酸氮量较低,但可以通过异养硝化提高硝态氮含量[36]。本研究中氮添加仅增加阔叶林土壤铵态氮含量,可能与碳含量较高对土壤氮的保持增加有关,而不是硝化作用较弱。因为土壤碳调控氮的矿化和固持,有效性碳的增加将有利于微生物对不同形态氮的吸收同化[37],导致氮储量的增加[38]。同时,阔叶林土壤较高的多酚含量可能会抑制微生物的活性,降低土壤矿化速率[39],氮添加降低可矿化的水解氨基酸,且主要表现在含量最高的2 000 ~ 250 μm和<2 μm粒径,对全土的变化起着决定性作用。
3.3 凋落物及氮添加对土壤水解氨基酸的影响
本研究发现,相比较于LS处理,NLS处理促进针叶林土壤硝化。在森林生态系统中氮沉降首先与凋落物发生作用[40],然后影响土壤,Wang等[41]发现无机氮或有机氮都促进阔叶林凋落物分解,但是有机氮和混合氮促进了针叶林凋落物分解。因此,凋落物的存在将调节氮添加对土壤的影响;氮添加加速了凋落物的分解[42-43],产生更多的可溶性碳推动针叶林土壤异养硝化作用。有研究指出植被类型会影响激发效应的强度[44],而氮添加可起到增强激发效应的作用。例如,Chen等[33]就指出,同时添加蔗糖和无机氮造成的激发效应,显著高于单独添加蔗糖造成的激发效应。Zhang等[29]报道无机氮加速了新合成的氨基酸的快速分解,抑制了原有氨基酸的矿化。本研究发现在有凋落物情况下,氮添加降低针阔叶林土壤<250 μm粒径水解氨基酸,可能抑制了<250 μm粒径惰性氮的活化。因此,土壤氮对氮添加和凋落物处理响应的差异可能就是可矿化氮在不同土壤粒径响应差异造成的。
4 结论
研究发现,可以通过加强对土壤各粒径组分水解氨基酸变化机理研究,来深入分析凋落物和氮添加对针叶林和阔叶林土壤氮的不同影响。淋溶试验表明,野外自然条件下,开展针、阔叶林土壤氮的变化、相互影响、补偿机理研究,降雨作为影响因素,值得关注。同时本研究结果可为地力维持和亚热带林分科学经营提供参考。
[1] Niu S L, Classen A T, Dukes J S, et al. Global patterns and substrate-based mechanisms of the terrestrial nitrogen cycle[J]. Ecology Letters, 2016, 19(6): 697–709.
[2] Chen J G, Xiao W, Zheng C Y, et al. Nitrogen addition has contrasting effects on particulate and mineral-associated soil organic carbon in a subtropical forest[J]. Soil Biology and Biochemistry, 2020, 142: 107708.
[3] Fan K K, Delgado-Baquerizo M, Guo X S, et al. Suppressed N fixation and diazotrophs after four decades of fertilization[J]. Microbiome, 2019, 7(1): 143.
[4] 武星魁, 施卫明, 徐永辉, 等. 长期不同化肥氮用量对设施菜地土壤氮素矿化和硝化作用的影响[J]. 土壤, 2021, 53(6): 1160–1166.
[5] Warren C R. Organic N molecules in the soil solution: What is known, what is unknown and the path forwards[J]. Plant and Soil, 2014, 375(1/2): 1–19.
[6] Lü H J, He H B, Zhao J S, et al. Dynamics of fertilizer-derived organic nitrogen fractions in an arable soil during a growing season[J]. Plant and Soil, 2013, 373(1/2): 595–607.
[7] Miao R H, Ma J, Liu Y Z, et al. Variability of aboveground litter inputs alters soil carbon and nitrogen in a coniferous–broadleaf mixed forest of central China[J]. Forests, 2019, 10(2): 188.
[8] Xu S, Liu L L, Sayer E J. Variability of above-ground litter inputs alters soil physicochemical and biological processes: A meta-analysis of litterfall-manipulation experiments[J]. Biogeosciences, 2013, 10(11): 7423–7433.
[9] 吴君君. 人工针叶林生态系统凋落物输入调控对土壤有机碳动态和稳定性的影响[D]. 武汉: 中国科学院武汉植物园, 2017.
[10] Cheng Y, Wang J, Zhang J B, et al. The mechanisms behind reduced NH4+and NO3−accumulation due to litter decomposition in the acidic soil of subtropical forest[J]. Plant and Soil, 2014, 378(1/2): 295–308.
[11] Sayer E J, Baxendale C, Birkett A J, et al. Altered litter inputs modify carbon and nitrogen storage in soil organic matter in a lowland tropical forest[J]. Biogeochemistry, 2021, 156(1): 115–130.
[12] Cheng Y, Wang J, Wang J Y, et al. The quality and quantity of exogenous organic carbon input control microbial NO3–immobilization: A meta-analysis[J]. Soil Biology and Biochemistry, 2017, 115: 357–363.
[13] Yu Z P, Huang Z Q, Wang M H, et al. Nitrogen addition enhances home-field advantage during litter decomposition in subtropical forest plantations[J]. Soil Biology and Biochemistry, 2015, 90: 188–196.
[14] Huang X L, Chen J Z, Wang D, et al. Simulated atmospheric nitrogen deposition inhibited the leaf litter decomposition ofH. W. Li in Southwest China[J]. Scientific Reports, 2021, 11: 1748.
[15] Gill A L, Schilling J, Hobbie S E. Experimental nitrogen fertilisation globally accelerates, then slows decomposition of leaf litter[J]. Ecology Letters, 2021, 24(4): 802–811.
[16] Kiikkilä O, Kitunen V, Smolander A. Properties of dissolved organic matter derived from silver birch and Norway spruce stands: Degradability combined with chemical characteristics[J]. Soil Biology and Biochemistry, 2011, 43(2): 421–430.
[17] Lavallee J M, Soong J L, Cotrufo M F. Conceptualizing soil organic matter into particulate and mineral-associated forms to address global change in the 21st century[J]. Global Change Biology, 2020, 26(1): 261–273.
[18] Cotrufo M F, Ranalli M G, Haddix M L, et al. Soil carbon storage informed by particulate and mineral-associated organic matter[J]. Nature Geoscience, 2019, 12(12): 989–994.
[19] 林伟, 马红亮, 裴广廷, 等. 氮添加对亚热森林土壤有机碳氮组分的影响[J]. 环境科学研究, 2016, 29(1): 67–76.
[20] 鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000.
[21] 马书国, 杨玉盛, 谢锦升, 等. 亚热带6种老龄天然林及杉木人工林的枯落物持水性能[J]. 亚热带资源与环境学报, 2010, 5(2): 31–38.
[22] Hemkemeyer M, Christensen B T, Martens R, et al. Soil particle size fractions harbour distinct microbial communities and differ in potential for microbial mineralisation of organic pollutants[J]. Soil Biology and Biochemistry, 2015, 90: 255–265.
[23] Zhang Q, Liang G Q, Myrold D D, et al. Variable responses of ammonia oxidizers across soil particle-size fractions affect nitrification in a long-term fertilizer experiment[J]. Soil Biology and Biochemistry, 2017, 105: 25–36.
[24] Moore S, Stein W H. A modified ninhydrin reagent for the photometric determination of amino acids and related compounds[J]. Journal of Biological Chemistry, 1954, 211(2): 907–913.
[25] 马红亮, 闫聪微, 高人, 等. 林下凋落物去除与施氮对针叶林和阔叶林土壤氮的影响[J]. 环境科学研究, 2013, 26(12): 1316–1324.
[26] Zhou W J, Sha L Q, Schaefer D A, et al. Direct effects of litter decomposition on soil dissolved organic carbon and nitrogen in a tropical rainforest[J]. Soil Biology and Biochemistry, 2015, 81: 255–258.
[27] Jiang J, Li Y K, Wang M Z, et al. Litter species traits, but not richness, contribute to carbon and nitrogen dynamics in an alpine meadow on the Tibetan Plateau[J]. Plant and Soil, 2013, 373(1/2): 931–941.
[28] Ma H L, Yin Y F, Gao R, et al. Response of nitrogen transformation to glucose additions in soils at two subtropical forest types subjected to simulated nitrogen deposition[J]. Journal of Soils and Sediments, 2019, 19(5): 2166–2175.
[29] Zhang W, Liang C, Kao-Kniffin J, et al. Differentiating the mineralization dynamics of the originally present and newly synthesized amino acids in soil amended with available carbon and nitrogen substrates[J]. Soil Biology and Biochemistry, 2015, 85: 162–169.
[30] Nannipieri P, Eldor P. The chemical and functional characterization of soil N and its biotic components[J]. Soil Biology and Biochemistry, 2009, 41(12): 2357–2369.
[31] Cheng Y, Wang J, Chang S X, et al. Nitrogen deposition affects both net and gross soil nitrogen transformations in forest ecosystems: A review[J]. Environmental Pollution, 2019, 244: 608–616.
[32] Zhao W, Cai Z C, Xu Z H. Does ammonium-based N addition influence nitrification and acidification in humid subtropical soils of China? [J]. Plant and Soil, 2007, 297(1/2): 213–221.
[33] Chen R R, Senbayram M, Blagodatsky S, et al. Soil C and N availability determine the priming effect: Microbial N mining and stoichiometric decomposition theories[J]. Global Change Biology, 2014, 20(7): 2356–2367.
[34] Li L L, Li S T. Nitrogen mineralization from animal manures and its relation to organic N fractions[J]. Journal of Integrative Agriculture, 2014, 13(9): 2040–2048.
[36] Zhang J B, Sun W J, Zhong W H, et al. The substrate is an important factor in controlling the significance of heterotrophic nitrification in acidic forest soils[J]. Soil Biology and Biochemistry, 2014, 76: 143–148.
[37] Burke I C, Bontti E E, Barrett J E, et al. Impact of labile and recalcitrant carbon treatments on available nitrogen and plant communities in a semiarid ecosystem[J]. Ecological Applications, 2013, 23(3): 537–545.
[38] Sheng W P, Yu G R, Fang H J, et al. Sinks for inorganic nitrogen deposition in forest ecosystems with low and high nitrogen deposition in China[J]. PLoS One, 2014, 9(2): e89322.
[39] Smolander A, Kanerva S, Adamczyk B, et al. Nitrogen transformations in boreal forest soils—does composition of plant secondary compounds give any explanations? [J]. Plant and Soil, 2012, 350(1/2): 1–26.
[40] Hatton P J, Castanha C, Torn M S, et al. Litter type control on soil C and N stabilization dynamics in a temperate forest[J]. Global Change Biology, 2015, 21(3): 1358–1367.
[41] Wang C Y, Han G M, Jia Y, et al. Response of litter decomposition and related soil enzyme activities to different forms of nitrogen fertilization in a subtropical forest[J]. Ecological Research, 2011, 26(3): 505–513.
[42] 郭绮雯, 段文标, 陈立新, 等. 模拟凋落物添加与氮磷沉降对红松凋落物生态化学计量特征的影响[J]. 植物营养与肥料学报, 2021, 27(7): 1222–1233.
[43] 郭绮雯, 段文标, 刘玉萍, 等. 凋落物添加和模拟氮磷沉降对红松凋落物木质素降解和碳释放的影响[J]. 生态学报, 2021, 41(16): 6621–6632.
[44] Zhu B, Gutknecht J L M, Herman D J, et al. Rhizosphere priming effects on soil carbon and nitrogen mineralization[J]. Soil Biology and Biochemistry, 2014, 76: 183–192.
Effects of Litter and Nitrogen Addition on Soil Nitrogen and Hydrolyzed Amino Acids Under Coniferous and Broad-leaved Forest
LIAO Congmei1,2, WANG Mengsi1,2, MA Hongliang1,2*, GAO Ren1,2, YIN Yunfeng1,2
(1 State Key Laboratory for Subtropical Mountain Ecology of the Ministry of Science and Technology and Fujian Province, Fujian Normal University, Fuzhou 350007, China; 2 School of Geographical Sciences, Fujian Normal University, Fuzhou 350007, China)
In order to explore the effect of litter on forest soil nitrogen and the regulation of nitrogen deposition in the subtropical natural broad-leaved forest and artificial coniferous forest, a simulated leaching experiment was conducted for one year, in which four treatments were designed: soil (control), soil with litter addition (3 times litter addition), soil with nitrogen addition (120 mg/kg), and soil with both litter and nitrogen addition (3 times litter addition and N 120 mg/kg), and then soil soluble nitrogen in bulk soil and soil hydrolysis amino acid in different size soil fractions were analyzed. The results showed that compared with control, the addition of broad-leaved forest litter increased soil ammonium nitrogen and free amino acids, but reduced nitrate nitrogen. Nitrogen addition reduced ammonia nitrogen and increased nitrate nitrogen in coniferous forest soil, but increased ammonium nitrogen and free amino acids in broad-leaved forest soil. In the presence of litter, nitrogen addition significantly increased nitrate nitrogen in broad-leaved soil. The proportions of different size soil fractions were found quite different. Nitrogen addition tended to reduce the proportion of the large fractions and increase that of small fractions for coniferous forest soil, which was inverse for broad-leaved forest soils. The addition of coniferous forest litter significantly increased soil hydrolytic amino acid contents in 2 000–250 μm, 20–2 μm and <2 μm soil fractions. Nitrogen addition increased hydrolytic amino acids in bulk soil, 2 000–250 μm and 20–2 μm soil fractions for conifer forest. However, the presence of litter or nitrogen addition, nitrogen addition or litter significantly reduced hydrolyzed amino acids in bulk soil, 250–53 μm, 53–20 μm soil fractions, meanwhile the effects of litter and nitrogen addition on hydrolytic amino acids were primarily inverse for broad-leaved forest soils. In conclusion, the responses of hydrolytic amino acids (as mineralized nitrogen) in different size soil fractions are different to the litter and nitrogen addition, thus, it is a potential indicator to reveal the changes of soluble nitrogen in coniferous and broad-leaved forests.
Forest soil; Soluble nitrogen; Hydrolyzed amino acid; Physical classification
S714
A
10.13758/j.cnki.tr.2022.04.008
廖从梅, 王梦思, 马红亮, 等. 凋落物及氮添加对针阔叶林土壤氮和水解氨基酸的影响. 土壤, 2022, 54(4): 715–722.
国家自然科学基金项目(31770659)和福建省公益类科研院所专项(2020R1002005)资助。
(mhl936@163.com)
廖从梅(1994—),女,广西梧州人,硕士研究生,主要从事森林生态系统土壤碳氮循环研究。E-mail: 1318442197@qq.com

