血管支架内表面正六边形微织构对血液流动特性的影响
郑凯瑞,杨发展,赵国栋,卞东超,黄珂,林云龙
表面功能化
血管支架内表面正六边形微织构对血液流动特性的影响
郑凯瑞,杨发展,赵国栋,卞东超,黄珂,林云龙
(青岛理工大学 机械与汽车工程学院,山东 青岛 266520)
探究具有不同面积占有率的正六边形凹坑微织构血管支架对血液流动特性的影响,探究微织构在抑制支架再狭窄中的作用。在管状血管支架内表面设计具有不同面积占有率的正六边形凹坑微织构,采用Ansys有限元分析方法探究不同面积占有率微织构的存在对其腔内血液流速的影响。带有微织构的支架腔体内血液流速大于无织构的支架腔体内血液流速。在整个心动周期内,心脏收缩时微织构面积占有率为31.9%的血管支架腔体内的主流区血液流速整体上最快;心脏舒张时微织构面积占有率为11.2%的血管支架腔体内的主流区血液流速最快。在峰值时微织构支架下的血液流动方向会产生径向跳动和扰动,血液流速产生了径向分量,在近壁面处血液出现了扰动和不稳定流动现象,微织构面积占有率越大,壁面产生扰动的血液越多。在平稳时刻,近壁面血液会产生回流,在无微织构支架下腔体内正常流动的血液与回流区血液形成了漩涡,面积占有率越大,形成的漩涡越明显。血管支架内壁微织构的存在可以减小血液的黏附和流动时所受到的阻力,提高血液的流速,同时可以使近壁面处血液更好地混合,有利于改善血液的流动状态,降低再狭窄现象的发生概率,提高血管支架正常服务的寿命。
微织构;血管支架;近壁面;血流速度
近年来,随着我国老龄化速度的加快,心脑血管疾病的发病人数逐年增加,给很多老年人带来了很大的困扰。经临床对比发现,目前支架介入治疗是一种比较有效的手段[1],但是支架置入血管后出现的再狭窄现象一直是影响远期血液畅通率的主要因素,降低再狭窄率是支架介入手术后亟待解决的问题[2]。目前,医院常用的支架有金属裸支架、药物涂层支架和可降解支架等[3]。据统计,金属裸支架在置入体内12个月后发生再狭窄的概率为11%~30%[4],采用药物涂层支架可使再狭窄概率降低5%~10%[5]。随着时间的延长,支架所携带的药物消耗完毕后,仍存在狭窄概率高的问题。将可降解支架置入人体后,随着时间的推移支架逐渐降解,可以避免支架永久介入引起的不良反应[6],然而支架降解后血管频发再狭窄问题仍然难以得到有效解决。解决介入手术后再狭窄概率居高不下的问题是当前医学工程急需解决的难题。目前,针对血管支架的研究主要集中在材料、结构和表面改性等方面[7-9]。其中,支架表面改性主要通过在支架的表面制备涂层,以提高支架的生物相容性,进而达到降低再狭窄概率的目的[10-12]。然而,现阶段的涂层支架存在涂层种类相对单一、涂层容易脱落等问题,涂层不能长时间发挥作用[13]。目前,关于在支架表面加工制备微织构的表面改性方式的相关研究还较少,针对血管支架的研究还有广阔的发展空间。
微织构具有良好的表面疏水性、减摩降磨性能等。具有微织构的材料对血液的吸附性较弱,可以抑制血细胞的黏附,血液相容性良好[14],由此可见,微织构的这些特性使其在医学方面具有广泛的应用前景。Donger等[15]在316L不锈钢表面实现了超疏水织构化,并获得了相对最佳的激光加工微织构参数,该研究结果在生物医学领域具有重要的应用价值。鲍雨梅等[16]在医用生物陶瓷涂层表面加工出了具有不同排列方式的椭圆形织构和不同面积占有率的圆形织构,采用数值模拟与实验相结合的方法探究了微织构参数对生物陶瓷表面摩擦因数的影响,结果表明,面积占有率为25%的圆形凹坑具有相对最佳的减摩、降磨效果。Qiao等[17]研究发现,利用水射流引导的激光加工可用于304不锈钢表面,以形成微织构,这些微织构可以使304不锈钢表面获得良好的疏水特性。Nikam等[18]在高速钢圆盘上制备了圆形、三角形和方形微凹坑表面,将无织构圆盘和微织构圆盘分别置于蒸馏水中,通过测量液滴的接触角发现,微织构表面表现出更好的疏水性,证明微织构可以改善材料表面的疏水性能。表面疏水性越好,材料的抗黏附能力、自清洁能力和血液相容性越好。Cockerill等[19]研究发现,微织构可以使锌板表现出更少的血小板黏附性和更好的血液相容性。
基于上述研究结论,笔者创造性地将血管支架与微织构相结合,在血管支架内表面设计微织构。通过总结分析诸多学者对微织构面积占有率的研究,发现面积占有率在10%~30%之间时具有相对最佳的效果,因而文中设计了面积占有率分别接近10%、20%、30%的正六边形凹坑微织构,具体的面积占有率分别为11.2%、20.4%、31.9%。文中重点采用数值模拟方法,探究不同面积占有率的正六边形凹坑微织构对血流特性的影响,并揭示其机理,以期获得最佳的织构参数,为新型血管支架的设计开发,改善血管支架的功能提供新的研究和开发思路。
1 方法
1.1 模型建立
采用SolidWorks绘图软件建立无织构血管支架和微织构血管支架模型。支架的几何形状为管状,长度为10 mm,内径为1.8 mm。微织构的形状为正六边形凹坑状,深度为40 μm,设计的面积占有率分别为11.2%、20.4%、31.9%。正六边形微织构在支架内壁均匀分布,其三维模型如图1所示。
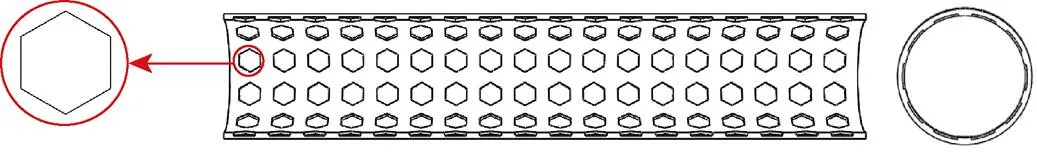
图1 微织构血管支架
1.2 仿真参数设置
采用Ansys有限元分析软件,选择Workbench中的Fluent模块进行纯流体仿真计算。首先将模型导入Fluent的Geometry模块中,抽取流体域,并将流体入口、出口和壁面分别命名为inlet、outlet、wall。在Mesh模块中采用四面体网格划分方式对血液流域进行网格划分,对微织构处进行网格加密细化处理。将Setup模块中的仿真参数设置如下[20-22]。
1)将血液视为不可压缩的牛顿流体,密度= 1 060 kg/m3,动力黏度=0.004 Pa·s。
2)忽略血管厚度的影响。
3)心脏的搏动包括舒张期和收缩期,心脏每收缩和舒张1次构成1个心动周期,因而血液流速也会产生周期性的变化。血液流速随时间的变化情况如图2所示。
4)出口压力为默认值。
2 结果与讨论
2.1 对主流区血液流速的影响
由支架和血管支撑起来的腔体内的血液流速是影响血管再狭窄的关键因素。若血液流速过慢,一方面血液在流动过程中携带的氧不能及时补充给血管内的机体,导致其缺氧;另一方面容易导致血液中脂类等表面黏附力较强的物质黏附在血管壁上,致使血管逐渐变得狭窄,直至堵塞[23]。由此可见,探究微织构血管支架对血液流速及流动过程中的扰动作用对于降低植入后血管支架出现再狭窄的概率具有重要意义。对支架内中间平面的血液流速进行分析,将1个心动周期内不同支架下的主流区血液流速绘制成曲线,如图3所示。从图3可以看出,在1个心动周期内,同一时刻、不同支架下的血液流速略有差异,但主流区血液的流速随着时间的变化趋势与血流的脉动特性一致。无织构支架腔体内的血液流速整体小于带有微织构支架腔体内的血液流速,同时发现不同面积占有率微织构支架腔体内的血液流速相差不明显。在心脏收缩时,血管内的压力增大,血液的动力较强,血液迅速由心室泵入主动脉[24],使得血液流速较快,在0~0.1 s时血液流速呈上升趋势,此时面积占有率为31.9%的微织构支架腔体内的血液流速较快。在峰值时刻(即0.1 s)时,面积占有率为20.4%微织构支架下的血液流速相对最大,为0.596 0 m/s;面积占有率为31.9%的微织构支架下的血液流速为0.595 8 m/s,与面积占有率为20.4%的支架下的血液流速非常接近。在心脏舒张期内,血管内的血压降低,血流的动力减小,血液流速降低,并逐渐趋于平稳。从图3可知,当流动至0.2 s后,面积占有率为11.2%的微织构支架下的血液流速较其他支架明显加快。
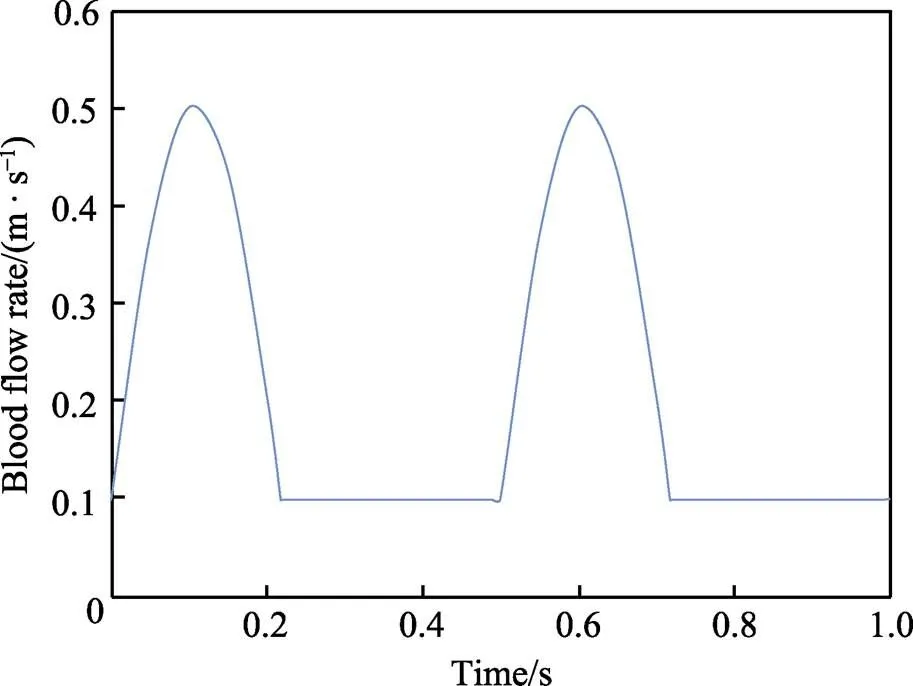
图2 不同时刻下的血液流速

图3 1个心动周期内不同支架下的血液流速情况
在心脏收缩期,血液的流动速度较大,血液流速惯性力的作用大于血液间黏滞力的作用,进入微织构内的血液较少,微织构的疏水性使得血液受到壁面的摩擦阻力减小;微织构的面积占有率越大,血液的流速越快。可见在心脏收缩时,面积占有率为31.9%和20.4%的微织构血管支架内的血液流速较快。在心脏舒张期,血管内的压力降低,血液的流速减小,在血液流经支架壁面时,进入凹坑织构内的血液增多,微织构面积占有率越大,储存的血液越多,对血液流动造成的影响越大。由此可见,在心脏舒张期,微织构面积占有率为11.2%的微织构血管支架腔体内的血液流速较快。
在1个心动周期内,不同支架内峰值时刻(0.1 s)的主流区血液流速云图见图4。从图4可以看出,采用无织构支架时,支架内中间平面血液流速云图呈现规则的矩形;采用微织构支架时,可以明显观察到血液流速云图在壁面处呈现凹凸不平的形态(如图4b—d中的放大区域所示),云图中的凸起部分为流经微织构处的血液。在峰值时刻,主流区的血液分布均匀,在入口处血液流速较低,而在支架内经过充分流动后,血液在出口处的流速明显大于入口处的流速。除血液流速略有不同外,不同支架内腔体的主流区血液分布没有明显差异。
平稳时刻(0.4 s)不同支架下的血液流速云图如图5所示。由图5可知,在0.4 s时,面积占有率为11.2%的微织构支架下的主流区血液流速相对最大,为0.180 5 m/s,相较于无织构支架下的主流区血液流速(0.177 4 m/s),提高了约1.75%。这是因为该时刻心脏处于舒张期,血液动力减小,流速变缓。在血液流经支架壁面时,进入凹坑织构内的血液相较于收缩期时有所增多。微织构面积占有率越小,凹坑织构内储存的血液越少,对血液流动造成的影响越小,因而在平稳时刻,面积占有率为11.2%微支架下的血液流速相对最快。无织构支架下入口处的血液流速分布不均匀,不同流速下血液之间出现了明显的波动(如图5a虚线框中所示)。在微织构支架下入口处的血液分布状态明显优于无织构支架下的血液分布状态,不同流速的血液在层与层之间分布更加均匀。不同面积占有率的微织构对入口处血液的分布状态的影响不同,在微织构面积占有率为11.2%时,入口处分层血液与主流区血液间的分层呈现略微波动状态(如图5b虚线框所示);当面积占有率为20.4%时,入口处最低流速层边缘也出现了波动(如图5c中虚线框所示),面积占有率为31.9%微支架入口端的血液层与层之间更加稳定。对比图4和图5可以看出,经过更加充分的流动后,平稳时刻下入口处的血液分层相较于峰值时刻更加明显,此时的血液为更加充分的层流流动。血液在入口处的边界层厚度很小,随着血液在支架内的流动,边界层厚度逐渐增加,在边界层厚度由薄变厚的过渡处,血液的停滞区面积变大,血液主流区面积在支架入口端相对最大。随着血液在支架内的流动,血液的主流区面积略有减小。

图4 峰值时刻不同支架下血液的流速

图5 平稳时刻不同支架下内腔体血液的流速
2.2 对近壁面血液流速的影响
当血液流速处于峰值时刻(0.1 s)时,近壁面血液流速矢量图如图6所示。从图6可以看出,在无织构支架下近壁面处的血液分层明显,壁面处的血液流速为0,血液流动方向与支架轴心方向一致。相较于无织构支架,微织构支架下的血液流动状态明显不同,在壁面处血液流线出现了波浪状的摆动,该处的
血流方向出现了径向跳动,血流速度产生了径向分量。产生该现象的原因与微织构有关,微织构的存在改变了支架的几何结构,支架内壁面不再是光滑的表面。当血液流经支架内壁面时,微织构破坏了血液平稳的层流关系,使得不同速度层之间的血液产生了混合。从图6b—d可以看出,微织构面积占有率越大,单个织构的尺寸越大,对血液流动状态的影响也越大,因而壁面处血液的摆动越明显,血液混合的区域越多。在微织构支架下,近壁面的血液流速大于无织构支架下近壁面的血液流速,微织构的存在使得不同流速血液相互混合,这样可以改善壁面处血液的停滞状态,减少血液黏附。

图6 峰值时刻不同支架下近壁面血液的流速矢量图
无织构支架和面积占有率为11.2%、20.4%和31.9%的微织构血管支架横截面血液流速云图如图7所示。由图7可以看出,从支架轴心向两侧内壁面处的血液流速逐渐减小,近壁面处血液边界层分层明显。从图7a可以看出,在无织构下血流区域的横截面为圆形。由图7b—d可知,与凹坑微织构接触部分的血液呈凸起状态,微织构面积占有率越大,血液流域中凸起部分的面积越大。在微织构支架下,与凹坑微织构接触的血液存在大量流速为0的区域,说明该处并没有血液流过,血液未完全进入凹坑微织构中,但微织构的存在增大了血液流域的面积。图7b—d中红色实线处为没有微织构存在时的血液流域边界,与无织构时的血液流域相比,微织构支架下的血液流域因部分血液进入凹坑微织构而增大,同样的区域,在无织构支架下血液流速为零,在微织构支架下血液流速大于零,近壁面处血液的流动速度有所提高。微织构的面积占有率越大,与微织构接触的血液越多,血液流域的面积越大,对提高近壁面处血液流速的作用越明显。
平稳时刻(0.4 s)不同支架下近壁面血液流速矢量图如图8所示。与图6相比,平稳时刻的血液流动状态比峰值时刻的血液流动状态更加复杂。在平稳时刻,心脏处于舒张状态,血液流动的动力降低,血管内的压力减小,导致近壁面的血液产生了回流[25],回流区的血液由慢速血流组成。在无织构支架下,回流区血液的流动方向与中心处的血液流速相反,与支架轴心方向平行。在微织构支架下近壁面处血液的流动方向出现了径向跳动,回流的血液与正常流动的血液形成了漩涡,微织构面积占有率越大,产生漩涡的区域越大,血液混合状态越明显。漩涡的产生改变了近壁面平稳的层流关系,血液变得混合无序,这种现象
发生在支架壁面处可以使不同流速的血液之间既流动又混合,改变了壁面处血液单一流速的现象,提高了壁面处血液的流速,缓解了血液的沉积现象,减小了血液的黏附。漩涡状的血液将流体与固体之间的摩擦状态由滑动摩擦变为滚动摩擦[26],减小了血液流动过程中的摩擦阻力,增强了减阻效果。从图8b—d可以看出,微织构面积占有率越大,漩涡的幅度越大,减阻抗黏附的效果越明显,更有利于缓解血液沉积、减少血液黏附。
平稳时刻不同支架下横截面血液流速云图如图9所示,与图7对比可知,平稳时刻时的边界层厚度明显大于峰值时刻的边界层厚度。这是由于边界层厚度与血液流速有关,血液流速越快,边界层厚度越小;血液流速越慢,边界层厚度越大[27]。在平稳时刻下的血液流速相较于峰值时刻下的血液流速大幅降低,因此边界层的厚度增加,此时血液主流区面积减小。平稳时刻微织构处的血液停滞区面积明显小于峰值时刻下的微织构处血液停滞面积,说明血液空白区面积减小,有更多的血液进入凹坑微织构。微织构的面积占有率越大,血液与微织构的接触面积越大,则进入微织构的血液越多,血液流速因更多的血液进入微织构而有所降低。从图9中还可以看出,除了在最外层壁面处血液的流速为0外,在边界层中也出现了血液流速为0的区域(图9a—d中红色虚线区域),在图5中显示为一条速度为0的线性区域(图5中红色矩形框所示区域)。结合图8可知,该区域处于回流血液与正常流动血液之间,该处血液因流动方向的不同而分布不均,从而出现了血液停滞区。
血管支架内表面的微织构可以有效改善血液的流动状态,减少脂类物质在血管中的沉积黏附,降低支架置入后再狭窄的概率,提高支架的使用寿命。微织构血管支架为新型血管支架的设计和研发提供了新的思路。

图7 峰值时刻不同支架下血液流速截面
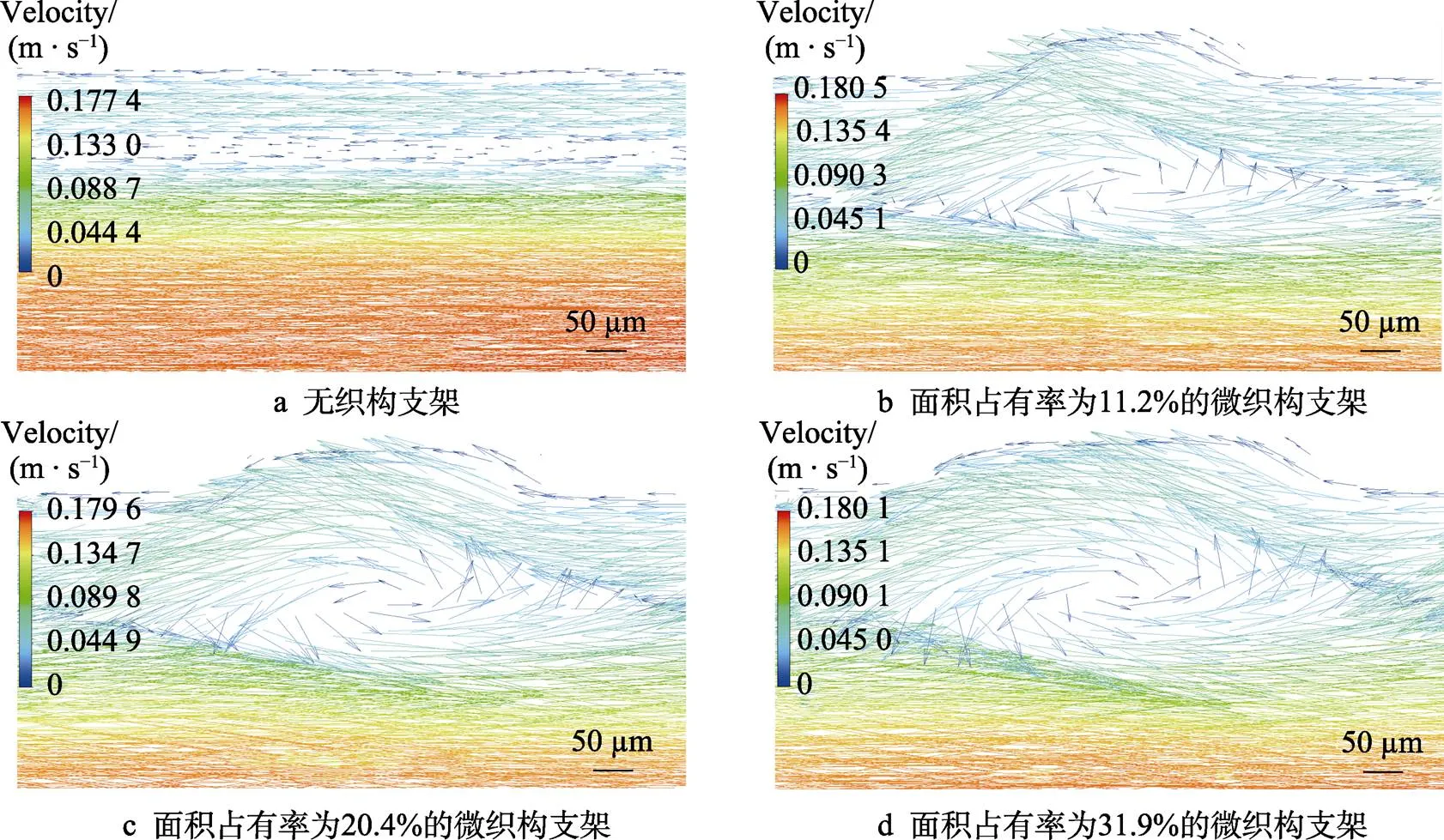
图8 平稳时刻不同支架下近壁面血液的流速矢量
stent with an area occupancy of 31.9%
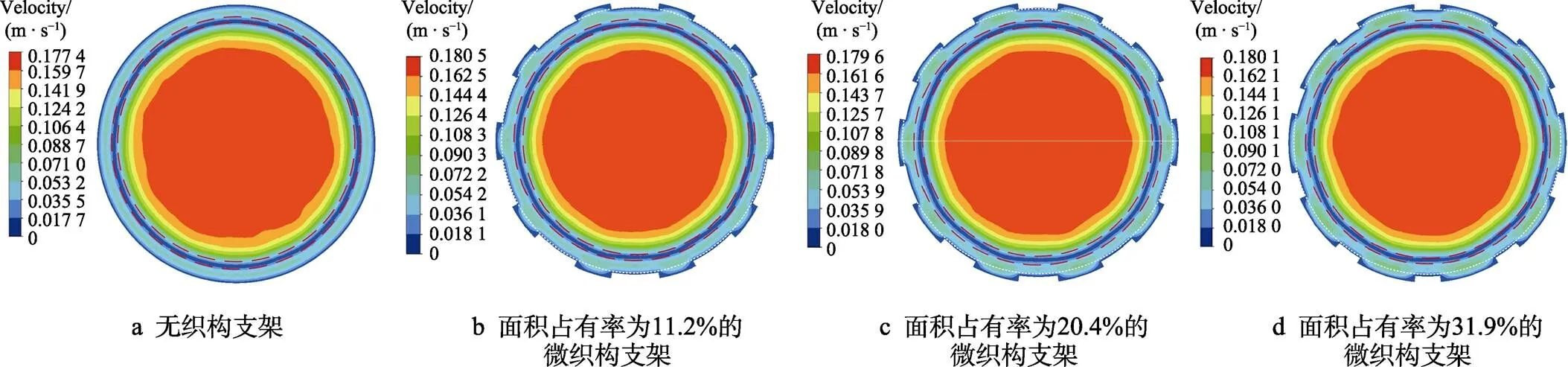
图9 平稳时刻不同支架下血液流速截面
3 结论
在管状血管支架内表面设计具有不同面积占有率的正六边形凹坑微织构,采用有限元分析方法探究了不同面积占有率微织构的存在对其腔内血液流速的影响,研究结论如下。
1)带有微织构的支架其腔体内血液流速大于无织构支架腔体内的血液流速。在整个心动周期内,当心脏收缩时微织构面积占有率为31.9%的血管支架的腔体内主流区血液流速相对最快;在心脏舒张时,面积占有率为11.2%的微织构支架下主流区血液的流速相对最快。
2)在峰值时,无织构支架下血液的流向与支架轴心方向平行,在微织构支架下的血液流动方向产生了径向跳动与扰动,血液流速产生了径向分量,近壁面处血液出现了扰动和不稳定流动现象。微织构面积占有率越大,壁面产生扰动的血液越多。
3)在平稳时刻,近壁面血液会产生回流,在无织构支架下正常流动和回流的血液流动方向均与支架轴心平行,在微织构支架下正常流动的血液与回流区血液形成了漩涡,面积占有率越大,形成的漩涡越明显。漩涡使得血液与壁面之间的滑动摩擦变为滚动摩擦,从而减小了血液在流动过程中的阻力。
4)血管支架内壁微织构的存在改变了近壁面处不同流速血液之间平稳的层流关系,使得各流层间的血液出现了混合现象,有利于改善血液的流动状态,进而提高壁面处的血液流速,可显著降低血液中脂类物质等的沉积和黏附的概率,大幅提高植入血管支架的服役寿命。
[1] 周生刚, 游远琪, 徐阳, 等. 生物可降解金属基支架的应用进展[J]. 昆明理工大学学报(自然科学版), 2021, 46(3): 18-26.
ZHOU Sheng-gang, YOU Yuan-qi, XU Yang, et al. Application Progress of Biodegradable Metal-Based Stents[J]. Journal of Kunming University of Science and Technology (Natural Sciences), 2021, 46(3): 18-26.
[2] CHEN Xing, ASSADSANGABI B, HSIANG Y, et al. Enabling Angioplasty-Ready Smart Stents to Detect In- Stent Restenosis and Occlusion[J]. Advanced Science (Weinheim, Baden-Wurttemberg, Germany), 2018, 5(5): 1700560.
[3] PAN Chen, HAN Ya-feng, LU Ji-ping. Structural Design of Vascular Stents: A Review[J]. Micromachines, 2021, 12(7): 770.
[4] WANG Ya-bing, MA Yan, GAO Peng, et al. Paclitaxel Coated Balloon Vs. Bare Metal Stent for Endovascular Treatment of Symptomatic Vertebral Artery Origin Stenosis Patients: Protocol for a Randomized Controlled Trial[J]. Frontiers in Neurology, 2021, 11: 579238.
[5] AOKI J, TANABE K. Mechanisms of Drug-Eluting Stent Restenosis[J]. Cardiovascular Intervention and Therapeutics, 2021, 36(1): 23-29.
[6] 丁皓, 张迎, 刘雨佳, 等. 冠脉可降解支架介入的血管力学特性数值模拟与实验研究[J]. 医用生物力学, 2021, 36(1): 6-13.
DING Hao, ZHANG Ying, LIU Yu-jia, et al. Numerical Simulation and Experimental Study on Vascular Mechanical Properties of Coronary Degradable Stent Intervention[J]. Journal of Medical Biomechanics, 2021, 36(1): 6-13.
[7] 李芳, 吴可通, 赵珺, 等. 血管支架及其在动脉瘤治疗中的发展趋势[J]. 中国组织工程研究, 2021, 25(34): 5561-5569.
LI Fang, WU Ke-tong, ZHAO Jun, et al. Advances of Endovascular Stent and Its Treatment for Aneurysms[J]. Chinese Journal of Tissue Engineering Research, 2021, 25(34): 5561-5569.
[8] 钱漪, 袁广银. 可降解锌合金血管支架的研究现状、面临的挑战与对策思考[J]. 金属学报, 2021, 57(3): 272-282.
QIAN Yi, YUAN Guang-yin. Research Status, Challenges, and Countermeasures of Biodegradable Zinc-Based Vascular Stents[J]. Acta Metallurgica Sinica, 2021, 57(3): 272-282.
[9] 魏云波, 赵丹阳, 王敏杰, 等. 高径向支撑性可生物降解聚合物血管支架结构设计与力学性能分析[J]. 中国机械工程, 2020, 31(9): 1098-1107.
WEI Yun-bo, ZHAO Dan-yang, WANG Min-jie, et al. Design and Mechanics Analysis of Biodegradable Polymer Vascular Stents with High Radial Supporting Property[J]. China Mechanical Engineering, 2020, 31(9): 1098-1107.
[10] 李向阳. 金属–酚(胺)化学构建一氧化氮催化涂层应用于血管支架的研究[D]. 成都: 西南交通大学, 2019: 1-132.
LI Xiang-yang. Construction of Nitric Oxide Catalytic Vascular Stents via Metal-Phenolic/Catecholamine Network[D]. Chengdu: Southwest Jiaotong University, 2019: 1-132.
[11] KANG M H, CHEON K H, JO K I, et al. An Asymmetric Surface Coating Strategy for Improved Corrosion Resistance and Vascular Compatibility of Magnesium Alloy Stents[J]. Materials & Design, 2020, 196: 109182.
[12] NAZARKINA Z K, CHELOBANOV B P, CHERNONOSOVA V S, et al. Sirolimus-Eluting Electrospun- Produced Matrices as Coatings for Vascular Stents: Dependence of Drug Release on Matrix Structure and Composition of the External Environment[J]. Materials, 2020, 13(12): 2692.
[13] 张明. 促进血管内皮化冠脉支架的研究及支架内再狭窄的危险因素分析[D]. 长春: 吉林大学, 2020: 1-94.
ZHANG Ming. Study on Promoting Endothelialization of Coronary Artery Stent and Analysis of Risk Factors of In- Stent Restenosis[D]. Changchun: Jilin University, 2020: 1-94.
[14] 吴勃, 周明, 李保家, 等. 医用316L不锈钢表面微结构的飞秒激光制备及血液相容性研究[J]. 功能材料, 2013, 44(22): 3291-3295.
WU Bo, ZHOU Ming, LI Bao-jia, et al. Microstructures Prepared with a Femtosecond Laser on Medical 316L Stainless Steel Surface and the Blood Compatibility Study[J]. Journal of Functional Materials, 2013, 44(22): 3291-3295.
[15] DONGRE G, RAJURKAR A, RAUT R, et al. Preparation of Super-Hydrophobic Textures by Using Nanosecond Pulsed Laser[J]. Materials Today: Proceedings, 2021, 42: 1145-1151.
[16] 鲍雨梅, 王成武, 金志伟, 等. 激光表面织构化生物陶瓷涂层及其摩擦磨损性能[J]. 中国激光, 2019, 46(2): 77-85.
BAO Yu-mei, WANG Cheng-wu, JIN Zhi-wei, et al. Textured Surface on a Bioceramic Coating via a Femtosecond Laser and Its Friction and Wear Properties[J]. Chinese Journal of Lasers, 2019, 46(2): 77-85.
[17] QIAO Hong-chao, CAO Zhi-he, ZHAO Ji-bin. Micromorphology of Metallic Surfaces for Hydrophobicity by Waterjet-Guided Laser Processing[J]. The International Journal of Advanced Manufacturing Technology, 2021, 114(7): 2159-2167.
[18] NIKAM M, ROY T, MASTUD S. Wettability Analysis of Hydrophobic Micro-Dimpled HSS Surfaces[J]. Journal of the Institution of Engineers (India): Series D, 2021: 1-12.
[19] COCKERILL I, SU Ying-chao, LEE J H, et al. Micro-/ Nanotopography on Bioresorbable Zinc Dictates Cytocompatibility, Bone Cell Differentiation, and Macrophage Polarization[J]. Nano Letters, 2020, 20(6): 4594-4602.
[20] 袁俊杰, 郭无极, 王锦涛. 基于流固耦合的复杂血管内血液动力学数值模拟及血管支架有限元分析[J]. 装备制造技术, 2018(9): 12-20.
YUAN Jun-jie, GUO Wu-ji, WANG Jin-tao. Kinetic Numerical Simulation of Complex Blood Vessel and Finite Element Analysis of Blood Vessel Stent Based on Fluid- Solid Coupling[J]. Equipment Manufacturing Technology, 2018(9): 12-20.
[21] 朱诗文. 血管支架表面织构设计及其血流动力学仿真分析[D]. 武汉: 武汉科技大学, 2019: 1-65.
ZHU Shi-wen. Surface Texture Design and Hemodynamic Simulation Analysis of Vascular Stent[D]. Wuhan: Wuhan University of Science and Technology, 2019: 1-65.
[22] 胡坤, 胡婷婷, 马海峰. ANSYS Fluent实例详解[M]. 北京: 机械工业出版社, 2019: 314.
HU Kun, HU Ting-ting, MA Hai-feng. ANSYS Fluent Example Detailed Explanation[M]. Beijing: China Machine Press, 2019: 314.
[23] 余亚杰, 王妍, 许松林. 血管中血液和血栓两相流动的CFD模拟[J]. 高校化学工程学报, 2015, 29(4): 992-996.
YU Ya-jie, WANG Yan, XU Song-lin. CFD Simulation of the Two-Phase Flow of Blood and Thrombus Flow in Blood Vessels[J]. Journal of Chemical Engineering of Chinese Universities, 2015, 29(4): 992-996.
[24] 陈佳, 王得水, 谷凯云, 等. 人工心脏泵辅助对左心室血流动力学影响的数值研究[J]. 北京生物医学工程, 2015, 34(4): 331-339.
CHEN Jia, WANG De-shui, GU Kai-yun, et al. Numerical Research of the Artificial Heart Blood Pump's Effect on Left Ventricular Hemodynamics[J]. Beijing Biomedical Engineering, 2015, 34(4): 331-339.
[25] 刘芮. 血液流动状态下动脉粥样硬化血管的流固耦合分析[D]. 天津: 河北工业大学, 2016: 1-77.
LIU Rui. Fluid Solid Coupling Analysis of Atherosclerotic Vessels under the Blood Flow State[D]. Tianjin: Hebei University of Technology, 2016: 1-77.
[26] 汪志远, 马建敏. 鲨鱼皮微沟槽结构减阻计算分析[J]. 力学季刊, 2017, 38(1): 160-168.
WANG Zhi-yuan, MA Jian-min. Calculation and Analysis on Drag Reduction of Shark's Skin Tiny Groove Structure[J]. Chinese Quarterly of Mechanics, 2017, 38(1): 160-168.
[27] 常青林. 平行板间边界层流体速度计算及差异分析[J]. 中国海上油气, 2014, 26(1): 109-113.
CHANG Qing-lin. Fluid Velocity Calculation in Boundary Layer and Difference Analysis between Two Parallel Plates[J]. China Offshore Oil and Gas, 2014, 26(1): 109- 113.
Effect of Hexagonal Micro Texture on Blood Flow Characteristics of Vascular Stent
,,,,,
(School of Mechanical & Automotive Engineering, Qingdao University of Technology, Shandong Qingdao 266520, China)
In recent years, there is a high incidence of cardiovascular and cerebrovascular diseases in China. The treatment methods mainly include surgery, drug therapy and interventional therapy. Surgical treatment is more traumatic, high risk, many adverse reactions of drug treatment, long treatment cycle, and the effect is not obvious. In contrast, interventional therapy has the advantages of safe operation, less surgical trauma, high success rate and less complications. At present, it has become the first choice for the treatment of cardiovascular and cerebrovascular diseases. The research report shows that the blood flow rate is the key influencing factor of restenosis after stent intervention in human body. If the blood flow rate is too slow, it is easy to deposit blood cells, lipids and other substances in the blood on the blood vessel wall, resulting in vascular blockage and restenosis over time. The work aims to study the effect of hexagonal micro pit texture vascular stents with different area occupancy rates on blood flow characteristics, and explore the role of micro texture in inhibiting stent restenosis. On the inner surface of tubular vascular stent, regular hexagonal micro pit textures with different area occupancy rates were designed, and the effect of micro textures with different area occupancy rates on the blood flow velocity in lumen was explored by Ansys finite element analysis method. The blood flow velocity in the lumen of the stent with micro texture was greater than that in the lumen of stent without micro texture. In a cardiac cycle, when the heart was contracted, the blood flow rate in the main flow zone of the micro-textured stent lumen with the occupancy rate of 31.9% was the fastest. When the heart was diastolic, the blood flow velocity in the main flow zone of the micro-textured stent lumen with the area occupancy rate of 11.2% was the fastest. At the peak, the blood flow direction in the stent without micro texture was parallel to the axis direction of the stent and the blood flow direction in the micro-textured stent produced radial runout and disturbance, the blood flow velocity produced radial component, and the blood near the wall showed disturbance and unstable flow. As the micro-textured area occupancy rate increased, more blood disturbed on the wall. At a steady condition, the blood near the wall flew back, and the blood flowing normally in the lumen of the stent without micro texture formed a vortex with the blood in the reflux area. The larger the area occupancy rate was, the more obvious the vortex was. The vortex changed the sliding friction between the blood and the wall into rolling friction, which reduced the resistance in the process of blood flow. The micro texture of the inner wall of the stent can reduce the resistance of blood adhesion and flow, improve the blood flow velocity, and make the blood near the wall better mixed, which is beneficial to improving the blood flow state, reducing the probability of restenosis and prolonging the normal service life of the stent.
micro texture; vascular stent; near wall; blood flow velocity
2021-09-13;
2022-01-11
ZHENG Kai-rui (1997-), Female, Master, Research focus: micromachining technology of tool surface texture
杨发展(1981—),男,博士,教授,主要研究方向为高速高效加工、刀具技术、微织构激光加工及作用机理。
YANG Fa-zhan (1981-), Male, Doctor, Professor, Research focus: high-speed and efficient machining, cutting tool technology, micro texture laser machining and mechanism.
郑凯瑞, 杨发展, 赵国栋, 等.血管支架内表面正六边形微织构对血液流动特性的影响[J]. 表面技术, 2022, 51(9): 280-287.
R318.08
A
1001-3660(2022)09-0280-08
10.16490/j.cnki.issn.1001-3660.2022.09.000
2021–09–13;
2022–01–11
山东省自然科学基金(ZR2018PEE011,ZR2019MEE059)
Fund:Natural Science Foundation of Shandong Province (ZR2018PEE011, ZR2019MEE059)
郑凯瑞(1997—),女,硕士,主要研究方向为刀具表面织构的微细加工技术
ZHENG Kai-rui, YANG Fa-zhan, ZHAO Guo-dong, et al. Effect of Hexagonal Micro Texture on Blood Flow Characteristics of Vascular Stent [J]. Surface Technology, 2022, 51(9): 280-287.
责任编辑:彭颋

