胃癌行腹主动脉旁淋巴结清扫的研究进展*
于鹏程 徐志远 王以 胡灿 程向东
据最新数据表明,到2020年胃癌发病率在全球范围内居第5 位,死亡率居第4 位。死亡率呈现降低的趋势,但胃癌仍旧严重威胁着人类的生命健康[1]。
手术、化疗、放疗、靶向治疗和免疫治疗是目前治疗胃癌的五大方式。手术治疗作为胃癌根治的重要手段,选择合理的手术范围及手术根治的彻底性会直接影响到进展期胃癌患者的预后。胃No.16 组淋巴结,又称腹主动脉旁淋巴结(para-aortic lymph node,PALN)或腹膜后淋巴结,是胃的淋巴引流进入全身循环的最末站。腹主动脉旁淋巴节转移在过去被定义为局部淋巴结转移,后被认为是远处转移[2],也有研究认为不应将其视为远处转移,因为与其它转移性肿瘤相比拥有更好的生存结局[3]。关于胃癌伴PALN 的患者是否需要进行腹主动脉旁淋巴结清扫(para-aortic lymph node dissection,PAND)一直存在争议。本文就胃癌伴PAND 的研究进行综述,以期为临床No.16胃癌淋巴清扫提供一定的指导意见。
1 PALN 的解剖结构及引流途径
腹主动脉的前方为胰腺、十二指肠水平部及肠系膜根等,后方为第1~4 腰椎及椎间盘,左侧为左交感干腰部,右侧为下腔静脉;下腔静脉左侧为腹主动脉,其后方毗邻腹主动脉的壁支、右腰交感干、第1~4 腰椎。根据第3 版日本胃癌分类法的划分,将No.16 淋巴结分为a1、a2、b1、b2 四个区。以腹主动脉干、左肾静脉、肠系膜下动脉为分界划分。16a1 区为主动脉裂孔区;腹主动脉干上缘与左肾静脉下缘之间为16a2 区;左肾静脉下缘与肠系膜下动脉上缘之间为16b1 区;肠系膜下动脉上缘与髂总动脉分叉之间为16b2 区[2]。其中16a2 和16bl 区淋巴结是胃癌患者PALN 转移的主要区域(图1)。
胃癌No.16 组淋巴结的引流未完全明确,主要存在3 种引流途径,3 种途径均流至No.16 组淋巴结,随后汇入胸导管。第1 种为沿腹主动脉周围淋巴结途径,即从No.3→No.1→No.7→No.9→No.16 或No.4→No.6→No.8→No.9→No.16。第2 种为沿肠系膜上动脉周围淋巴结途径,即从No.4→No.6→No.15→No.16。第3 种为胰腺后途径,即从No.4→No.6→No.15→No.16[4]。
2 PALN 转移的诊断方法及其危险因素
胃癌患者是否发生淋巴结转移的诊断“金标准”是病理诊断。如B 超或CT 引导下的细针穿刺在理论上是可行的,但由于穿刺活检是一种侵入性诊断方法,因此大多数机构通常不采用。影像学是评估PALN转移的主要方法,目前临床上常用CT、磁共振、PETCT 等影像学技术对其进行评估。影像学检查中临床上阳性淋巴结的标准主要基于淋巴结的短轴测量,直径≥8mm 作为诊断临床淋巴结转移的主要标准,并且显示出高达85%和95%的敏感性和特异性[5-6]。但部分正常大小淋巴结存在微转移的可能性。有研究认为进展期胃癌PALN 的转移率达到18%~40%[7-8]。不同部位胃癌的的PALN 转移率因胚胎学原理的不同而存在差异。在胃的上部癌中,癌细胞常转移至No.7、No.9 组淋巴结,随后转移至No.16 组淋巴结。晚期胃上部癌的PALN 转移率为16%~38%。与胃上部癌相比,胃中部癌转移至No.16 组淋巴结的概率相对较低,为17%~23%,且仅在T3、T4 期胃癌中发生[9]。
为了能更好地预测进展期胃癌PALN 的转移情况,许多研究者试图找出影响PALN 转移的危险因素,从而总结出其转移规律。通过荟萃分析11 项临床病理特征,认为位于胃上部的肿瘤、肿瘤大小>5 cm,肿瘤浸润深度>T2、处于N2 和N3 期、组织学分类为低分化型、Borrman3/4 型为腹主动脉旁淋巴结转移的危险因素[10]。有研究分析174 例接受D2+PAND 患者的临床病理因素与主动脉旁淋巴结浸润之间的关系,认为N2/N3(45.2%)患者较N1/N2(6.2%)患者有更高的转移率[7]。Hu 等[11]认为腹主动脉旁淋巴结转移与No.8a、No.9 组淋巴结有关。也有研究表明,胃癌No.9 组淋巴结转移是导致PALN 转移的独立危险因素[7,12]。在No.9 组淋巴结阳性的患者中,发生PALN转移的患者约为61.3%,而在No.9 组淋巴结阴性的患者中,发生PALN 转移的患者仅占15.9%[13]。
3 PAND 的历史及其意义
淋巴结转移是胃癌常见的转移方式,因此对于淋巴结转移的患者,合理的淋巴结清扫范围对患者术后的预后及生存非常重要。荷兰胃癌小组在1989年8月至1993年7月对711 例局部进展期胃癌进行了一项Ⅲ期临床试验,目的是比较D1 与D2 淋巴节清扫术的效果。随着15年随访结果的发表,证实D2 淋巴节清扫术可使进展期胃癌患者获益。尽管D2 淋巴结清扫术组的手术死亡率(10%)高于D1 淋巴结清扫术(4%),但D2 淋巴结清扫术后胃癌相关死亡率(37%)较D1 淋巴结清扫术(48%)有明显下降,且局部复发率也有所降低[14]。D2 淋巴结清扫术已逐渐成为全世界范围内标准的进展期胃癌淋巴结清扫方案。
目前,PALN 转移在TNM 分期中被归为M1 期,视为远处转移,不包括在标准的D2 淋巴结清扫范围内[2]。而另一方面有研究者建议考虑将胃癌转移至PALN 视为可切除的病例而不是转移性肿瘤,因为与其他转移性肿瘤相比,在此类患者中观察到的长期结局要好得多[3]。但D2+PAND 是否能够延长患者生存期仍不明确。日本临床肿瘤学小组开展了一个多中心临床随机试验(JCOG9501)研究。在这项研究中,共分配523 例患者来比较单纯D2 淋巴结清扫术与D2+PAND 对进展期胃癌患者预后的影响。结果显示两组的手术相关死亡率无显著差异,5年生存率分别为70.3% 和69.2% (HR=1.03 ,95%CI :0.77 ~1.37;P=0.85),5年无复发生存率分别为61.7% 和62.6%(HR=1.08,95%CI:0.83~1.42;P=0.56)。但D2+PAND组的术后并发症发生率明显高于D2 组(分别为28.1%和20.9%)[15]。因此,采用D2 淋巴结清扫仍被认为是局部进展期胃癌的标准常规淋巴结清扫术,无必要进行扩大切除。然而该研究存在一定的缺陷:入组患者术前均诊断为无PALN 转移,术后病理结果显示仅有8.5% 的患者No.16 淋巴结为病理阳性,且N0 和N1 期患者占比较高为24.6%。结果可能会弱化D2+PAND 的效果。因此,JCOG9501 临床试验仅否定了预防性PAND 的临床意义,治疗性的PAND是否有价值还有待进一步探究。
Kunisaki 等[16]回顾性比较D2(430 例)和D2+PAND(150 例)手术结果。认为D2 和D2+PAND患者之间的生存时间无显著差异。Yonemura 等[17]进行的多中心临床研究以评估D2+PAND 是否可以使患者获益,D2(135 例)手术后5年生存率为52.6%,D4(134 例)手术后5年生存率为55.0%,D2 和D4 组之间的生存率差异无统计学意义(P=0.801),且D4 组的手术风险更高。因此不建议对可治愈的晚期胃癌患者进行预防性D4 手术。有研究评估D2+PALD 对胃癌的生存益处,D2+PALD 组的3年和5年总生存率分别为73.2%和65.8%,D2 组分别为73.2%和66.1%,差异无统计学意义[11]。因此,对进展期胃癌不建议使用常规的D2+PAND。
另有一些回顾性研究得出了相反的结论。Tokunaga 等[18]的回顾性研究分析178 例病理明确PALN转移胃癌患者行D2+PAND 手术后的资料,报告了病理阳性淋巴结个数≤15 枚且大体分型为4 型以外的患者的5年生存率高达28.6%。该研究认为在特定患者中由受过专业训练的外科医生进行治疗性D2+手术具有一定价值。Zhang 等[19]的研究将165 例明确有1~3 枚淋巴结转移的患者分为PAND 组(72 例)和非PAND 组(93 例),结果显示5年生存率PAND组相比非PAND 组有较大提高(43.7%vs.31.8%,P=0.04)。Ozmen 等[20]的研究显示对于进展期(ⅢA~ⅢB)胃癌患者,D2+PAND 的生存率优于D2 手术,且不会增加术后发病率和死亡率。《日本胃癌治疗指南》第4 版(2014)指出:在无远处转移时,对于PALN 转移局限于No.16a2、No.16b1 的患者,行治疗性D2+PAND 可使患者生存获益[21]。因此胃癌伴PALN 转移患者是否行D2+PAND 仍存在争议,需要进一步的研究来确定其能否使患者生存获益。各项针对腹主动脉旁淋巴清扫疗效的临床试验结果见表1。
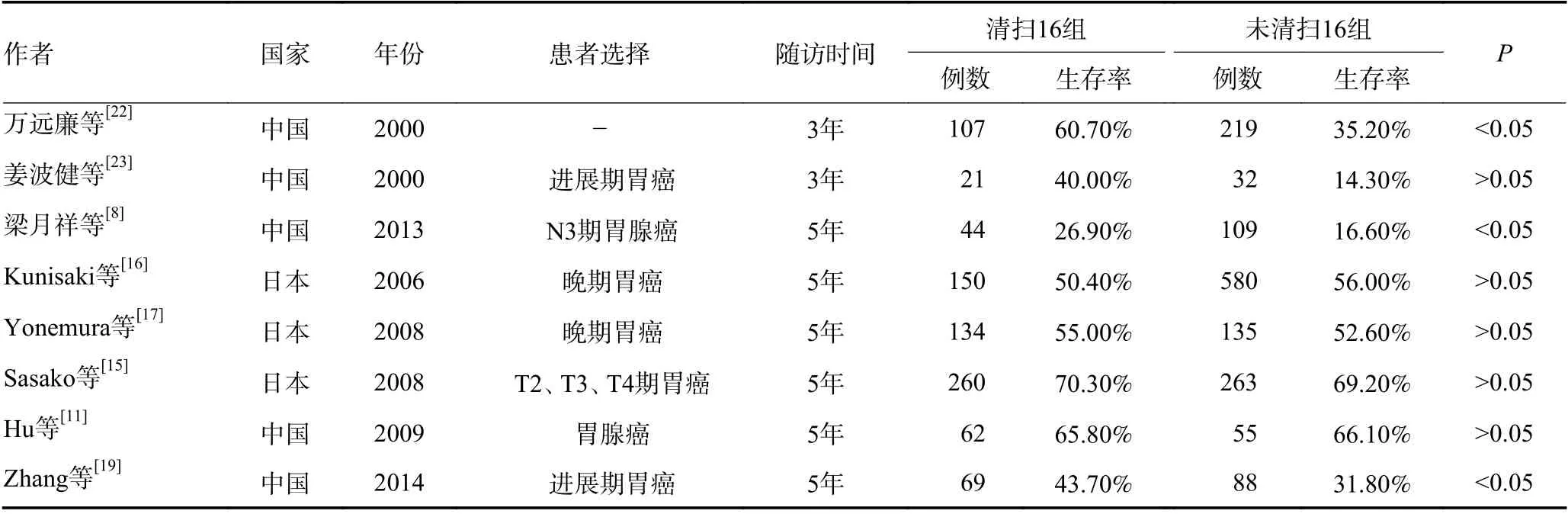
表1 腹主动脉旁淋巴清扫临床试验结果
4 多模式治疗时代下术前新辅助化疗联合PAND 的价值
近年来有研究证实,对局限性PALN 转移胃癌患者术前行新辅助化疗,再行D2+PAND 可获得较好预后。目前对于PALN 清扫普遍认为,预防性清扫并不能改善患者生存;对于不存在远处转移等非治愈性因素的PALN 可疑转移的胃癌患者,应行新辅助化疗,化疗有效患者可行D2+PAND 以期获得R0 切除并改善生存。日本第5 版胃癌指南也做出调整,提出对单纯No.16a2/b1 组淋巴结转移的胃癌患者,推荐术前新辅助化疗联合PAND 手术综合治疗方案[24]。
为评估胃癌广泛淋巴结转移(extensive lymph node metastasis,ELM)患者术前化疗后D2+PAND 的治疗效果,日本临床肿瘤学组(Japanese Clinical Oncology Group,JCOG ) 自2000年以来进行了3 次Ⅱ期临床试验(JCOG0001、JCOG0405 和JCOG1002)。以评估术前化学疗法联合D2+PAND 对ELM 胃癌的疗效和安全性。JCOG0001 试验中,在2000年8月至2003年5月间共招募了55 例病理确诊为腺癌,伴有广泛区域淋巴结转移和PALN 转移,无远传转移的胃癌患者。所有患者均接受了伊立替康联合顺铂的术前化疗,2 至3 个周期后经评估进行D2+PAND 的胃切除术。3年生存率可达27%。该试验因3 例与治疗相关的死亡于2003年终止,死亡率>5%[25]。随后,在2005年2月至2007年6月,有53 例符合要求的胃癌患者进入JCOG0405 试验中,该试验的入组标准与JCOG0001 相似。在4 周为1 个周期疗程的前3 周中,每日两次口服S-1。顺铂(60 mg/m2)在每个周期的第8 天静脉内输注。同样在2~3 个疗程经评估后进行D2+PAND 的胃切除术,R0 切除率为82%。其结果显示RR 为64.7%,3年生存率为58.8%,且严重不良反应的发生率低,未出现治疗相关的死亡事件[26]。基于这些Ⅱ期试验结果,JCOG 认为术前S-1 加顺铂化疗是晚期或复发性胃癌患者的标准治疗方法。JCOG1002 研究是一项多机构Ⅱ期试验。目的是评估术前多西他赛+顺铂+替吉奥(docetaxel+cisplatin+S-1,DCS)三联化疗方案用于ELM 胃癌的安全性和有效性[27]。在2011年7月至2013年5月之间,共招募53例患者,所有患者术前接受2 至3 个周期的三联化疗,在每个周期(3 周)第1 天静脉滴注多西他赛(40 mg)和顺铂(60 mg/m2),第1 天至第14 天每天口服S-1(80 mg/m2),随后休息1 周。经评估可行D2+手术前休息两周,然后进行D2+PAND 胃切除术,术后1年口服S-1。主要研究终点是评估术前化疗的危险比(risk ratio,RR)。在初步分析中,DCS 的RR(57.7%)低于JCOG0405 试验中的双重化疗方案。病理RR为50.0%(26/52)。尽管DCS 疗法可行,但不能产生足够的RR。在所有患者中,其5年总生存率为54.9%(95%CI:40.3%~67.3%)。在44 例R0 切除的患者中,5年无复发生存率为47.7%(95%CI:32.5%~61.5%),生存率均未改善[28]。因此S-1 加顺铂新辅助化疗后再行D2+PAND 可能是进展期胃癌的一种治疗选择。3项针对术前新辅助化疗联合腹主动脉旁淋巴清扫的Ⅱ期临床试验结果见表2。
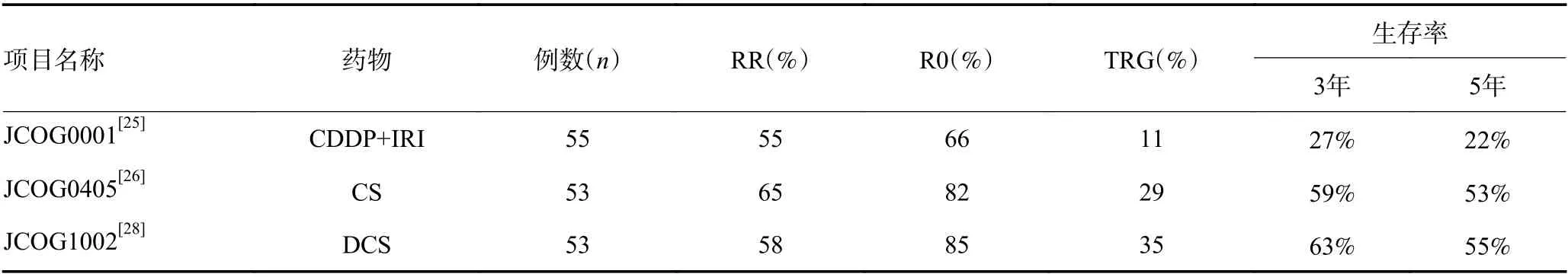
表2 术前新辅助化疗联合腹主动脉旁淋巴清扫临床试验结果
国内的研究也同样显示出术前化疗联合手术治疗胃癌伴PALN 转移患者可使患者生存获益。Wang等[29]进行的一项单臂Ⅱ期试验显示对于PALN 转移的胃癌患者,卡培他滨和奥沙利铂(XELOX)新辅助化疗表现出良好的反应率和足够的R0 切除率,且具有良好的安全性。该研究将48 例胃癌伴PALN 转移患者进行每3 周一次XELOX 化疗,两个周期后根据化疗反应酌情进行手术。结果显示一线化疗反应率为49.0%,临床获益反应率为85.1%。所有患者的中位无进展生存期和总生存期分别为10.0、29.8 个月。与非手术组相比,手术组患者具有更好的生存结局。魏晟宏等[30]回顾性分析25 例术前奥沙利铂联合替吉奥(SOX)化疗后行D2+PAND 的患者资料,长期随访结果显示25 例患者中位无进展生存期和总生存期分别为20、29 个月。3年总生存率和无疾病进展生存率分别为48%和38%。术前新辅助化疗联合手术的综合治疗可以明显改善此类患者的预后,但术前化疗用何方案,化疗后能否手术等问题仍需进一步探究。
5 结语与展望
临床上PALN 肿大的病例通常作为ELM 胃癌处理。胃癌伴PALN 转移的标准治疗方法尚未确定。3项针对术前新辅助化疗联合腹主动脉旁淋巴清扫的Ⅱ期临床试验结果表明,S-1 加顺铂新辅助化疗后再行手术切除加PAND 可能是治疗进展期胃癌的一种治疗选择。但许多临床问题仍未解决,包括诊断的准确性,最佳治疗方案,淋巴结清扫范围等。诸多相关研究的结果显示并不一致,这可能是由于缺乏大样本、多中心的临床研究和使用的技术、标准化方法及样本量的差异所导致。需要更深入的研究去探索胃癌PALN 的引流途径,明确PAND 的准确预测因素、以进一步的证据和前瞻性临床试验来建立胃癌伴PALN 转移的最佳策略,制定标准的治疗方式,使胃癌伴PAND 患者获得最大的生存收益。

