NLR、PLR与ⅠB2~ⅡB期宫颈癌新辅助化疗效果及预后的关系
梁春燕 郑瑞芳 黄艳萍
宫颈癌(cervical cancer)是妇科常见的恶性肿瘤,发病率仅次于乳腺癌,严重威胁着女性患者的生命健康。据报道,我国每年新发宫颈癌病例约13万,死亡病例约5.3万,居世界第2位,且很多患者初次诊断时已发展为中晚期[1]。新辅助化疗因其能使局部癌原发灶缩小、降低局部复发率,甚至提高患者生存时间而推荐作为宫颈癌初始治疗方法[2]。以往报道指出,针对临床反应有效的患者给予新辅助化疗治疗后,患者肿瘤分期能够降低,有利于提高手术净切率,但部分患者经新辅助化疗后,疗效并不明显,且可能伴各种不良反应等[3]。目前,临床尚无有效的标准评估宫颈癌新辅助化疗效果,故积极探讨评估宫颈癌新辅助化疗效果的指标是临床研究的重点。近年来,肿瘤与炎症的相关性已成为临床研究的热点,诸多研究指出,肿瘤周围的炎细胞浸润对肿瘤的预后有重要作用[4]。肿瘤相关性炎症指标如外周血中性粒细胞计数与淋巴细胞计数的比值(neutrophil/lymphocyte ratio,NLR)、血小板与淋巴细胞比值(platelet/lymphocyte ratio,PLR)被广泛应用于各种恶性肿瘤患者预后的预测[5],但与ⅠB2~ⅡB期宫颈癌患者新辅助化疗效果及预后的相关性尚不明确,本文通过回顾性分析对此进行探讨,现报告如下。
1 资料与方法
1.1 一般资料
回顾性分析2014年3月-2019年3月180例在韶关市第一人民医院接受新辅助化疗和根治性手术的ⅠB2~ⅡB期宫颈癌患者为研究对象,年龄28~73岁,平均(48.67±12.09)岁。以NLR≥2.89设为NLR高组(n=105),NLR<2.89设为NLR低组(n=75);并以 PLR≥134.27设为 PLR 高组(n=111),PLR<134.27设为 PLR低组(n=69)。纳入标准:(1)依据国际妇产科联盟(International Federation of Gynecology and Obstetrics,FIGO)临床分期标准[6],经妇科检查及病理评估确诊为宫颈癌;(2)患者均为初次治疗;(3)术前未合并其他多原发癌;(4)术前经诊断无远处转移。排除标准:(1)随访资料不完整;(2)2周内发生急性感染;(3)合并其他恶性肿瘤;(4)合并严重出血性疾病;(5)合并自身免疫性疾病及严重肝肾功能损害;(6)合并其他盆腔外疾病者;(7)不愿意参加本次研究。
1.2 方法
1.2.1 资料及标本采集 收集所有患者年龄、淋巴结转移、肿瘤浸润深度、病理类型、肿块大小、FIGO分期、脉管浸润及病理分级等临床资料。所有患者均于化疗前1周进行空腹采集外周静脉血5 ml,送本院检验科检验血常规,并通过中性粒细胞计数、血小板计数与淋巴细胞计数计算得出NLR和PLR。
1.2.2 妇科检查 由两名副主任医师职称以上的妇科医师对所有患者在化疗治疗前及治疗后进行妇科检查。取膀胱截石位,将外阴充分暴露,充分暴露阴道及宫颈口,对宫颈口的大小、形态等进行观察,分析有无接触性出血。结合三合诊检查对子宫的位置、大小及子宫两旁及双侧附件区的浸润情况等,并进一步判断盆腔有无病灶及直肠是否受肿块浸润等。
1.2.3 新辅助化疗方案 采取TP方案:第1天,紫杉醇(生产厂家:云南汉德生物技术有限公司;国药准字 H10960322)175 mg/m2,静脉滴注,3 h 内滴注完毕;第1~3天,静脉滴注顺铂(生产厂家:齐鲁制药有限公司;国药准字H37021362)75 mg/m2,均为1次/d,1个化疗周期为3周,持续化疗3个周期。
1.2.4 手术方案 新辅助化疗结束后6~8周采取手术切除。术前常规准备,所有患者均采取广泛性全子宫切除术+盆腔淋巴结清扫术±腹主动脉旁淋巴结清扫术。根据患者的年龄及意愿决定是否保留卵巢。
1.2.5 疗效评定 主治医师需在新辅助化疗3~4周后观察研究对象的宫颈肿块及宫旁情况,并根据CT检查或阴道B超测量肿瘤病灶大小,进行肿瘤临床反应评价。根据WHO实体瘤治疗效果的评价标准判断近期疗效,完全缓解(complete remission,CR):肿瘤病变完全消失;部分缓解(partial remission,PR):肿瘤病灶最大直径缩小>50%以上;稳定(stable disease,SD):肿瘤最大直径缩小≥25且≤50%;进展(progressive disease,PD)肿瘤病灶最大直径缩小<25%以上或出现新的病灶[7]。有效=CR+PR,无效=SD+PD。
1.2.6 术后辅助治疗 以下情况需给予术后辅助治疗:(1)局部肿瘤直径 >4 cm;(2)发生淋巴结转移;(3)淋巴脉管浸润、深间质浸润、宫旁浸润;(4)手术切缘阳性。根据病理结果确定是否需给予放疗或新辅助化疗方案。以45~50 Gy为盆腔照射剂量,阴道切缘阳性者需再次切除后放疗。
1.2.7 随访 包括电话及门诊随访。出院后1个月内门诊复查,以后每3个月门诊复查1次,末次随访截至2020年3月31日。从化疗开始日至随访结束日或者至患者死亡日为总生存(overall survival,OS)时间。从化疗开始日至确诊复发日为无疾病生存(disease-free survival,DFS)时间,复发或病灶转移以B超、CT、MRI、PET-CT等影像学检查结果为准。
1.4 统计学处理
本研究数据统计采用SPSS 19.0软件进行分析,以率(%)表示计数资料,组间比较采用χ2检验,病理分级资料采用秩和检验。根据治疗前NLR、PLR水平,以Kaplan-Meier法绘制生存曲线,比较不同NLR、PLR水平对宫颈癌患者OS的影响。Log-rank法进行生存率比较。Cox比例风险模型进行多因素相关的生存分析。P<0.05为差异有统计学意义。
2 结果
2.1 各组患者临床病理特征比较
NLR高组年龄≥50岁、淋巴结转移、肿块直径≥4 cm率显著高于NLR低组,PLR高组年龄≥50岁、淋巴结转移、浸润深度≥1/2、肿块直径≥4 cm、脉管浸润率均显著高于PLR低组,差异均有统计学意义(P<0.05);NLR高组与NLR低组浸润深度、病理类型、FIGO分期、脉管浸润及病理分级相比,PLR高组与PLR低组病理类型、FIGO分期、病理分级相比,差异均无统计学意义(P>0.05),见表 1、表 2。
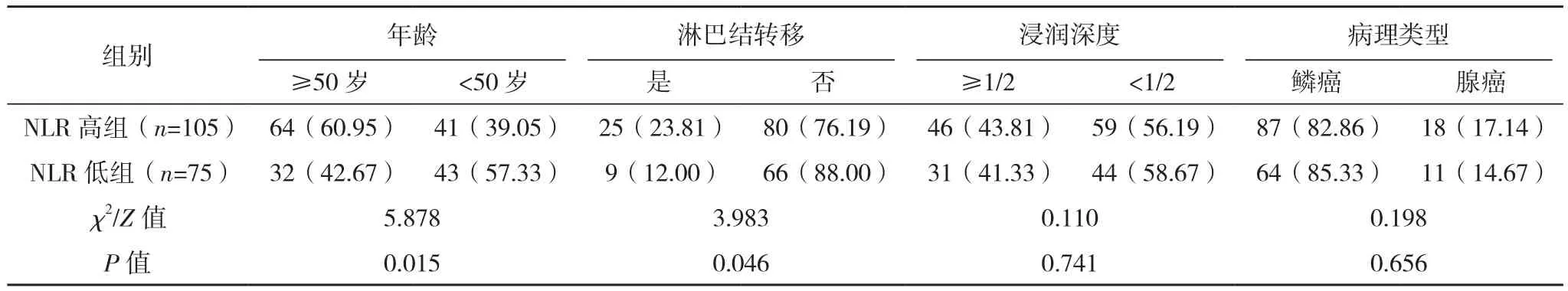
表1 NLR高组与NLR低组患者临床病理特征比较[例(%)]
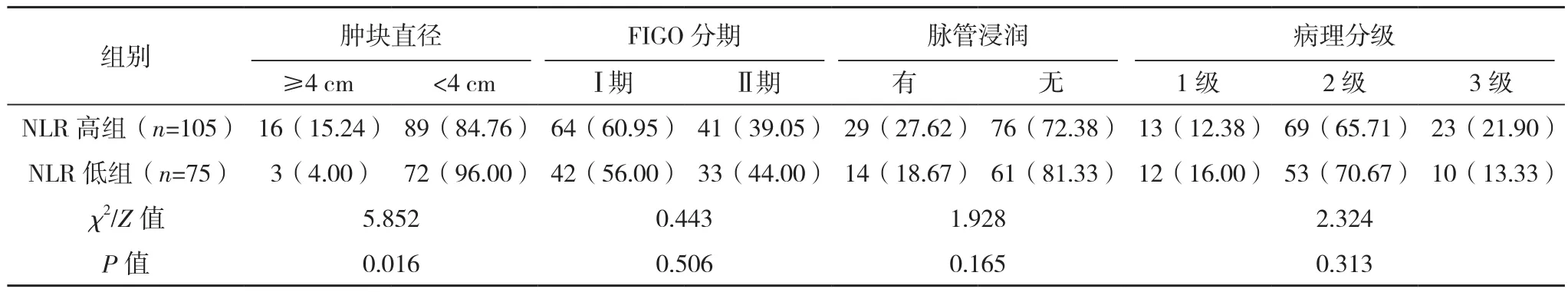
表1(续)
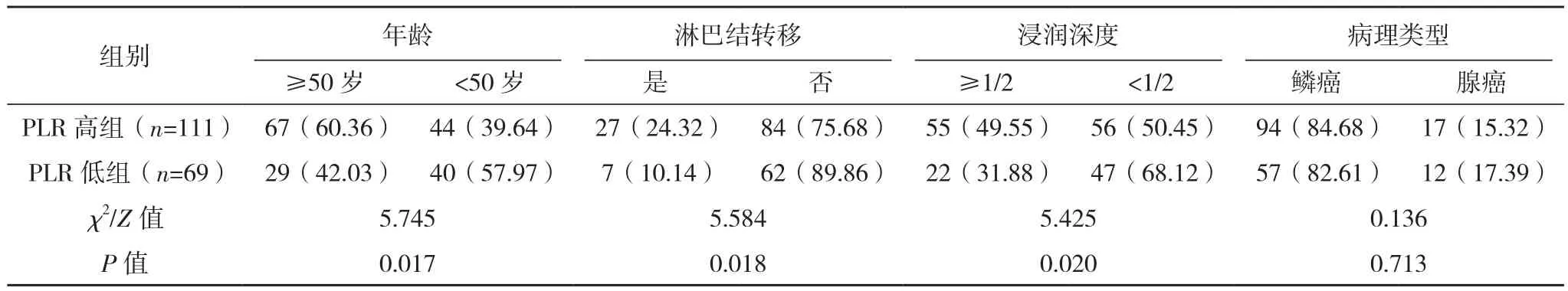
表2 PLR高组与PLR低组临床病理特征比较[例(%)]
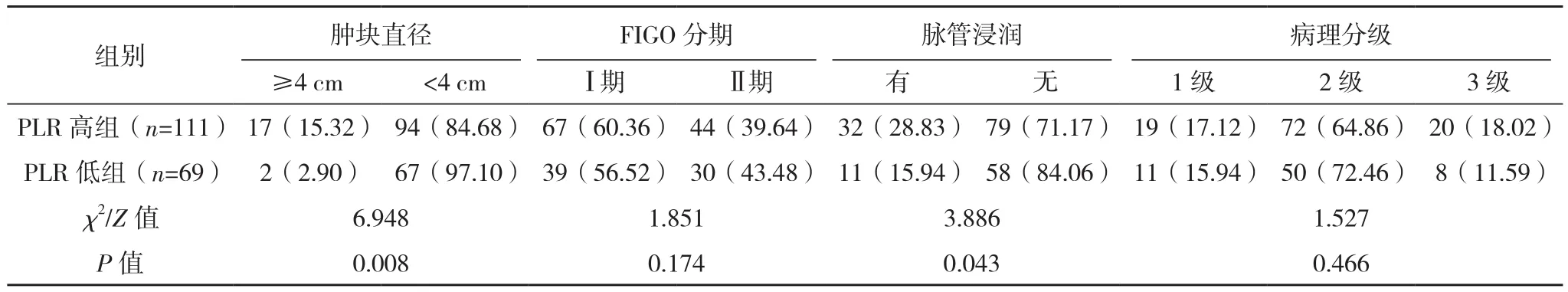
表2(续)
2.2 NLR、PLR与新辅助化疗效果的关系
180例宫颈癌患者接受新辅助化疗后,根据化疗效果分为有效组(CR+PR)136例及无效组(SD+PD)44例。NLR高组、PLR高组化疗有效率显著低于NLR低组、PLR低组,差异均有统计学意义(P<0.05),见表 3、表 4。
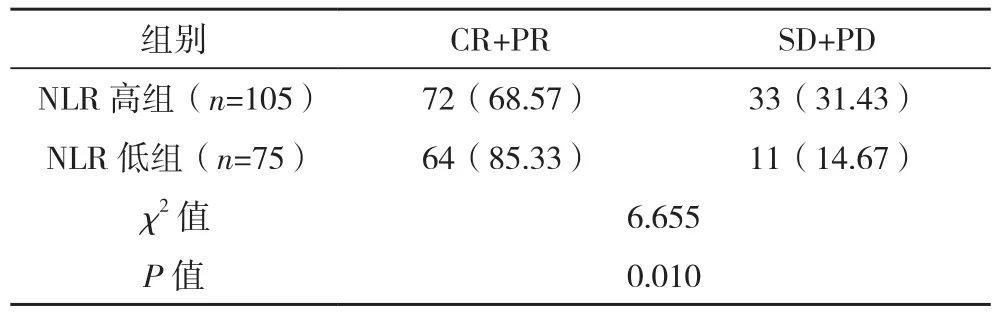
表3 NLR高组与NLR低组新辅助化疗效果比较[例(%)]
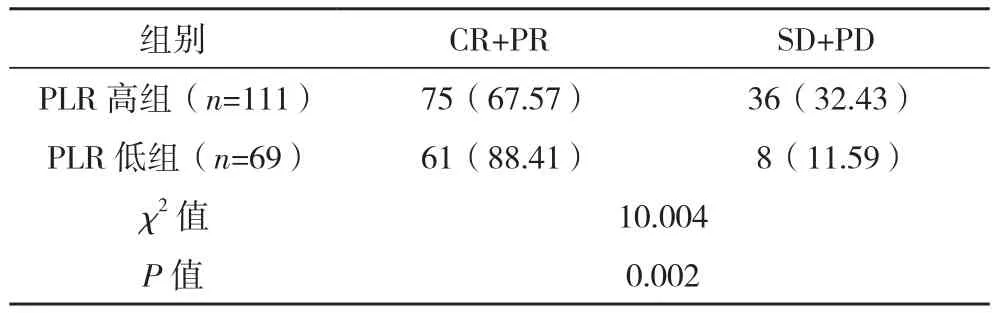
表4 PLR高组与PLR低组新辅助化疗效果比较[例(%)]
2.3 NLR、PLR与患者OS的关系
对所有患者进行为期1年的随访,至随访终止时,共161例存活,19例死亡,根据治疗前NLR、PLR水平绘制生存曲线。NLR高组(NLR≥2.89)与NLR 低组(NLR<2.89)OS[86.67%(91/105)vs 93.33%(70/75)],以及PLR高组(PLR≥134.27)、PLR低组(PLR<134.27)OS[88.29%(98/111)vs 91.30%(63/69)]比较,差异均无统计学意义(P>0.05),见图1。
2.4 NLR、PLR对宫颈癌患者DFS的影响
NLR高组、NLR低组患者中无疾病进展分别为83、68例,PLR高组、PLR低组患者中无疾病进展分别为87、64例。NLR高组DFS显著低于NLR低组 [79.05%(83/105)vs 90.67%(68/75)](χ2=4.336,P<0.05),PLR高组DFS显著低于PLR低组[78.38%(87/111)vs 92.75%(64/69)](χ2=6.506,P<0.05),见图2。
2.5 宫颈癌患者OS和DFS的影响因素
赋值情况,年龄:≥50岁=1,<50岁=0;淋巴结转移:是=1,否=0;浸润深度:≥1/2=1,<1/2=0;病理类型:腺癌=1,鳞癌=0;肿块直径:≥4 cm=1,<4 cm=0;FIGO 分 期:Ⅱ 期 =1,Ⅰ 期=0;脉管浸润:有=1,无=0;病理分级:1级=1,2级=2,3级 =3;NLR:≥2.89=1,<2.89=0;PLR:≥134.27=1;<134.27=0。
Cox比例风险模型结果显示,淋巴结转移、浸润深度和肿块直径均是宫颈癌患者OS和DFS的独立影响因素,此外,NLR和PLR也是DFS的独立影响因素,差异有统计学意义(P<0.05),见表5。

表5 Cox比例风险模型分析宫颈癌患者OS和DFS的影响因素
3 讨论
新辅助化疗是宫颈癌早期治疗的主要方法,虽然对新辅助化疗有反应的宫颈癌患者行根治术后能显著提高患者的肿瘤局部控制率和生存率,但对于如何在治疗前评估对新辅助化疗有临床反应的患者仍是目前临床面临的难题。近年来随着分子生物医学的不断进步,诸多研究证实在肿瘤发生发展中全身炎症反应发挥了重要作用[8]。最常见的与癌症相关的血细胞变化包括增多的血小板、中性粒细胞、白细胞及减少的淋巴细胞[9]。
中性粒细胞是外周血白细胞中的主要细胞,参与肿瘤微环境的形成,一方面可通过释放某些细胞因子刺激肿瘤血管的生长,促进肿瘤进展,另一方面可通过抑制淋巴细胞抑制机体免疫系统。抗癌细胞包括淋巴细胞,其可识别及消灭癌细胞,同时能够分泌一系列免疫因子激活人体自身的免疫反应。血小板是一种与肿瘤相关的全身炎症反应指标,与患者自身炎症呈正相关,通常在恶性肿瘤中表达升高并释放一系列生长因子促进恶性肿瘤细胞的增殖和黏附[10]。因此中性粒细胞、淋巴细胞及血小板在肿瘤炎症免疫机制中相互作用,将以上指标结合起来研究更能反映机体炎症水平[11]。NLR和PLR是兼顾机体炎症和免疫状态的一种平衡,能够动态地反映机体炎症状态的变化。高NLR和PLR反映了中性粒细胞和血小板依赖的高炎症反应及淋巴细胞介导的抗肿瘤免疫反应的降低,进而增高肿瘤的生物学活性和肿瘤进展[12]。
此外,大量研究表明NLR和PLR与肿瘤的疗效及预后相关。Zhang等[13]研究分析440例结直肠癌患者的预后与NLR的关系,发现NLR升高患者术后复发率更高。Liu等[14]分析的研究,发现NLR升高的患者总生存率和无病生存率显著降低。Hu等[15]研究发现,无转移肾细胞癌患者术前NLR水平较高,则给予肾切除术后复发率明显升高。Sun等[16]研究计算了127例患者治疗前NLR和PLR,发现二者是接受胰腺导管腺癌切除患者的独立不良预后因素。Hiromi等[17]分析310例软组织肉瘤术后患者预后指标,发现PLR和NLR结合使用具有更好的预测能力。Yang等[18]发现NLR是影响下咽鳞状细胞癌患者总体生存时间及无病进展生存时间的独立危险因素。Zhao等[19]研究表明,治疗前高PLR组上皮性卵巢癌患者具有更低的生存率及无进展生存期。Tao等[20]研究发现,与高PLR组相比,低PLR组患者的5年生存率明显升高,且PLR是影响结直肠癌预后的独立危险因素。以上研究提示治疗前NLR和PLR对治疗后肿瘤患者预后的判断具有重要价值。
本研究分析的180例ⅠB2~ⅡB期宫颈癌患者,分为NLR高组、NLR低组和PLR高组、PLR低组,发现NLR和PLR高、低两组均在年龄、淋巴结转移和肿块直径等方面比较差异有统计学意义(P<0.05),PLR高、低两组还在浸润深度方面比较差异有统计学意义(P<0.05),这反映了NLR和PLR在肿瘤形成过程中的作用,提示二者与肿瘤进展的联系。Yang等[21]研究报道,高PLR水平与子宫内膜癌患者的宫颈间质浸润有关,术前PLR能作为预测子宫内膜癌患者宫颈间质浸润情况的指标。同时,本研究还发现高水平NLR和PLR患者新辅助化疗效果较差,这可能与高水平的NLR和PLR往往伴随淋巴结转移、肿块较大及肿瘤浸润较深有关。进一步探讨NLR和PLR与预后的关系,发现NLR、PLR高组宫颈癌患者治疗后无疾病进展生存率均显著低于NLR、PLR低组,同时均是无病进展生存率的独立影响因素,提示二者对无疾病进展生存期有较好的独立预测价值。但本研究未发现两组在总生存率方面的显著差异,通过多因素Cox回归分析发现NLR和PLR均不是患者总生存率的独立影响因素(P>0.05),患者总生存率主要受到淋巴结转移、浸润深度和肿瘤直径等的影响。因此二者对总生存率的预测价值有待进一步研究。
综上所述,治疗前外周血NLR、PLR高往往提示宫颈癌患者新辅助化疗效果和预后差,二者检测方便且不会增加患者经济负担,有望成为预测早期宫颈癌患者新辅助化疗效果和预后的补充性临床指标,但由于本研究样本量较小,样本选择局限于单中心,因此仍需多中心、大样本研究进一步的验证。

