基底膜蛋白多糖对肌萎缩相关因子myostatin和IGF-1信号表达的影响
许 卓,杨寿君,石洪峰,王月英,平泽惠理
(1.吉林大学中日联谊医院,吉林 长春130033;2.日本东京顺天堂大学老人疾患研究中心)
肌少症(sarcopenia)又称“肌肉减少症”,由Rosenberg于1989年首次命名。国际肌少症工作组将肌少症定义为与增龄相关的进行性、全身肌量减少和(或)肌强度下降或肌肉生理功能减退[1]。大量研究表明,老年人群骨折与肌量减少、肌力下降、跌倒增加、骨量减低密切关联。对患者生活质量及生存时间均造成严重影响,已成为威胁公众健康的重要疾病之一。
细胞外基质(extra cellular matrix,ECM)为肌肉卫星细胞再生、增殖、分化提供重要的细胞外环境[2],基底膜蛋白聚糖(perlecan)作为细胞外基质主要的硫酸肝素类蛋白聚糖之一,广泛存在于神经肌肉接合部,在肌肉细胞增殖过程中发挥重要调节作用[3-4]。肌肉生长抑制素(myostatin)和胰岛素样生长因子-1(insulin-like growth factor-1,IGF-1)分别作为肌肉增殖的抑制因子和促进因子在肌肉再生、增殖、分化过程中具有重要调控作用[5-6]。本研究旨在观察perlecan对肌肉萎缩相关分子myostatin和IGF-1表达的影响,为明确perlecan在调节肌肉卫星细胞增殖中的作用及机制提供证据,并为治疗肌少症提供新的治疗途径。
1 材料与方法
1.1 肌肉卫星细胞培养及perlecan因子添加
采用Hashimoto等[7]介绍的单一肌纤维提取技术,从12周龄C57小鼠腓肠肌中培养原代肌卫星细胞,用含2%马血清(Invitrogen)和0.05%鸡胚提取物(MP Biomedicals)的DMEM (Invitrogen)处理90%融合度的成肌细胞11天备用(见图1)。然后将肌卫星细胞分为实验组和对照组,实验组添加20ng /ml的perlecan因子,对照组添加同等剂量的正常培养液,同时进行30 min培养。
1.2 总蛋白提取
将perlecan刺激反应30 min后的两组肌卫星细胞回收制备提取物,缓冲液包括50 mM Tris(pH 7.6),0.5%脱氧胆酸钠,150 mM NaCl,1 mM EDTA,1% Triton X-100,蛋白酶和磷酸酶抑制剂混合物。匀浆在4℃,10,000 ×g离心15 min,收集收集上清液用于Western blot分析。
1.3 Weston blot分析
检测总蛋白样本中Myostatin(1∶100)和其下游通路的smad2/3以及phospho-smad2;IGF-1和其下游通路的Akt以及抗磷酸化Akt蛋白的水平。采用蛋白定量试剂盒(Pierce BCA蛋白测定试剂盒);然后用合适的匀浆缓冲液将样品稀释到相同的浓度。用SDS-PAGE分离含24 μg总蛋白的样品,并转移到聚偏二氟乙烯膜上。转移后,用Ponceau S染色,在白光下用化学发光探测器(Amersham Imager 600)扫描后,用含0.1% Tween-20的tris缓冲盐水对膜进行脱色,用5%脱脂牛奶在相同的缓冲液中室温封闭1小时。然后冲洗膜,在4℃下与一抗孵育过夜,随后与辣根过氧化物酶结合的抗小鼠抗体在室温下孵育1小时。免疫检测采用化学发光试剂和化学发光探测器(Amersham成像仪600)。用ImageJ软件[8]测量捕获图像中的波段强度。使用了以下抗体:抗myostatin(1∶100)、抗TGF-β抗体(1∶500),抗smad2/3抗体(1∶1000)、抗phospho-smad2抗体(Ser465/467)(1∶100);抗IGF-1(1∶200)、抗Akt抗体(1∶1000)、抗磷酸化Akt抗体(1∶1000)。
1.4 定量RT-PCR检测
根据试剂盒说明书使用TRIzol试剂(Invitrogen)分别从实验组和对照组的肌肉卫星细胞中分离总RNA。1.5 μg总RNA,采用MMLV逆转录酶和oligo(dT)引物[9]生成cDNA,利用ABI PRISM 7500型快速序列检测系统进行实时定量扩增,反应总体系为25 μl,并进行定量PCR样本分析,以GAPDH作为内参。
1.5 统计学分析
2 结果
2.1 肌卫星细胞形态学观察
按照单一肌纤维提纯法进行肌肉卫星细胞培养,培养第5天时可见卫星细胞中呈梭形的细胞已贴壁生长,呈圆形细胞尚未贴壁(图1A)。第7天时可见卫星细胞基本已经贴壁生长,并开始融合(图1B)。第9天时培养细胞进一步增粗、变长,开始融合且呈方向性生长(图1C)。第11天时细胞进一步融合形成许多长的肌管(图1D)。

图1 肌卫星细胞形态学观察
2.2 在肌卫星细胞中,检测myostatin和IGF-1及相关下游信号的蛋白免疫印记
2.2.1通过蛋白免疫检测发现,perlecan添加组肌肉萎缩促进因子myostatin蛋白质表达量较对照组上升57%,肌肉萎缩抑制因子IGF-1蛋白质表达量较对照组下降31%,组间差异均具有统计学意义(P<0.05),提示perlecan对肌肉萎缩相关因子myostatin及IGF-1表达具有显著影响作用(见图2)。

图2 肌卫星细胞Myostatin和IGF-1蛋白免疫印迹定量检测(*P<0.05)
2.2.2对照组和添加组分别用10 ng/ml的Myostatin处理30 min。通过抗磷酸化Smad2 (Ser465/467)抗体免疫印迹分析激活的Smad2。用抗Smad2/3抗体复制相同的印迹。Myostatin在对照组和添加组中都能激活Smad信号,而在添加组中,Myostatin下游信号通路的Smad2磷酸化出现过度表达37%,组间差异具有统计学意义(P<0.05)(见图3)。

图3 肌卫星细胞中Smad信号通路磷酸化表达(*P<0.05)
2.2.3对照组和添加组用20 ng/ml的IGF-1处理30 min。通过抗磷酸化Akt抗体免疫印迹分析激活的Akt。用抗Smad2/3抗体复制相同的印迹。IGF-1在对照组和添加组中都能激活Akt信号通路,而在perlecan添加组中,发现IGF-1下游信号通路的Akt磷酸化表达水平降低63%,组间差异具有统计学意义(P<0.05)(见图4)。
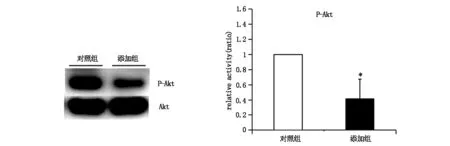
图4 肌卫星细胞中Akt信号通路磷酸化表达(*P<0.05)
2.3 定量RT-PCR分析
通过定量RT-PCR检测发现,perlecan添加组和对照组myostatin和IGF-1的mRNA表达变化情况(图5)。结果显示,perlecan添加组肌肉萎缩促进因子myostatin的mRNA表达量较对照组上升13%,肌肉萎缩抑制因子IGF-1表达量较对照组下降9%,组间差异均具有统计学意义(P<0.05)(见图5)。
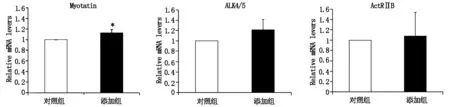
图5 肌卫星细胞Myostatin及IGF-1定量PCR检测结果比较(*P<0.05)
3 讨论
目前随着社会的不断老龄化,由于肌少症造成的肌肉力量减弱,身体动态平衡和静态平衡能力下降等临床表现较常见,病理表现为肌肉体积缩小,肌纤维变细或消失。通常肌肉组织依靠肌肉细胞促进因子和抑制因子的相互制约协调维持其动态平衡,而这种平衡受到细胞外基质等微环境内的多种自分泌或旁分泌因子调节,其中perlecan作为细胞外基质的重要组成分子,因其广泛存在于神经肌肉结合部而在防治肌肉萎缩方面受到广泛关注。
Perlecan是细胞外基质中硫酸肝素类蛋白聚糖之一,由核心蛋白和四条硫酸肝素(heparan sulfate,HS)侧链组成,其核心蛋白含5个功能区,N 端附着有3条长的HS侧链,核心蛋白功能区上还有一个HS侧链的附着位点,可以通过四条硫酸肝素侧链与相关细胞因子结合,从而影响细胞因子表达[10]。Perlecan作为一种稳定基质结构和细胞-基质相互作用的黏合剂,能介导生长因子信号对细胞增生和分化的作用[11]。本实验在体外培养肌卫星细胞并添加Perlecan因子,经蛋白免疫印迹定量分析及PCR检测发现,添加perlecan因子能促使肌肉卫星细胞中myostatin含量升高,同时使其下游Smad信号通路的磷酸化水平过表达。能够使IGF-1含量降低,同时降低了其下游AKT信号通路的磷酸化表达水平。表明perlecan因子可能与肌肉萎缩促进因子myostatin呈正相关作用,与肌肉萎缩抑制因子IGF-1呈负相关作用,从而使perlecan在肌肉卫星细胞增殖过程中起到重要的调控作用。
另外,Ning L等研究表明[12],perlecan缺乏导致p70S6k和Akt磷酸化水平降低,AMPKα磷酸化水平升高,并且通过激活mTORC1通路抑制自噬过程,而这种自噬反应可能成为增强骨骼肌萎缩治疗疗效的新靶点。Satoshi等研究发现[13],在去神经支配过程中,perlecan通过激活FoxO信号和泛素-蛋白酶体系统,促进nNOS离域,刺激蛋白质降解和肌肉萎缩。这些研究都为perlecan因子在应用治疗肌少症方面提供了新的思路。
综上所述,本研究结果表明perlecan因子对myostatin及IGF-1表达具有调控作用,其调节机制可能是其核心蛋白功能区上一个HS侧链的附着位点上,通过四条硫酸肝素侧链与myostatin和IGF-1两个细胞因子相结合,从而影响细胞因子的表达。

