蛇床子素联合 TRAIL 诱导人卵巢癌细胞的凋亡及其相关机制
司丽慧,林瑞新,吴乙时,李佳慧,崔君泽,杨淑莉*
(吉林大学第二医院 1.妇产科;2.肝胆胰外科,吉林 长春130041)
卵巢癌是妇科病症中致死率处于首位的恶性肿瘤,以上皮性癌最为多见,占比近70%[1]。针对此类疾病的治疗,目前首选治疗方案为手术联合足疗程化疗,但在治疗过程中患者易出现耐药性,从而引发剧烈毒副反应,故应用极大受限[2]。对此,生物治疗技术应运而生,其中以肿瘤坏死因子相关凋亡诱导配体(TRAIL)为典型代表,其作为新型生物制剂,属于TNF超家族范畴,可特异性诱使肿瘤细胞凋亡,呈无毒性,正常细胞组织生长分化不受影响,是一类具有潜力的抗癌药物,但治疗过程中部分患者耐药性依旧存在,TRAIL临床应用亦受到阻碍[3]。为增强其抗癌效用,进一步提升疗效,辅以其他药物联合治疗为现今研究热点。而据报道证实[4]:蛇床子素作为伞形科植物中的一类纯天然香豆素,除发挥抗变态反应、抗肝炎、抗病毒及抗骨质疏松效用外,还具有广谱抗癌作用,在肺癌、肝癌及白血病等治疗中均呈现良好抗癌活性。鉴于蛇床子素联合 TRAIL 在卵巢癌抗癌作用中的研究所涉不多,本研究旨在探究蛇床子素联合TRAIL在卵巢癌中的作用,并初步探究其机制。
1 资料与方法
1.1 一般资料SKOV-3和OVCAR-3细胞株由吉林大学第二医院实验室提供,重组人TRAIL蛋白购于美国RD公司,蛇床子素、MTT、DMSO购自美国Sigma-Aldrich公司,caspase-3、caspase-9及其前体、凋亡酶激活因子(Apaf-1)、细胞色素C检测试剂盒/抗体购自美国Cell Signaling公司,Apaf-1 siRNA购自上海吉玛生物,蛋白G免疫共沉淀琼脂糖珠购自美国Santa Cruz公司,Lipofectamine 2000购自美国Invitrogen公司,RPMI1640培养基购自美国Hyclone公司,细胞凋亡检测试剂盒购自美国BD公司,Caspase活性检测试剂盒由江苏碧云天生物技术研究所支持。酶标仪为美国雷勃公司Thermo Multiskan MK3,流式细胞仪购自美国BD公司。
1.2 方法
1.2.1细胞培养与处理 细胞培养于含10%新生牛血清的RPMI1640培养基,环境条件为37℃、5%CO2。分组施加蛇床子素(0 μmol/L、25 μmol/L、50 μmol/L及100 μmol/L)及TRAIL(0 ng/mL、10 ng/mL、20 ng/mL及40 ng/mL),48小时后以MTT法检测活性,Logit法计算半数抑制浓度(IC50)后,选取蛇床子素(50 μmol/L)、TRAIL(20 ng/mL)为最终试验浓度。分别为蛇床子素组(OS组),TRAIL组(TR组),蛇床子素联合TRAIL组(OT组),空白对照组(Blank组)。
1.2.2最终浓度选择 单一施以不同浓度蛇床子素(0 μmol/L、25 μmol/L、50 μmol/L及100 μmol/L)及TRAIL(0 ng/mL、10 ng/mL、20 ng/mL及40 ng/mL),作用48 h后运用MTT法检测细胞活性,经MTT检测显示,蛇床子素及TRAIL单一作用SKOV-3和OVCAR-3 48 h后,抑制率与浓度呈正相关。由Logit法计算半数抑制浓度(IC50)后,选取蛇床子素(50 μmol/L)、TRAIL(20 ng/mL)为最终试验浓度开展研究。
1.2.3MTT法检测细胞活性 取对数生长期的细胞,每孔5×103接种于96孔版,每孔内加入20 μl MTT检测液,培养48小时后,每孔加200 μl DMSO,酶标仪测定吸光值。
1.2.4siRNA转染 转染前24 h,取对数生长期的细胞,胰酶消化后加完全培养基重悬,吸管吹打混匀制成细胞悬液。按1×106个/孔的细胞浓度将细胞接种至6孔板中,置37℃,5% CO2培养箱培养18-24 h,使其转染前每孔细胞达到80%-90%的汇合率。转染前3 h,去除原培养基,更换为不含血清和抗生素的新鲜基础培养基。采用脂质体Lipofectamine 2000根据试剂盒说明书进行转染,在37℃,5% CO2的条件下培养48小时。根据转染及其后处理的不同,细胞分为蛇床子素、TRAIL联合Apaf-1 siRNA组(si-OT组),蛇床子素、TRAIL联合阴性对照 siRNA组(NC-OT组)。
1.2.5凋亡检测 收集各组细胞,按照PE Annexin V凋亡检测试剂盒(BD,美国)说明操作,流式细胞仪检测细胞凋亡,并用配套软件进行数据分析。
1.2.6ELISA检测 设置标准品孔、0值孔、空白孔和样品孔,标准品孔、0值孔和样本孔,加入辣根过氧化物酶(HRP)标记的检测抗体,恒温箱温育60 min,自动洗板机洗板,将底物A和B按1∶1体积充分混合,所有孔中加入底物混合液,恒温箱温育15 min,所有孔加入终止液,在酶标仪上读取各孔吸光度。
1.2.7Western blot检测 RIPA提取总蛋白,对蛋白进行定量,采用SDS-PAGE对100 μg蛋白进行电泳,200 mA恒流电转印120 min,将样品转移至PVDF膜上,将膜浸于含5%脱脂奶粉的TBST室温封闭1 h;加入一抗工作液,TBST洗3次,加入二抗,室温摇床孵育1.5 h。TBST洗3次,使用EZ-ECL化学发光增强试剂盒对膜进行显色反应。
1.2.8免疫共沉淀检测 各组取2×106细胞行免疫沉淀。缓冲液裂解15 min后置于12 000 rpm离心10 min,取用上清液加入Apaf-1抗体孵育过夜,再加以蛋白G琼脂糖珠行2小时孵育,经免疫沉淀2小时后,以Western blot试验检测pro-caspase蛋白。
1.3 统计学分析将所有实验数据用SPSS22.0软件行统计处理,计量资料以“均值±标准差”表示,运用非配对双边t检验,若P<0.05,则视作差异具备统计学意义。
2 结果
2.1 蛇床子素联合TRAIL处理降低卵巢癌细胞活性并诱导凋亡
在MTT检测与流式凋亡检测结果中发现,与空白对照相比,加入药物进行处理的另外三组的活性抑制率与诱导凋亡率均有显著上升(P<0.05),其中蛇床子素与TRAIL联合使用显示出了比单独使用蛇床子素或TRAIL更高的活性抑制与诱导凋亡效果,此结果提示蛇床子素和TRAIL在抑制卵巢癌细胞活性与诱导其凋亡上具有协同作用。结果见表1及图1A、1B。
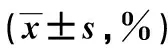
表1 细胞活性抑制率及诱导凋亡率

图1 细胞活性抑制率及诱导凋亡率
2.2 蛇床子素与TRAIL影响凋亡相关蛋白及细胞色素C表达
通过ELISA检测caspase-3、caspase-9 及细胞色素C表达情况,结果显示,TRAIL组细胞色素C呈高表达,蛇床子素组则与空白对照组细胞色素C表达水平无明显差异,提示TRAIL在卵巢癌细胞中的机制为通过细胞色素诱导线粒体分泌至细胞质中;蛇床子素组caspase-9前体蛋白表达水平与空白对照组基本一致,可知其无法直接诱使Apaf-1与caspase-9前体蛋白结合;而在蛇床子素与联合 TRAIL使用的组别中,caspase-9前体蛋白表达相对水平显著提高,可见Apaf-1表达上调促进Apaf-1与caspase-9前体蛋白结合;经ELISA检测结果显示,蛇床子可通过上调Apaf-1表达促使caspase-3、caspase-9的活化。见表2、3与图2。

表2 SKOV-3中caspase-3、caspase-9活化、细胞色素C及caspase-9 前体蛋白表达相对水平

表3 OVCAR-3中caspase-3、caspase-9活化 、细胞色素C及caspase-9 前体蛋白表达相对水平

图2 SKOV-3与OVCAR-3中caspase-3、caspase-9活化 、细胞色素C及caspase-9 前体蛋白表达相对水平
2.3 蛇床子素与TRAIL影响Apaf-1表达水平
通过Western blot检测Apaf-1表达水平发现,TRAIL组Apaf-1相对水平较空白对照组无明显差异,而蛇床子素联合TRAIL组Apaf-1则呈现显著高表达,提示蛇床子素可能通过上调Apaf-1表达起到TRAIL增敏效用。影响Apaf-1的表达可能是蛇床子素与TRAIL处理起到效果的重要机制。结果见表4与图3。

表4 SKOV-3中Apaf-1表达相对水平

图3 SKOV-3中Apaf-1表达相对水平
2.4 Apaf-1通过与caspase-9前体的相互作用影响细胞凋亡
利用免疫共沉淀检测Apaf-1与caspase-9前体的相互作用情况,结果显示Apaf-1与caspase-9前体在卵巢癌细胞中存在相互作用(图4),提示Apaf-1通过此种相互作用影响卵巢癌细胞凋亡情况是蛇床子素与TRAIL诱导卵巢癌细胞凋亡的机制。对蛇床子素、TRAIL联合Apaf-1 siRNA组(si-OT组),蛇床子素、TRAIL联合阴性对照 siRNA组(NC-OT组)两组细胞进行的凋亡检测与ELISA检测结果显示,在转染Apaf-1 siRNA后,蛇床子素联合TRAIL处理对卵巢癌细胞的凋亡诱导作用出现下降,提示Apaf-1的表达变化是蛇床子素联合TRAIL影响卵巢癌细胞凋亡的重要一环。结果见图5。

图4 Apaf-1与caspase-9前体的相互作用情况

图5 凋亡检测与ELISA检测结果
3 讨论
卵巢癌作为盆腔深部隐匿性妇科肿瘤,首次确诊多已为中晚期,因此最佳治疗时机错失,有效治疗手段缺乏,其致死率在妇科恶性肿瘤中处第一位[5-6]。目前,以肿瘤细胞减灭术联合铂类、紫杉醇等药物足疗程化疗为卵巢癌一线治疗方案,可有效延长患者生存期[7]。据有关研究证实[8]:在化疗初期阶段,60%-80%卵巢癌患者具有较高敏感性,但在持续治疗过程中,约75%以上晚期卵巢癌患者呈现耐药性,由此引发的严重副作用使治疗难度骤升。为此,医学界以卵巢癌凋亡机理为切入点开展了诸多相关研究,旨在寻求一种更为有效的治疗方案。
现如今,生物治疗成为恶性肿瘤治疗的第四大技术,在卵巢癌治疗中已取得确切疗效。TRAIL为首选生物治疗药物,于1995年首次发现,归属于TNF家族,因其肿瘤细胞凋亡属特异性诱导,且不对正常细胞产生毒性,故其作为抗癌药物潜能巨大[9]。但限于仍有部分肿瘤患者可对TRAIL治疗产生耐药性,因此,联合增敏药物,对其耐药性加以逆转,提升TRAIL杀伤肿瘤细胞能力,为现今研究热点[10]。据相关研究发现[11],单独使用蛇床子素及TRAIL无法对肾癌细胞凋亡产生影响,但联合使用,诱导肾癌细胞凋亡情况明显,且线粒体膜电位水平明显降低,细胞色素C释放增加,由此证实蛇床子素可能为TRAIL增敏剂。蛇床子作为一类天然植物化合物,可在一定程度控制上皮-间充质转变(EMT)过程,在炎症及纤维化病症中具有确切疗效[12]。据Lu K等学者[13]研究报道,使用不同剂量的蛇床子素治疗子宫内膜癌(Ec),随蛇床子素剂量上升可上调miR-424表达,从而使Ishikawa和KLE细胞增殖受到抑制并被诱导凋亡,蛇床子素已成为一种新型且具备潜力的子宫内膜癌抗癌药剂。多方证据表明,蛇床子素具备成为卵巢癌治疗药物潜能。基于此,本文研究意欲探析蛇床子素联合TRAIL 诱导人卵巢癌细胞的凋亡,并对其作用机理加以明确,旨在寻找一种新型卵巢癌治疗策略。
本文结果显示:蛇床子素+TRAIL组细胞活性抑制率及凋亡率均最高,且其中机制为Apaf-1表达上调促进了caspase-3、caspase-9活化。其中Apaf-1是线粒体通路中一个关键的促凋亡因子,在一定条件下能直接促进procaspase-9的活化和释放,从而进一步活化caspase-3,导致细胞凋亡的发生。在本研究的实验中,已经证实了Apaf-1在卵巢癌细胞中与caspase-9前体的相互作用。由此可知:蛇床子素联合TRAIL治疗具有协同效果,且可增强TRAIL抗癌效用,此过程与Apaf-1蛋白高度相关。另外可能的潜在机制在于[14]:蛇床子素联合TRAIL可影响线粒体膜电位,从而增加细胞色素C等凋亡诱导因子释放,细胞凋亡通路得以激活。有关线粒体膜电位变化的机制有待进一步实验研究探索。
此外,作为 caspase 家族引起细胞凋亡的最主要的成分之一的caspase-9,其活化直接影响到通路进程,可有效激活caspase-3效应分子,促使肿瘤细胞DNA呈片段化导致细胞凋亡,在caspase-9活化过程中,Apaf-1蛋白的参与极为关键。本研究结果已证实:蛇床子素联合TRAIL可促进Apaf-1表达上调,由此与caspase-9前体蛋白结合增强。这一机制与于有江等学者[15]所述研究有较大一致性,而Jiang G等学者[16]以卵巢癌细胞系A2780、OV2008及正常卵巢细胞IOSE80为实验模型试验,发现蛇床子素可通过G2/M阻滞抑制细胞增殖并诱使细胞凋亡,其中潜在机制与相对凋亡蛋白Bcl-2、Bax和caspase 3/9的调节有关。且据Bae H等学者[17]研究证实,蛇床子素可通过靶向调节磷脂酰肌醇3-激酶/促分裂原激活的蛋白激酶信号传导途径促进卵巢癌细胞凋亡,通过对斑马鱼异种移植测定,肯定了蛇床子素的药理作用,故将其作为卵巢癌治疗的有效药物得到了有力佐证。本文的研究结果对上述发现具有补充意义。
综上所述:蛇床子素联合TRAIL治疗卵巢癌可降低细胞活性,进而促使细胞凋亡,原因与其诱导卵巢癌细胞中细胞色素C的分泌及上调Apaf-1表达,从而通过Apaf-1与caspase-9相互作用,促进caspase-9的活化表达有关。蛇床子素与TRAIL联合使用具有较高卵巢癌治疗潜力,可为后续卵巢癌临床治疗提供重要参考。

