基于UCP2-SIRT3通路探讨瑞舒伐他汀联合丹参川芎嗪注射液对脑缺血/再灌注的影响
田洪涛 姚永新 隋媛 王其亮
(青岛市中医医院(青岛市海慈医院) 1神经外科,山东 青岛 266033; 2健康管理科;3药剂科)
脑缺血/再灌注是长时间大脑严重缺血或缺氧引起的脑梗死,出现脑水肿和脑细胞坏死,损伤器官。在临床上具有较高的发病率和死亡率,严重危害中老年患者健康,需要及时采取措施进行治疗〔1,2〕。瑞舒伐他汀(RS)属于选择性还原酶抑制剂,临床上具有降血脂、抗动脉粥样硬化,治疗脑梗死的作用〔3〕。丹参川芎嗪注射液(DS)为复方制剂,其组分为盐酸川芎嗪,对脑阻塞、脑血栓等脑血管疾病具有较好的效果〔4〕。研究表明,RS类药物联合丹参川芎嗪可以治疗脑缺血、心血管疾病,还可以降低血压等。UCP2-SIRT3信号通路是调控机体氧化应激和线粒体动力的一种途径,已经脑缺血/再灌注疾病中发挥功能〔5〕。本实验基于UCP2-SIRT3通路探讨RS联合DS对脑缺血/再灌注损伤的影响。
1 材料与方法
1.1材料
1.1.1药物 RS购自美国Sigma公司,批号:Y0001719。DS购自贵州拜特制药有限公司,批号:20210209,规格:每支5 ml。将DS稀释成原浓度的15%,配制成100 μmol/L〔1〕。
1.1.2细胞和试剂 人神经母细胞瘤细胞SH-SY5Y系(中国科学院上海细胞库);改良培养基(DMEM)培养基、磷酸盐缓冲液(FBS,美国Gibco公司);噻唑蓝(MTT)试剂盒(上海碧云天生物科技有限公司);酶联免疫吸附试验(ELISA)试剂盒(上海酶联免疫生物科技有限公司);JC-1染色液(七海复泰生物科技公司);放射免疫沉淀测定(RIPA)缓冲液、二喹啉甲酸(BCA)试剂盒(北京索莱宝生物科技有限公司);UCP2单抗、SIRT3单抗、TOMM20单抗、羊抗兔IgG二抗(武汉博士的生物科技有限公司);Trizol试剂(日本Takara公司)。
1.2方法
1.2.1构建氧糖剥夺/复氧(OGD/R)模型 SH-SY5Y细胞置于DMEM培养基中(不含FBS和抗生素),在37℃、5%CO2的细胞培养箱条件下,进行氧糖剥夺8 h,之后更换为含10% FBS和1%青链霉素的DMEM培养基,培养24 h,OGD/R模型建立成功。
1.2.2细胞培养和分组 常规培养的SH-SY5Y细胞作为Control组。构建OGD/R模型的细胞作为OGD/R组。采用低浓度(2.5 μmol/L)、高浓度(40 μmol/L)的RS处理OGD/R细胞,再分别添加DS,作为OGD/R+RS-L+DS、OGD/R+RS-H+DS组。将si-NC、si-UCP2转染至OGD/R细胞中,再用高浓度的RS和DS处理,作为OGD/R+si-NC组、OGD/R+si-NC+RS-L+DS组、OGD/R+si-NC+RS-H+DS组,OGD/R+si-UCP2组、OGD/R+si-UCP2+RS-L+DS组、OGD/R+si-UCP2+RS-H+DS组。
1.2.3MTT检测细胞增殖 将细胞接种于96孔板,每孔添加10 μl MTT溶液,37℃条件下培养4 h,离心后去除上清液,向每孔中添加100 μl二甲基亚砜(DMSO)溶液。分光光度计检测各孔450 nm的吸光度。将吸光度换算成细胞存活率。
1.2.4ELISA检测细胞中IL-6、IL-8、IL-10水平
根据ELISA试剂盒的说明书检测细胞中IL-6、IL-8、IL-10水平,实验步骤严格按照操作流程进行。
1.2.5共聚焦法观察UCP2、SIRT3和TOMM20分子表达和定位 用预冷的4%多聚甲醛固定各组细胞15 min,观察细胞形态。在细胞中滴加正常山羊血清,室温封闭1 h。吸弃血清,加入稀释的一抗(1:1 000),4℃孵育过夜;加入稀释的二抗(1∶2 000),室温避光孵育2 h。用4,6-二氨基-2-苯基吲哚(DAPI)染色8 min,滴加50%甘油,共聚焦荧光拍照。
1.2.6建立UCP2沉默细胞系 SH-SY5Y细胞在含10% FBS和1%青链霉素的DMEM培养基中培养。将si-UCP2-673、si-UCP2-853、si-UCP2-1235和阴性对照si-NC分别转染至SH-SY5Y细胞中,检测基因和蛋白表达水平,筛选沉默效果最好的UCP2用于后续研究。
1.2.7Western印迹检测细胞中UCP2蛋白表达 收集各组细胞,加入RIPA裂解液提取细胞总蛋白,采用BCA法测定蛋白浓度,应用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白,将分离的蛋白凝胶转移至聚偏氟乙烯(PVDF)膜,封闭2 h,室温孵育一抗稀释液(UCP2稀释比1∶1 000),4℃孵育过夜,TBST洗涤,孵育二抗稀释液(稀释比1∶2 000),室温孵育1 h,TBST洗涤,滴加ECL显影,应用ImageJ软件分析各条带灰度值。
1.2.8qRT-PCR检测细胞中UCP2 mRNA和PGC1、Drp1、Opa1 mRNA表达 采用Trizol法提各组细胞中总RNA,应用Nanodrop2000c超微量分光光度计检测RNA浓度。反转录将总RNA反转录为cDNA。反应条件:25℃ 10 min,37℃ 60 min,95℃ 5 min,4℃保存。反转录体系:RNA 2 μl,10×RT缓冲液2 μl,dNTP 0.4 μl,Multiscripe RT 1 μl,10×Random Primer 2 μl,RNase-Free ddH2O补足体系至20 μl。以cDNA为模板进行qRT-PCR扩增,反应体系:SYBR Green Master Mix 10 μl,正反向引物0.8 μl,cDNA 1 μl,RNase-Free ddH2O补足体系至20 μl;反应条件:95℃ 2 min,95℃ 15 s,60℃ 30 s,72℃ 30 s,共循环40次。UCP2:上游引物5′-TAGACGTGGTCAAGACGAGATA-3′,下游5′-AGGGCATGAA CCCTTTGTAG-3′。PGC1:上游引物5′-CCAAACCAACAACTTTATCTCTTCC-3′,下游5′-CACACTTAAGGTGCGTTCAATAGTC-3′;Drp1:上游引物 5′-CACCCGGAGACCTCTCATTC-3′,下游5′-CCCCATTCTTCTGCTTCCAC-3′;Opa1:上游引物5′-GTGCTGCCCGCCTAGAAA-3′,下游5′-TGACAGGCACCCGTACTCAGT-3′; GADPH:上游引物5′-AGGTTGTCTCCTGCGACTTC-3′,下游5′-CTTGCTCAGTGTCCTTGCTG-3′。以GADPH为内参。采用2-ΔΔCt法计算基因相对表达量。
1.3统计学处理 采用SPSS21.0软件进行t检验,方差分析。
2 结 果
2.1RS联合DS对脑OGD/R细胞增殖的影响 与Control组〔(100.00±10.92)%〕相比,OGD/R组细胞存活率显著降低〔(41.40±4.33)%,P<0.05〕;与OGD/R组相比,OGD/R+RS-L+DS组、OGD/R+RS-H+DS组细胞存活率显著升高〔(78.94±9.11)%、(86.49±7.37)%,P<0.05〕。
2.2RS联合DS对脑OGD/R细胞炎性因子水平的影响 与Control组相比,OGD/R组细胞IL-6、IL-8、IL-10水平显著升高(P<0.05);与OGD/R组相比,OGD/R+RS-L+DS组、OGD/R+RS-H+DS组细胞IL-6、IL-8、IL-10水平显著降低(P<0.05)。见表1。

表1 RS联合DS对脑OGD/R细胞炎性因子水平的影响
2.3建立UCP2沉默细胞系 与NC组相比,si-NC组UCP2 mRNA和蛋白表达水平及浓度无显著变化(P>0.05),si-UCP2-673组、si-UCP2-1235组UCP2 mRNA和蛋白表达水平及浓度显著降低(P<0.05);与NC组、si-NC组比较,si-UCP2-853组UCP2 mRNA和蛋白表达水平及浓度极显著降低(P<0.05)。所以,采取UCP2-853进行后续实验。见表2,图1。
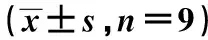
表2 建立UCP2 沉默细胞系
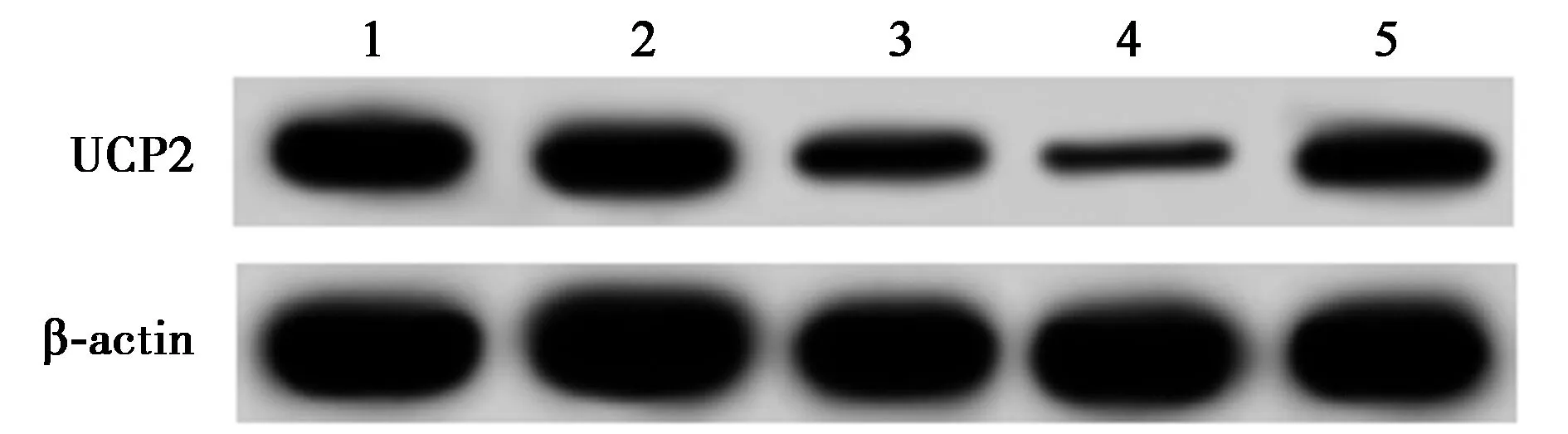
1~5:NC组、si-NC组、si-UCP2-673组、si-UCP2-853组、si-UCP2-1235组图1 各组UCP2蛋白表达
2.4RS联合DS对脑OGD/R细胞UCP2、SIRT3和TOMM20分子表达和定位的影响 与Control组相比,OGD/R组细胞UCP2、SIRT3免疫荧光明显减弱(P<0.05);与OGD/R组相比,RS联合DS显著增强细胞UCP2、SIRT3免疫荧光(P<0.05)。见表3。抑制UCP2表达前后,各组SIRT3表达水平无显著差异(P>0.05)。抑制UCP2表达前,与OGD/R-si-NC组比较,RS联合DS显著升高TOMM20表达水平(P<0.05);抑制UCP2后,各组TOMM20表达水平均显著降低(P<0.05)。见表3。
2.5RS联合DS对脑OGD/R细胞PGC1、Drp1、Opa1 mRNA表达的影响 与Control组相比,OGD/R组PGC1 mRNA表达水平显著升高,Drp1、Opa1 mRNA表达水平显著降低(P<0.05)。与OGD/R组相比,OGD/R+RS-L+DS组、OGD/R+RS-H+DS组PGC1 mRNA表达水平显著降低,Drp1、Opa1 mRNA表达水平显著升高(P<0.05)。与OGD/R组或OGD/R+si-NC组相比,OGD/R+si-UCP2组PGC1 mRNA表达水平显著升高,Drp1、Opa1 mRNA表达水平显著降低(P<0.05)。与OGD/R+RS-L+DS组或OGD/R+si-NC+RS-L+DS组相比,OGD/R+si-UCP2+RS-L+DS组PGC1 mRNA表达水平显著升高,Drp1、Opa1 mRNA表达水平显著降低(P<0.05);与OGD/R+RS-H+DS组或OGD/R+si-NC+RS-H+DS组相比,OGD/R+si-UCP2+RS-H+DS组PGC1 mRNA表达水平显著升高,Drp1、Opa1 mRNA表达水平显著降低(P<0.05)。见表3。
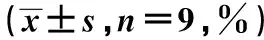
表3 RS联合DS对脑OGD/R细胞UCP2、SIRT3和TOMM20分子表达荧光强度、PGC1、Drp1、Opa1 mRNA表达的影响
3 讨 论
脑缺血/再灌注是大脑在长时间缺血缺氧情况下造成的组织不可逆损伤,减弱了增强线粒体功能,降低线粒体跨膜转运和能量代谢,抑制脑细胞存活〔7,8〕。RS治疗动脉粥样硬化性脑血管病的临床效果较好,安全性较高〔9〕。RS可以降低脑梗死患者血脂、炎症因子水平,临床价值显著,没有不良反应〔10〕。DS是由丹参提取液和盐酸川芎嗪组成的,DS下调了急性脑梗死患者血清hs-CRP、TNF-α、IL-6水平,改善了脑环境〔11〕。DS能有效减轻脑神经功能损伤,改善血液流变,治疗脑血栓〔12〕。有类似的研究报道,丹红注射液联合RS治疗不稳定型心绞痛〔13〕。复方丹参滴丸联合瑞舒伐他汀治疗冠心病合并的高脂血症〔14〕。已经有文献结果,RS通过UCP2-SIRT3信号调控降低脑脑缺血/再灌注对神经元的损伤,减低OGD/R细胞凋亡,提高细胞存活率,阻止OGD/R细胞膜电位下降〔15〕。RS通过调控UCP2-SIRT3通路减轻脑缺血/再灌注对神经元线粒体的损伤,增加OGD/R细胞中UCP2、SIRT3分子表达〔16〕。综上,RS联合DS通过调控UCP2-SIRT3通路减轻脑缺血/再灌注造成的损伤,为治疗该疾病提供理论基础。

