血清PDPK1水平与绝经后髋部骨折患者早期骨密度和骨转化标志物变化的关系*
张 岩,吴多艺,张志伟,叶宝飞
海南省中医院骨一科,海南海口 570000
绝经后女性发生的髋部骨折是常见的骨骼肌肉疾病,尽管针对髋部骨折的治疗方法有所改进,但是仍有10%左右的患者表现出骨修复不足,导致骨折延迟愈合或无法愈合[1]。骨折愈合是一个复杂的过程,潜在的细胞和分子机制仍然未知。骨折愈合的核心是骨重建过程,包括破骨细胞性骨吸收和成骨细胞性骨形成[2]。维持破骨细胞和成骨细胞活动之间的动态平衡对于骨修复是必要的[3]。3’-磷酸肌醇依赖性蛋白激酶1(PDPK1)是存在于破骨细胞中的一种丝氨酸/苏氨酸激酶和磷酸肌醇-3-激酶(PI3K)-蛋白激酶B(Akt)信号级联的关键调节因子,其特异性缺失会抑制核因子-κB受体活化因子配体(RANKL)诱导的破骨细胞形成和骨吸收[4-5]。鉴于破骨细胞在骨折修复中的重要性,笔者推测破骨细胞中PDPK1的表达缺失将改变骨折的愈合过程。本研究旨在分析血清PDPK1水平与绝经后髋部骨折患者骨质丢失、骨转化标志物血清Ⅰ型前胶原氨基端原肽(PINP)和Ⅰ型胶原蛋白的β-异构化羧基端肽(β-CTX)之间的关系,进而探讨血清PDPK1作为监测药物或康复运动干预后骨折愈合效果指标的可能性。
1 资料与方法
1.1一般资料 本研究为一项针对55岁以上绝经后骨质疏松性髋部骨折患者的纵向病例对照研究,已获得本院医学伦理委员会的批准。从2017年1月至2020年6月连续调查了261例因轻微创伤性髋部骨折就诊的绝经后女性患者(骨折组),年龄55~89岁,绝经超过1年。轻微创伤被定义为髋关节受到的机械冲击相当于或小于从站立高度坠落[6]。所有患者均签署了书面知情同意书。排除标准为病理性骨折或高能创伤性骨折。对于骨折延迟愈合病例,暂不纳入本研究。在随访过程中,57例患者个人原因或不明原因失访,21例骨折延迟愈合,53例在随访期间因合并脑梗死、冠心病、糖尿病等服用其他可能影响待测指标或骨代谢的药物,1例患者诊断出恶性肿瘤,1例患者死亡,最终128例患者完成了为期1年的随访。另选取106例年龄匹配、无低能创伤性骨折(现有证据或疾病史)、无脑卒中病史的于本院进行体检的绝经女性作为对照组。两组研究对象均排除了可能影响骨代谢的疾病,如转移性骨癌、原发性甲状旁腺功能亢进、甲状腺功能亢进、多发性骨髓瘤、骨软化症、肾功能不全。
1.2方法
1.2.1标本采集及资料收集 骨折组患者分别于骨折后2、4、7、10、14、30、365 d时(以2 d为基线)采集血液标本。对照组研究对象在体检当天采集血液标本。两组均空腹采集静脉血标本,立即离心,并在-80 ℃保存,之后进行ELISA。PINP(骨形成标记物)和β-CTX(骨吸收标记物)通过Cobas 6000型全自动电化学发光系统(德国罗氏诊断公司)进行检测。PDPK1使用ELISA试剂盒(中国武汉USCN Life Science公司)测定。按说明书分析100 μL的等分标本。收集两组人口学、人体测量学,以及相关临床合并症、并发症、实验室数据。
1.2.2骨密度(BMD)测量[7]骨折组患者于骨折后1周内测量BMD。采用DXA型双能X线骨密度仪(美国GE Lunar公司)测量腰椎(L2-L4)和股骨颈的BMD(在未受骨折影响的一侧测量BMD)。BMD分析仪间和分析仪内的变异系数<3%。在进行BMD扫描时,还测量了体质量和身高。
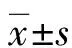
2 结 果
2.1两组一般资料比较 入组时,骨折组和对照组研究对象的一般资料见表1。两组年龄、TSM、体质量指数(BMI)、估算的肾小球滤过率(eGFR)、合并症发生情况比较,差异无统计学意义(P>0.05)。骨折组患者血清PDPK1水平高于对照组(P<0.05),而腰椎BMD和股骨颈BMD均低于对照组(P<0.05)。骨折组患者血清β-CTX和PINP水平高于对照组,但差异无统计学意义(P>0.05),见表1。
表1 两组一般资料比较[M(P25~P75)或或n(%)]
2.2骨折组患者血清PDPK1基线水平与BMD、骨转化标志物的关系 骨折组患者血清PDPK1基线水平与股骨颈BMD呈负相关(r=-0.529,P<0.05),而与β-CTX(r=0.403,P<0.05)和PINP(r=0.236,P<0.05)呈正相关。见表2。

表2 患者骨折的潜在危险因素与血清PDPK1水平之间的相关性
2.3多元线性回归分析 进一步校正年龄、TSM、BMI等混杂因素后,经多元线性回归分析发现,血清PDPK1(β=-0.390,t=-2.302,P=0.004)和β-CTX(β=-0.503,t=-2.879,P=0.001)基线水平是影响股骨颈BMD的独立危险因素。此外血清β-CTX基线水平也是影响腰椎BMD的独立危险因素(β=-0.366,t=-2.040,P=0.012)。
2.4骨折患者血清PDPK1水平动态监测 128例(49.04%)患者随访1年以上,其余133例患者失访或被排除。在骨折后7 d时,患者血清PDPK1水平达到峰值,随后逐渐下降。经重复测量方差分析,骨折患者血清PDPK1水平随时间变化趋势的差异有统计学意义(F=8.351,P<0.05)。在骨折后4、7、10、14、30 d时观测到PDPK1水平显著高于基线值(P<0.05),在365 d时血清PDPK1水平较基线值略有升高,但差异无统计学意义(P>0.05)。此外,1年随访期间,骨折患者血清β-CTX、PINP水平亦出现短暂升高,分别在14 d和30 d时达到峰值,随后稳步下降(F=4.790、3.789,P<0.05)。见图1。
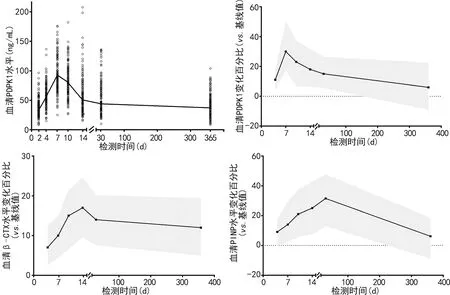
注:A为血清PDPK1水平变化趋势;B为不同时间点血清PDPK1水平较基线值的变化百分比;C为不同时间点血清β-CTX水平较基线值的变化百分比;D为不同时间点血清PINP水平较基线值的变化百分比。
2.5骨折患者血清PDPK1水平动态变化与β-CTX、PINP变化的关系 经Pearson相关分析,骨折7 d时患者血清PDPK1水平变化百分比与β-CTX、PINP变化百分比呈正相关(r=0.396,P=0.002;r=0.180,P=0.033),但是在7 d后未观察到血清PDPK1水平变化百分比与PINP变化百分比之间的关系。在整个研究期间,血清PDPK1水平变化百分比与β-CTX变化百分比均呈正相关(r=0.293,P=0.019)。
3 讨 论
本研究侧重于分析55岁以上绝经后骨质疏松性髋部骨折的患者和匹配的对照者血清PDK1水平的分布情况以及随访1年血清PDPK1水平的动态变化。结果显示,血清PDPK1水平升高与股骨颈BMD降低有关,在愈合阶段随着骨形成标志物PINP和骨吸收标志物β-CTX水平持续增加,PDPK1水平亦同步升高。这表明骨形成和骨吸收之间的相对不平衡与骨质疏松性髋部骨折患者高PDPK1水平有关,反映了愈合过程中早期骨膜内骨化形成[2]。
骨折愈合是一个复杂的骨质再生过程[8],可分为早期炎性反应期、软骨内成骨和硬性骨痂形成中期、骨重建晚期3种相互重叠的生物学阶段,而各个阶段有不同类型细胞发挥作用[9-14],破骨细胞介导的骨/软骨吸收和成骨细胞介导的骨形成过程对于骨折修复的速度和质量有重要影响。骨形成标志物反映了骨形成细胞(主要是成骨细胞)的酶活性,它们是骨形成过程中基质成分分解时释放的多余产物,其中PINP是较敏感的骨形成标志物之一[12]。骨吸收标志物,如β-CTX是骨组织沉积的产物[13]。有研究已经证实,PINP和β-CTX能够反映成骨细胞和破骨细胞的活性,且其变化早于BMD[14]。因此,血清PINP和β-CTX水平在一定程度上反映了骨质疏松性骨折患者的愈合速度[15]。本研究发现,患者在愈合阶段,血清PINP、β-CTX、PDPK1水平同步升高。尤其是在骨折后第1周持续增加,并且在随访1年内仍保持高水平,这表明PDPK1的释放不仅取决于髋部骨折本身,可能还与是否存在骨质疏松或骨折愈合过程有关。
XIAO等[5]证实PDPK1是机械因素影响骨密度和骨再生的重要介质。作为一种新的骨质疏松性骨折调节因子,PDPK1可能反映骨膜细胞代谢活动对骨折的影响,从而使骨修复处于稳定状态。此外,笔者还观察到髋部骨折后PDPK1水平上调,在第7天达到峰值,然后在1年内恢复到接近基线水平。这些结果表明在祖细胞募集至骨痂期间以及骨骼发育和重塑的早期阶段,PDPK1参与骨折的早期修复。PDPK1在骨折患者血清中的水平变化使其有望成为评估预后和监测治疗效果的重要生物标志物。
本研究多元线性回归分析结果表明,PDPK1基线水平是影响股骨颈BMD的独立危险因素,而非影响腰椎BMD的危险因素。其可能的解释为PDPK1主要表达于骨膜中,而骨膜主要覆盖长骨[16-17]。在笔者看来,骨膜是贴在骨表面的结缔组织膜,在一定程度上补偿了绝经后骨皮质内骨丢失。随着骨丢失的进展,骨皮质变得更薄,而由于微结构不良,机械应力增加,导致PDPK1表达代偿性增加[18]。因此,可以假设PDPK1合成量也可能随着绝经后女性骨质疏松性髋部骨折的发生而增加。这些研究结果表明,PDPK1可能是诊断骨质疏松性骨折的较好的生物标志物,特别是髋关节[19]。然而目前的研究也有一些局限性,例如骨折后的用药情况、骨折愈合评估、骨折固定后的体力活动和康复训练量未被考虑。
综上所述,髋部骨折患者在基线和愈合早期具有更高的血清PDPK1水平。血清PDPK1水平能反映骨丢失及骨折愈合进展情况,但在发生急性骨折和并发症的情况下,分析时需要更加谨慎。

