小麦全蚀病拮抗细菌Z0-j的鉴定及其生防潜力评估
李正鹏, 苏皖平, 杨 威, 宋虎卫, 顾大路, 刘廷武, 罗玉明
(1.江苏省环洪泽湖生态农业生物技术重点实验室/淮阴师范学院生命科学学院,江苏淮安 223300;2.江苏徐淮地区淮阴农业科学研究所,江苏淮安 223001)
由禾顶囊壳小麦变种(var.)引起的小麦全蚀病,是世界上最重要的小麦根部病害,因其突出的土壤传播特性,一直是小麦亟待解决的防治难题。该病在我国安徽省、山东省和河南省等栽培地区广泛发生,目前主要采取化学药剂拌种的方法进行防治,而化学防治易引起环境污染及产生抗药性。随着人们环保、绿色意识的增强,利用微生物防控全蚀病已成为一条行之有效的新途径。假单胞菌是广泛存在于植物根际的一类微生物,常常具备显著防治植物病害、促进植物生长的作用。其生防机制包括产生拮抗物质和铁载体或水解酶、营养竞争、生物膜的快速形成以及诱导植物抗性等。因此,本研究在前期构建的微生物资源库基础上,以禾顶囊壳小麦变种为靶标菌,鉴定全蚀病生防菌株Z0-j,并对其拮抗效果和代谢产物稳定性进行评估,为进一步开发利用奠定理论依据和技术支持。
1 材料与方法
1.1 试验材料
供试病原真菌为禾顶囊壳小麦变种,由黑龙江八一农垦大学柯希望副教授惠赠。
供试生防细菌Z0-j,2017年11月筛选自江苏省环洪泽湖生态农业生物技术重点实验室有益微生物资源库,编号L031,保存于-80 ℃冰箱。
1.2 试验方法
1.2.1 菌株活化 靶标菌:将斜面上保存的禾顶囊壳小麦变种扩繁于PDA培养基上,待菌落直径长至培养皿的一半时,待用。
菌株Z0-j发酵液制备:按照前期研究结果,将直径7 mm的菌饼接种到种子发酵培养液(250 mL 三角瓶,发酵培养基装瓶量为50 mL)中,于28 ℃、150 r/min摇床上培养2 d后,以12.8%的接种量、装料量100 mL/250 mL,接入NA发酵培养液中进行二次发酵,于25 ℃、120 r/min摇床上培养2 d,即为发酵液原液。将发酵液原液在10 000 r/min、4 ℃下离心15 min,上清液经0. 22 μm无菌滤膜过滤,即为无菌发酵滤液,保存于4 ℃冰箱备用。
1.2.2 16S rDNA鉴定 采用细菌基因组试剂盒提取基因组DNA,用细菌通用引物27F (5′-A G A G T T T G A T C M T G G C T C A G-3′)和1492R (5′-G G T T A C C T T G T T A C G A C T T-3′) 进行16S rDNA的PCR扩增。扩增条件:94 ℃预变性5 min;94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸1.5 min,共30次循环;最后 72 ℃ 延伸10 min。所得PCR产物送生工生物工程(上海)股份有限公司测序。测序后的序列,利用 Genbank 中的 BLAST 软件对获得的 16S rDNA 序列进行同源性分析,再通过 MegaX 软件构建系统进化树。
1.2.3 菌株Z0-j抑菌效果测定 采用菌丝体干质量法测定菌株Z0-j对小麦全蚀病菌的抑菌效果。将生长72 h的靶标菌菌饼(直径7 mm),移至PD培养液中,再将不同体积的生防菌Z0-j发酵液原液和上清液加入摇瓶中,设置无菌水作为对照,每个处理重复3次,于25 ℃、110 r/min条件下培养,4 d后取菌丝于30 ℃条件下烘干,测定菌丝干质量,并计算抑制效果。
1.2.4 菌株Z0-j抑菌效果的显微观察 利用皿内对峙法,取受抑制后的靶标菌菌落边缘菌丝,利用光学显微镜进行形态学观察,并以照片记录受抑制菌丝形态变化。
1.2.5 菌株Z0-j对靶标菌菌丝膜通透性的影响 采用电导率法进行测定,参考郅晓燕等的方法,稍作改动。将靶标菌菌饼接种于PD液体培养基中,于25 ℃、110 r/min振荡培养3 d后,将菌丝用蒸馏水冲洗3次,去除菌丝表面培养基及水分;分别称取0.1 g菌丝体,加入到设置不同浓度菌株 Z0-j 发酵液的水溶液中,以蒸馏水作为空白对照。在20 ℃条件下分别测定0、0.5、1、2、4 h时处理和对照溶液的电导率,重复3次。根据公式计算溶液电导率的增幅。
电导率增幅=(不同时刻电导率-初始电导率)/初始电导率×100%。
1.2.6 代谢产物稳定性分析 温度影响:无菌发酵液置于恒温水浴锅中处理30 min,梯度为40、60、80、100 ℃,采用皿内对峙法测定其抑菌效果。
pH值影响:用1 mol/L HCl、1 mol/L NaOH调节发酵上清液pH值分别为4、6、7、8、10、12,处理后放入 4 ℃冰箱中放置48 h,采用皿内对峙法测定其抑菌效果。
紫外线影响:100 W紫外灯下处理无菌发酵滤液0~1 h,梯度间隔为10 min,距离为60 cm,再采用皿内对峙法测定其抑菌效果。
超声波影响:利用100 W超声波分别处理无菌发酵上清液20、30、40、60 min,采用皿内对峙法测定其抑菌效果。
蛋白酶K影响:吸取1 mL无菌发酵上清液于1.5 mL离心管中,向管内加入浓度不同的蛋白酶K,使其终浓度分别达到2、20、100 g/mL,37 ℃下水浴2 h后,采用皿内对峙法测定其抑菌效果。
2 结果与分析
2.1 菌株Z0-j分子鉴定
将拮抗菌Z0-j测序获得的16S rDNA序列在Genbank数据库中进行同源性比对,挑选与之高度同源的序列,然后利用MegaX软件,利用邻接法(neighor-joining)构建系统发育树(图1)。可以看出,生防菌Z0-j与铜绿假单胞菌() RTE4在同一分支,同源性最高。再结合前期形态学特征与生理生化特征,最终鉴定为铜绿假单胞菌。

2.2 抑菌效果测定
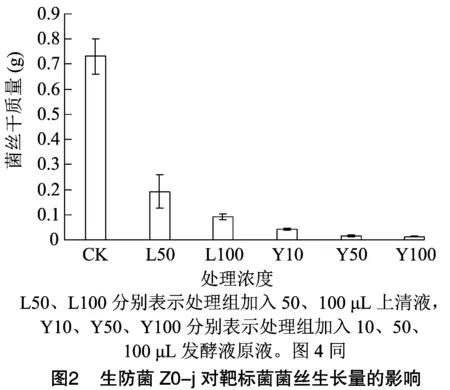
菌株Z0-j对小麦全蚀菌()菌丝生长抑制72 h后,进行菌丝干质量测定。从图2可以看出,处理组L50、L100的菌丝干质量与CK存在显著差异(<0.05),抑菌效果分别为73.3%、87.4%,且干质量平均值呈下降趋势;处理Y10、Y50、Y100的菌丝干质量与CK存在显著差异,抑菌效果均在94%以上,且干质量平均值也呈下降趋势。由此可见,发酵液中活性物质能够显著抑制菌丝的生长,且活性物质含量越高,拮抗效果越好。
2.3 菌株Z0-j对靶标菌抑制显微观察
显微观察结果(图3)表明,对照菌丝光滑、纤细、粗细均匀、向前生长;而经生防菌Z0-j处理 72 h 后,靶标菌菌丝多数呈现畸形、粗细不一、顶端膨大、旋转扭结;部分菌丝明显出现溶解、断裂、原生质外渗且透明等杂乱现象。

2.4 菌株Z0-j对靶标菌菌丝膜通透性的影响
由图4可知,随着处理时间的增加,对照组和处理组溶液的电导率持续增大,处理组电导率增幅明显高于对照组,且随着发酵液活性物质浓度增多,处理组溶液电导率增幅也呈增大趋势。当添加 100 μL 发酵上清液时,处理后溶液的电导率平均增幅在120 min时为18.25%,当添加100 μL发酵原液时,处理后溶液的电导率平均增幅在120 min时为21.14%。由此可知,菌株Z0-j可以破坏靶标菌菌丝完整性,和显微观察结果一致。
2.5 不同外界因素对代谢产物稳定性的影响
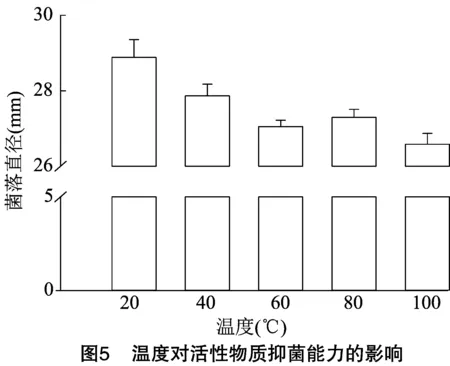
2.5.1 温度对活性物质稳定性的影响 用平板对峙法测量20(CK)、40、60、80、100 ℃与室温下的活性物质抑菌效果,结果显示,发酵滤液的抑菌圈直径总体呈缩小趋势。CK与其他温度处理相比差异显著;高于40 ℃处理的抑菌圈直径显著缩小;但在100 ℃条件下活性物质仍有较强抑菌活性,抑菌圈直径达到26.58 mm,说明活性物质在高温处理下比较稳定(图5)。

2.5.2 pH值对活性物质的影响 用平板对峙法测量生防菌Z0-j活性物质在pH值为4、6、7(CK)、8、10、12时的抑菌活性,发现随着pH值变化,活性物质的抑菌作用在酸性条件下差异不显著,在碱性条件下显著下降,但仍表现出较强的抑菌活性,表明菌株Z0-j可能含有多种活性物质,保证抑菌能力对不同pH值条件的稳定性(图6)。
2.5.3 紫外线对活性物质的影响 由图7可知,经不同时间(10、20、30、40、50、60 min)紫外线处理后,Z0-j发酵滤液的抑菌作用出现了显著差异。未经紫外线照射处理的发酵滤液的抑菌作用最大,抑菌圈直径为29.76 mm,紫外线照射处理后,抑菌圈直径有所缩小,但从照射时长在20 min以上后,仍保持有27.82 mm的抑菌圈直径,且各处理间没有显著差异。说明发酵液活性性物在紫外线条件下抑菌作用比较稳定。


2.5.4 超声波对活性物质的影响 由图8可知,随着超声波处理时间(20、30、40、60 min)的延长,未经处理的发酵滤液抑菌圈直径为29.03 mm,处理的抑菌圈对比对照显著缩小,但至少仍有27.62 mm的直径,且各个处理间无显著差异。说明该活性物质对超声波有较好的耐受性。

2.5.5 蛋白酶对活性物质的影响 用平板对峙法测量了生防菌Z0-j活性物质经蛋白酶K处理后的抑菌圈直径,发现各处理的活性物质的抑菌圈直径逐渐减小,存在显著差异。蛋白酶K浓度为2 g/L处理时,抑菌效果与对照之间无显著差异:蛋白酶K浓度逐渐提高到20 、100 g/L时,抑菌能力显著降低,但抑菌圈直径仍有25.70 mm。由此可见,活性物质中可能含有某些酶类物质,但发酵液活性物质整体对蛋白酶K表现出良好的耐受性(图9)。

3 讨论与结论
小麦全蚀病是小麦生产过程中的重大病害,本研究鉴定和评估了内生细菌Z0-j及其对小麦全蚀病菌的生防潜力,证明了内生细菌Z0-j为铜绿假单胞菌(),对靶小麦全蚀病菌拮抗效果显著,能够引致靶标菌菌丝畸形、顶端膨大、原生质外渗、细胞膜透性增强,甚至菌丝死亡。同时,菌株Z0-j活性物质对温度、pH值、紫外光照、超声波以及蛋白酶等外界因素有良好的耐受性,表明内生细菌Z0-j是一株对小麦全蚀病具备良好开发潜力的生防菌株。
研究表明,活跃在植物根际的假单胞菌一方面产生活性物质或改善矿质营养直接促进植物生长,另一方面产生代谢物质或竞争作用抑制或阻碍病原微生物的侵染。假单胞菌产生的铁载体通过竞争病原菌的铁营养而占据优势生态位,拮抗物质如吩嗪酸(PCA)、硝吡咯菌素(Prn)、2,4-二乙酰滕黄酚(Ph1)、藤黄绿脓菌素(Plt)、环状脂多肽等通过抑制孢子萌发、裂解真菌菌丝等途径抑制病原真菌生长发育,多种低分子量挥发性有机化合物(VOCs)亦抑制菌丝生长、产孢、萌发等,水解酶如几丁质酶、蛋白酶和纤维素酶可以溶解真菌的细胞壁,甚至一些吩嗪类和VOCs物质还参与植物系统抗性的诱导。本研究中的生防假单胞菌Z0-j能够显著抑制靶标菌小麦全蚀菌()的生长,在不同影响因素条件下表现的抑制效果有所差异,证明活性物质中有多种抑菌物质,且包含一些能被蛋白酶K影响的酶类活性物质。
一直以来,生防假单胞菌被认为是一种有效、环保、可持续的化学杀菌剂替代品。然而,对于成千上万被报道的潜在生防资源而言,仅有极少数被开发应用,其主要原因就是野外条件下生物资源的稳定性不佳,进而影响其商业化程度。因此,生防菌活性物质的稳定性是其作为生防制剂、生物肥料、植物生长调节因子等发挥有效作用的关键因素。本研究中生防假单胞菌Z0-j发酵液中的活性物质在温度、pH值、紫外线、超声波、蛋白酶K等影响下,依然表现出良好的抑菌能力,显示出对外界环境的耐受性,说明该菌株是一株对小麦全蚀病有开发潜力的生防菌株。

