棘洪滩水库春季细菌多样性及影响因素
丁 宁 杨莹莹 仇志峰 宋志文#
(1.青岛理工大学环境与市政工程学院,山东 青岛266520;2.山东省调水工程运行维护中心,山东 青岛266111)
细菌是水体的重要组成部分,其群落结构组成与水环境因子相互影响、相互作用,并且在生物地球化学循环中发挥着重要作用,了解细菌群落的时空变化是预测和控制自然与工程系统中细菌功能的必要前提。饮用水系统中的细菌与水的自净能力密切相关,并可能对公共卫生安全产生影响[1]。细菌群落结构在一定程度上能够反映水质情况[2],如蓝细菌过度繁殖可能会引起“水华”[3],而黄杆菌属(Flavobacterium)能够分解有机物改善水质[4]。因此,探究饮用水水源地水体中细菌群落结构组成与环境因子的相关性对水环境保护与供水安全具有重要意义。
引黄济青工程是将黄河水引向青岛的跨流域调水工程,自2014年4月开始与南水北调东线联合运行,实现黄河水和长江水双水源调度。棘洪滩水库是引黄济青工程中唯一的调蓄水库,并且是亚洲最大的平原围坝型水库,为青岛市提供90%以上居民生活用水,是青岛市最重要的饮用水水源地。目前关于棘洪滩水库的研究主要集中在浮游生物群落动态[5]和氮磷营养盐[6]等方面,对细菌群落结构研究较少。相对于其他季节,春季棘洪滩水库水体理化因子变化明显,外源性氮营养盐增加,总磷浓度低[7-8],浮游植物优势类群演变复杂,部分进入休眠或死亡状态[9],微生物种类少,易受环境影响。因此分析春季棘洪滩水体细菌群落结构及影响因素更为重要。
本研究以棘洪滩水库为研究对象,对春季进水口和出水口断面进行采样,分析细菌群落的α多样性和β多样性变化,研究细菌群落在门和属水平的组成,探讨细菌群落结构与环境因子的相关性。
1 材料与方法
1.1 区域概况
棘洪滩水库位于青岛市城阳区(36°21′N,120°13′E),总面积为14 km2,设计水位高度14.2 m,围坝长14.3 km,总容量1.46亿m3。
1.2 样品的采集
在棘洪滩水库泵站前进水口和水库出水口设置采样点,见图1。采集水面以下0.5 m和5.0 m处水样各1 L,混合后代表该采样点的水样。采样时间为2021年3—5月每月25日10:00—12:00。每月采集进水口和出水口样品各1组,共计6组,分别标记为In-Mar(3月进水口)、Out-Mar(3月出水口)、In-Apr(4月进水口)、Out-Apr(4月出水口)、In-May(5月进水口)、Out-May(5月出水口)。使用灭菌聚甲基丙烯酸甲酯取样器采集水样,用灭菌聚四氟乙烯塑料瓶在1 h内运回实验室,通过0.22 μm混合纤维滤膜抽滤,滤膜用无菌离心管于-80 ℃保存。

图1 棘洪滩水库采样点位置示意图
1.3 环境因子测定
温度、pH、溶解氧(DO)分别使用温度计、pH计(HQ40d,美国哈希)和DO仪(HQ30d,美国哈希)现场直接测定。硝态氮采用紫外分光光度法测定;亚硝态氮采用N-(1-萘基)-乙二胺分光光度法测定;氨氮采用纳氏试剂分光光度法测定;总氮(TN)采用碱性过硫酸钾消解紫外分光光度法测定;总磷(TP)采用过硫酸钾消解钼锑抗比色法测定;硫酸盐采用铬酸钡光度法测定;化学需氧量(COD)采用重铬酸盐法测定[10]。所有理化指标均做3组平行。
1.4 细菌多样性分析
将滤膜送至上海某生物医药科技有限公司进行脱氧核糖核酸(DNA)提取及16S rRNA基因高通量测序,测序片段为16S rRNA基因的V3~V4段,引物序列为338F(5’-ACTCCTACGGGAGGCAGCAG-3’)和806R(5’-GGACTACHVGGGTWTCTAAT-3’),测序平台为Illumina MiSeq。
1.5 数据分析
通过美吉生物云平台对DNA测序数据进行优化处理,剔除嵌合体重复序列和没有重复的单序列,得到优质的样品序列后进行生物信息统计分析。将获得的优质序列以相似度97%进行归并和可操作分类单元(OTU)聚类,选取丰度最高的序列为该OTU的代表序列。通过美吉生物云平台计算种群丰富度指数(Chao1指数、ACE指数)和群落多样性指数(Shannon指数、Simpson指数)。对OTU进行组间差异性分析获得在门和属水平的细菌丰度和组成。主成分分析(PCA)和层次聚类分析均通过美吉生物云平台进行,冗余分析(RDA)采用软件Canoco 5.0进行。
2 结果与讨论
2.1 水质分析结果
进出口水质理化指标见表1。水体呈弱碱性,DO、COD、氨氮、TP均满足《地表水环境质量标准》(GB 3838—2002)Ⅰ类水要求,硫酸盐满足GB 3838—2002集中式生活饮用水补充标准。TN接近GB 3838—2002 Ⅴ类水限值,硝态氮满足《生活饮用水水源水质标准》(CJ 3020—93)要求。
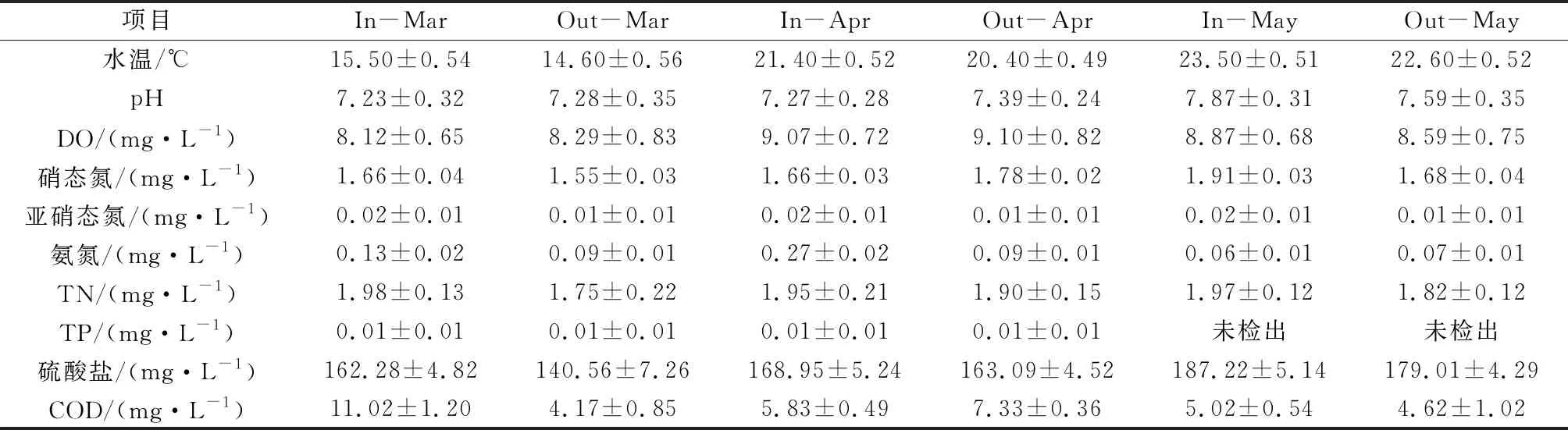
表1 水样的理化性质
3—5月为水库引水期,外源性氮磷营养盐增加,平均水温较低,浮游植物死亡或进入休眠状态,会降低硝态氮及TP消耗量,并且冬季水体湍流度小,水体中悬浮物减少,磷酸盐不易被吸附于悬浮物上[11],水体中硝态氮和TP含量较高。
2.2 样品的测序结果及细菌群落多样性分析
水样的测序结果见表2,6组水样中最高有效序列为39 523条,最低有效序列为34 495条,覆盖度为99.43%~99.66%,测序深度能基本反映样品的细菌群落组成。

表2 样品的测序结果及群落α多样性指数
6组水样共包含150个OTU,特有OTU数量分别为40(In-Mar)、28(Out-Mar)、72(In-Apr)、19(Out-Apr)、47(In-May)、77(Out-May)个。筛选掉丰度值低于测序总量0.001%的OTU,共分类出1 349个OTU,包含34个门、81个纲、199个目、323个科和524个属。
样品α多样性指数见表2,ACE指数和Chao1指数表现为In-Apr>Out-Apr>Out-May>In-May>In-Mar>Out-Mar,3月和4月细菌群落丰富度出水口低于进水口,5月呈现相反态势。总体表现为4月最高,3月最低。Shannon指数表现为Out-May>In-Apr>In-May>Out-Apr>Out-Mar>In-Mar,Simpson指数表现为Out-May β多样性用于分析不同样品间细菌群落结构的差异性,属水平的PCA结果见图2,PC1和PC2对细菌群落组成差异的解释度分别为54.16%和18.25%。在PC1维度上,同一月份进水口与出水口细菌群落组成相似度较高。在PC2维度上,In-Apr和Out-May细菌群落组成相似,In-Mar、Out-Mar、Out-Apr和In-May细菌群落组成相似。 图2 细菌群落PCA 层次聚类分析结果表明,In-Mar与Out-Mar、In-Apr与Out-Apr和In-May与Out-May的层次距离较小,即同一月份进水口与出水口细菌群落结构组成相似,不同月份之间细菌群落结构组成差异明显,与PCA结果基本一致。总体而言,3月进水口和出水口细菌群落结构相似性最高,4月进水口和出水口细菌群落结构相似性最低。 门水平细菌群落组成如图3所示,所有样品共检出34个门,6组样品分别为20(In-Mar)、25(Out-Mar)、30(In-Apr)、30(Out-Apr)、28(In-May)、27(Out-May)个菌门。其中放线菌门、变形菌门、拟杆菌门和蓝细菌门为优势菌门。放线菌门表现为In-Mar(39.84%) 图3 门水平结构组成 样品中共检出524个菌属,相对丰度较高的部分菌属见表3,其中In-Mar相对丰度最高的菌属为hgcI_clade、孢鱼菌科未知属、绿弯菌属;Out-Mar相对丰度最高的菌属为hgcI_clade、孢鱼菌科未知属、CL500-29_marine_group和多核杆菌属;In-Apr相对丰度最高的菌属为hgcI_clade、CL500-29_marine_group、绿弯菌属和蓝细菌属;Out-Apr相对丰度最高的菌属为hgcI_clade、CL500-29_marine_group、栖湖菌属和孢鱼菌科未知属;In-May相对丰度最高的菌属为hgcI_clade、CL500-29_marine_group和孢鱼菌科未知属;Out-May丰度最高的菌属为hgcI_clade、CL500-29_marine_group和栖湖菌属。 表3 属水平上细菌的相对丰度 利用Canoco 5.0软件,对相对丰度大于1%的优势菌属与pH、DO等10个环境因子进行RDA。优势菌属主要受DO和COD的影响,其中DO与黄杆菌属和绿弯菌属呈正相关,与hgcI_clade、CL500-29_marine_group、沉积物杆状菌属和红育菌属呈负相关;COD与CL500-29_marine_group、绿弯菌属、沉积物杆状菌属和分枝杆菌属呈正相关,与hgcI_clade和红育菌属呈负相关。 棘洪滩水库TN大于0.2 mg/L,TP在0.01 mg/L左右,TN是其富营养化的关键因素。外界氮磷营养盐的输入会促进浮游生物繁殖,导致水质变差[12]。黄河干流氨氮污染严重[13],引水可能是棘洪滩氮营养盐的主要输入源。棘洪滩水库TP输出依靠出水携带和底泥吸收,董国栋等[14]通过构建棘洪滩水库TP变化模型,发现在3—8月TP平均沉降速率为负值,证明春季磷主要来源于引水。 α多样性分析中,Chao1指数越大表示细菌群落丰富度越高,Shannon和Simpson指数越高代表微生物群落多样性和均一性越好。3月和4月出水口细菌群落丰富度均低于进水口,这与棘洪滩水库水流缓慢,细菌大量繁殖有关[15]。3月引水河道温度较低,导致进水口细菌多样性低于出水口[16],而Shannon指数最大值和Simpson指数最小值出现在Out-May,即5月出水口细菌多样性最高,可能与水库内部受人类影响较小有关。在属水平上,5月绿弯菌属和蓝细菌属相对丰度与3、4月有较大差异,绿弯菌属属于兼性厌氧菌,能够进行光合作用参与有机物的降解。而蓝细菌属相对丰度减少与5月COD浓度升高有关[17],也可能与蓝细菌属能够在缺氧环境利用亚硝酸盐作为电子受体进行厌氧生长有关[18]。 PARULEKAR等[19]通过对湖泊水体微生物群落结构组成分析,发现放线菌门、变形菌门、拟杆菌门和蓝细菌门是水体中优势度较大的菌门,与本研究结果基本一致。棘洪滩水库引水河道途径滨州、潍坊和青岛等农田地区,其菌门相对丰度可能受到农田影响。变形菌门和放线菌门是典型淡水菌[20],已有研究表明,变形菌门能够参与脱氮除磷过程,在有机物降解中也发挥着一定的作用[21]。Out-Mar、Out-Apr和Out-May与In-Mar、In-Apr和In-May相比TN含量较低,可能与蓝细菌门有固氮能力有关[22]。拟杆菌门在脱氮和有机物降解过程中起一定作用。李建柱等[23]等在对水体微生物群落研究中发现hgcI_clade、CL500-29_marine_group和绿弯菌属是水体的优势菌属,与本研究结果基本一致。hgcI_clade相对丰度随温度升高而明显增大,与水质变好以及其能够利用低浓度有机碳有关[24-25]。CL500-29_marine_group能够利用含碳有机物改善水质[26]。绿弯菌属属于兼性厌氧菌,可参与脱氮除磷过程[27]。此外,样品中还检测出黄杆菌属,可能与水库中鱼类活动有关。 RDA结果表明,DO和COD为影响细菌群落结构的主要环境因子,与WEI等[28]和ZHANG等[29]研究结果一致。其中CL500-29_marine_group和红育菌属均与亚硝态氮、TP呈负相关,红育菌属和CL500-29_marine_group均在氮循环过程中起到一定作用[30]。COD与CL500-29_marine_group呈正相关,可能与CL500-29_marine_group能够利用COD进行生长繁殖有关[31],hgcI_clade与TN呈负相关,可能与hgcI_clade能够利用含氮有机物进行异养有关[32]。DO与绿弯菌属呈正相关,这与绿弯菌属能在高DO的出水口脱氮和去除COD作用有关[33]。黄杆菌属与亚硝态氮呈负相关,黄杆菌属属于反硝化菌,在富营养的水体中能够将亚硝态氮最终转化为氮气。黄杆菌属与pH呈正相关,说明它更适应高pH环境。TP、TN与多核杆菌属呈正相关,说明多核杆菌属更适应高TP和TN环境[34]。 (1) 棘洪滩水库中氮磷营养盐主要来源于进水,α多样性表现为细菌群落丰富度4月进水口最高,3月出水口最低;细菌群落多样性5月出水口最高,3月进水口最低;β多样性表现为3月进水口和出水口细菌群落结构相似性最高,4月进水口和出水口细菌群落结构相似性最低。 (2) 门水平上,放线菌门占比最大,3月到5月拟杆菌门相对丰度均表现为进水口低于出水口,蓝细菌门相对丰度呈相反态势;属水平上,hgcI_clade相对丰度最高,其次是CL500-29_marine_group、绿弯菌属和孢鱼菌科未知属。 (3) DO、COD是影响棘洪滩水库细菌群落结构的主要环境因子。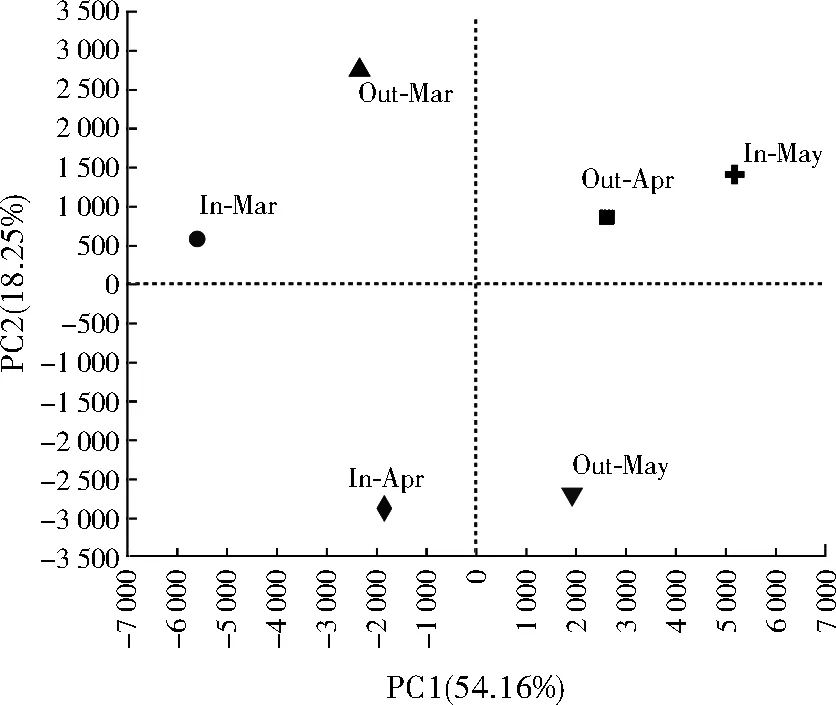
2.3 细菌群落结构


2.4 环境因子与细菌群落结构相关性分析
3 讨 论
4 结 论

