褪黑素壳聚糖微粒防止褪黑素降解并有效提高其抗旱功能
周 彬,于小晶*,张 民*,田虹雨,董晶晶,郭 蕾,张天骄
[1 山东农业大学资源与环境学院/土肥高效利用国家工程研究中心, 山东泰安 271018;2 山东农业大学经济管理学院(商学院), 山东泰安 271018]
小麦 (TriticumaestivumL.)是我国第二大粮食作物,其产量的高低直接影响人民生活水平和国家粮食安全。华北地区作为我国冬小麦重要产区之一,该区域水资源量仅占全国水资源总量的6%,人均水资源占有量大大低于全国平均水平[1–2]。干旱在冬小麦苗期出现频繁,且易导致小麦植株生理伤害,导致产量减少45%以上,严重威胁粮食安全[3]。干旱通过降低植物体内相对含水量、叶片水势,抑制细胞生长和增殖,引起光合色素含量下降,造成细胞损伤,严重时甚至会导致植物死亡[4]。为了减轻干旱胁迫对作物造成的损伤,可通过适量添加生物刺激素来诱导植物的分子和生理防御机制,达到促生保收的效果,这也成为保障我国粮食安全的重要途径之一[5]。
褪黑素又名N-乙酰-5-甲氧基色胺 (N-acetyl-5-methoxytryptamine),是一种动植物内源性抗氧化剂和自由基清除剂[6]。有研究表明,外源施加褪黑素是提高植物抗逆性的有效手段[7–8]。Sharma等[9]研究发现,褪黑素通过调控抗氧化防御的关键基因提高抗旱性。然而,由于褪黑素存在易氧化、光敏感等问题,导致外源添加褪黑素时需要在黑暗条件下高频次施用,这严重限制了褪黑素在农业上的推广应用[10]。
通过合理的封装技术控制褪黑素的释放是防止褪黑素失效,且实现其在农业中应用的有效手段[11]。传统农药封装技术主要是微胶囊技术,基于水相和油相互不相容,从而使得壁材能够在芯材表面凝聚形成微胶囊,保护芯材实现缓释提高利用率[12]。由于褪黑素直接作用于植物,且溶于乙醇等与水互溶的溶剂,其通过水油体系封装较为困难。壳聚糖(CS)是一种聚阳离子电解质多糖,具有生物相容性、可生物降解特性[13]。三聚磷酸钠(TPP)是一类水溶性线状聚磷酸盐。当CS与带相反电荷的TPP作用时,通过CS的氨基和TPP的磷酸基团之间的静电吸引作用从而产生微粒负载药品[14]。研究表明,壳聚糖/三聚磷酸钠微粒负载氟乐灵能够实现其缓释并减少环境毒性[14]。果胶是存在于植物细胞壁中的一种多糖,带负电荷且易被植物吸收。有研究表明,壳聚糖/三聚磷酸钠/果胶纳米粒子负载百草枯可以有效提升百草枯的活性,降低其光降解速率和提高其利用效率[15]。本研究尝试采用壳聚糖、果胶及三聚磷酸钠,开发具有缓释和抵御光降解能力的褪黑素壳聚糖微粒并进行表征评价。本研究的目的在于:1)明确褪黑素壳聚糖微粒的制备原理及形态特征;2)褪黑素壳聚糖微粒抵抗光降解能力的评价;3)施用褪黑素壳聚糖微粒对小麦苗期抗旱性的影响。这项技术能为功能物质提供一种低成本、高效的保活缓释手段,为功能物质在农业生产中大面积推广应用提供技术参考。
1 材料与方法
1.1 供试材料
壳聚糖(CS,脱乙酰度,90%~95%)、褪黑素(MT)、三聚磷酸钠(TPP)、果胶(≥74.0%)、乙酸、甲醇购自上海源叶生物科技有限公司;透析袋(3500 Da)购自北京瑞达恒辉科技发展有限公司;0.45 μm滤膜购自上海必泰生物科技有限公司;小麦(济麦22)购自山东登海种业股份有限公司。
供试基质来源于丹麦品氏托普公司,主要以优质泥炭藓为原料,基本理化性质为有机质434 g/kg、NO3–-N 296 mg/kg、NH4+-N 84.1 mg/kg、有效磷 99.2mg/kg、速效钾1169 mg/kg、最大持水量为66.67%。育苗采用梯形方盒,上口边长10 cm、高8 cm、底面边长 7 cm。
1.2 试验设计
1.2.1 褪黑素壳聚糖微粒的制备 微粒的制备方法(图1)在Rashidipour等[15]的离子凝胶化技术基础上进行了一些参数的优化和调整:称取0.1 g壳聚糖粉末,溶解在100 mL的0.2% (V/V)醋酸溶液中,磁力搅拌12 h至完全溶解。同时制备质量分数为0.1%的三聚磷酸钠水溶液和质量分数为0.08%的果胶溶液。为了去除不溶性或聚集的物质,三种溶液均通过0.45 μm的滤膜过滤。不含褪黑素壳聚糖微粒的制备:在磁力搅拌下缓慢的将5 mL TPP溶液和2 mL果胶溶液滴加到20 mL壳聚糖溶液中,60℃下搅拌30 min,在 4℃,10000 g 离心 20 min 后弃掉上清液,将沉淀冷冻干燥12 h,得到不含褪黑素的壳聚糖微粒(MP)。含褪黑素的壳聚糖微粒的制备:先将0.1、0.3、0.5、1.0 mL 的褪黑素甲醇溶液 (10 mg/mL)分别与20 mL壳聚糖溶液混合,再按照上述步骤添加5 mL TPP和2 mL果胶,制得褪黑素添加量为1、3、5、10 mg的褪黑素壳聚糖微粒。在4℃,10000 g离心20 min,后弃掉上清液,沉淀用蒸馏水洗涤3次,保证去除未负载的褪黑素。经12 h冷冻干燥后获得粉末样品,密封避光下储存。
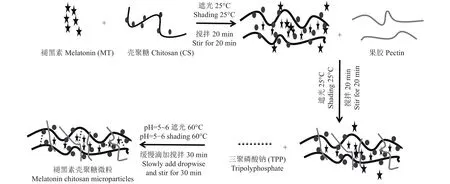
图1 褪黑素壳聚糖微粒制备原理示意图Fig.1 Schematic diagram of the preparation principle of melatonin chitosan microparticles
1.2.2 小麦干旱胁迫试验 供试品种为济麦22,所用基质以优质泥炭藓为主要原料,所用MP-MT为褪黑素添加量为5 mg的褪黑素壳聚糖微粒。试验采用基质培养方法,以基质最大持水量的80%为正常供水对照(CK1),40%为干旱胁迫对照(CK2),在干旱条件下,设施用1.0 g/L普通褪黑素溶液(MT1.0),壳聚糖微粒溶液(MP),以及含褪黑素0.5、1.0、1.5 g/L(MP-MT0.5、MP-MT1.0、MP-MT1.5,即每 1 L 溶液中添加5、10、15 g褪黑素壳聚糖微粒溶液制成) 共7个处理,各处理重复4次。选取颗粒饱满的小麦种子进行消毒灭菌处理(经75%乙醇浸泡30 s,20%的NaClO溶液浸泡15 min),用蒸馏水清洗干净,浸种催芽后选取萌发水平一致的种子,均匀点播于方盒中,每盆10粒,种子上部用0.5 cm厚蛭石覆盖,蛭石表面喷洒20 mL蒸馏水,在25℃下,14 h光照/10 h黑暗,光强6000 lx进行培养,称重法每天补充水分,培养至两叶一心后每盆保留5株健壮且生长水平一致的小麦幼苗。进行试验处理,每天使用称重法补充水分,连续处理8 天。干旱胁迫后第1天和第5天,分别用20 mL相应浓度的褪黑素壳聚糖水溶液进行灌根,对照处理以等量蒸馏水浇灌,第8天收获。
1.3 测定项目与方法
1.3.1 包封率测试 将制备完成的微粒悬浮液放入50 mL 离心管中,以 10000 g,4℃ 离心 20 min。取上清液,测量未包覆的褪黑素。通过超高效液相色谱测量残留在滤液中的褪黑素量间接计算包封率。将未负载褪黑素的壳聚糖微粒滤液作为空白对照。以含有已知浓度的褪黑素溶液做校准曲线。
包封率 (%) =100×(1–残留褪黑素量/褪黑素总量)[15]
1.3.2 形态观察 为了观察褪黑素壳聚糖微粒个体形貌,减少冷冻干燥对微观形貌的影响,对褪黑素壳聚糖悬浮液滴进行SEM扫描。将褪黑素壳聚糖微粒悬浮液滴加到硅片并在室温下干燥,进行喷金处理,然后使用扫描电子显微镜(SEM)进行形态观察。仪器采用日本日立公司的SU8020型扫描电子显微镜。
1.3.3 红外光谱测试 将褪黑素壳聚糖微粒、褪黑素、壳聚糖、三聚磷酸钠、果胶分别同溴化钾粉末混合压片,将制好的薄片置于傅里叶红外光光谱仪中测定红外光谱。仪器采用美国Nicolet公司的Nexus型红外光谱仪,扫描次数为32,分辨率为2 cm–1,扫描范围为 4000~400 cm–1。
1.3.4 缓释性能测试和释放动力学分析 褪黑素壳聚糖微粒在不同pH条件下的释放行为测试:将10 mg褪黑素壳聚糖微粒和空白壳聚糖微粒放置在3500 Da透析袋中,分别放置于pH 5.0和pH 7.0的100 mL磷酸缓冲溶液中。室温下,以预定时间2、4、6、8、10、12、24、36 h 为时间点间隔取 1 mL 样品。使用超高效液相色谱仪分析所收集样品中褪黑素的量。每个样品3次重复。
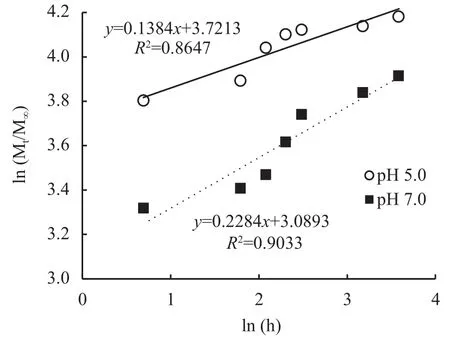
Ritger-Peppas模型[16]现在常被用于描述骨架片的药物释放规律,数学表达式如下:
Mt/M∞=−ktn
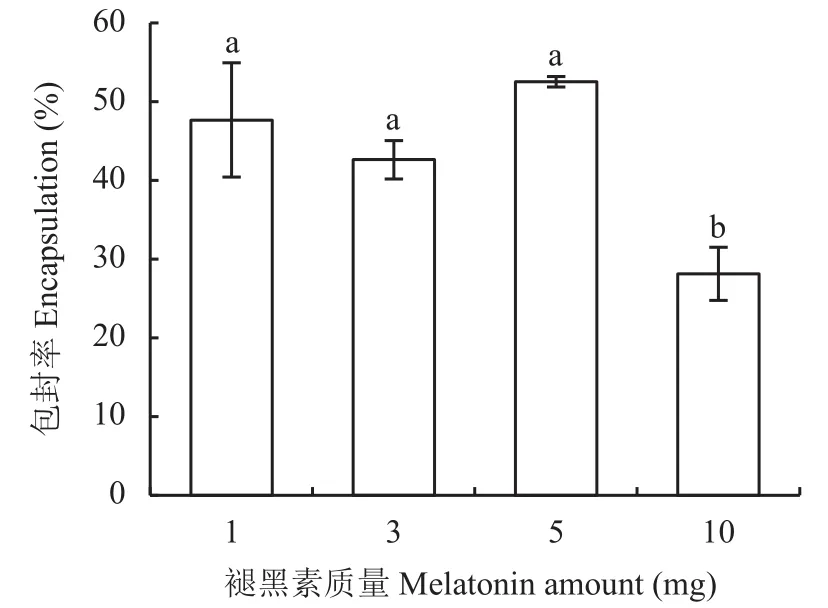
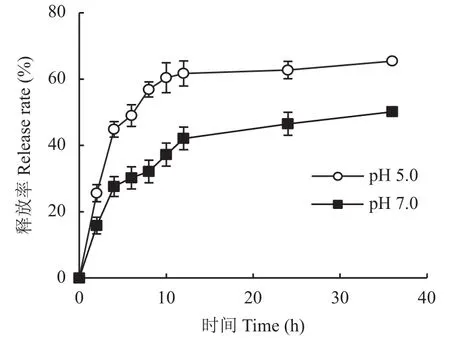
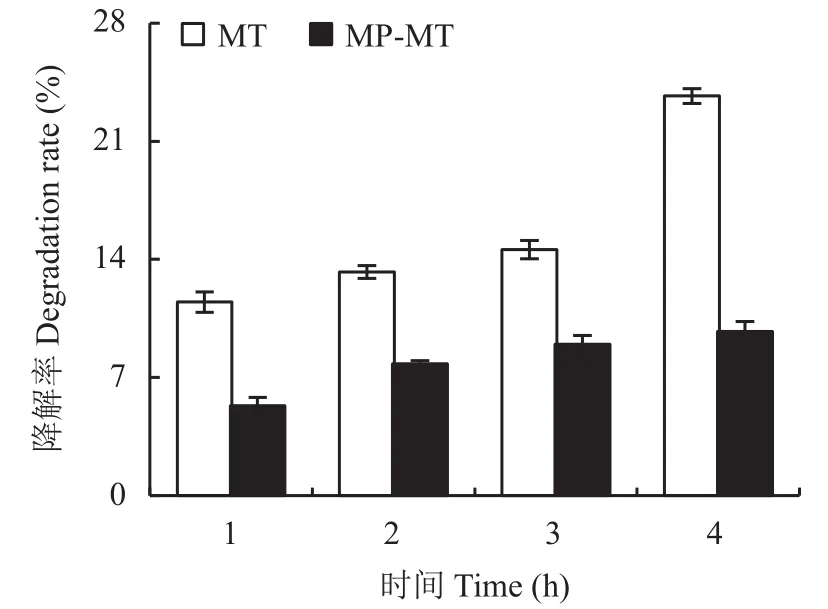
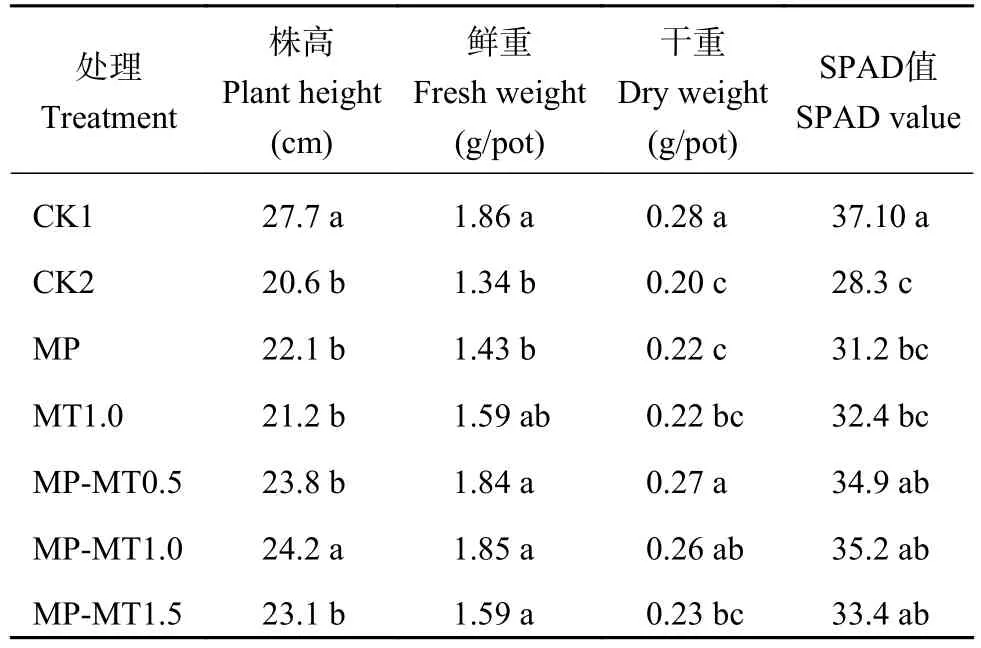
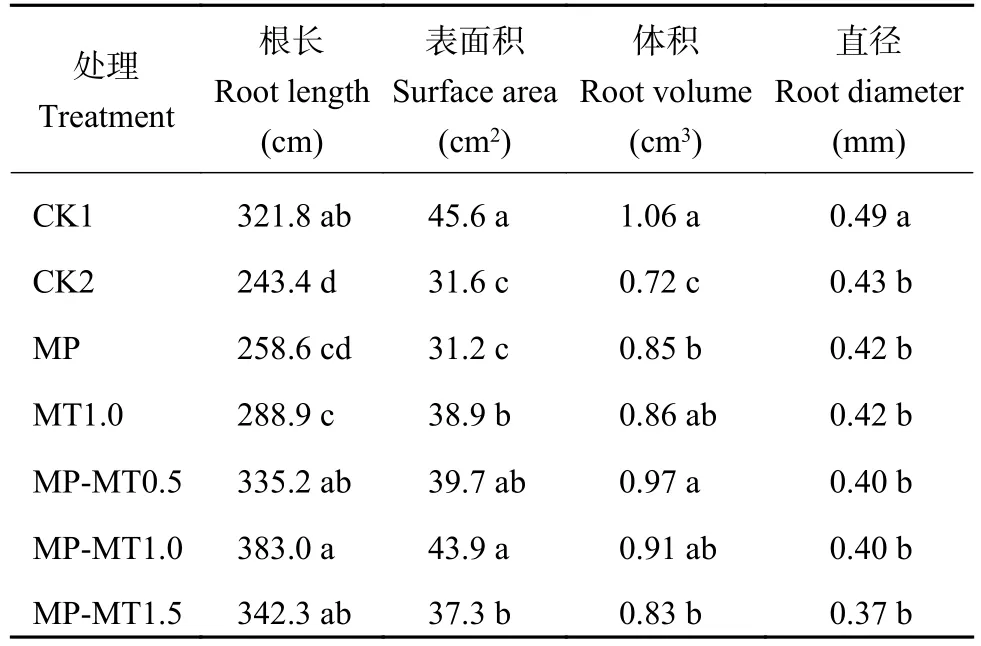
式中:Mt为微粒释放出来的褪黑素质量,M∞为微粒中褪黑素的总质量,Mt/M∞是药物累积释放率,k是释药速率常数,t为释放时间,n是扩散释放指数。当n≤0.43时,药物以Fick扩散(浓度梯度越大,扩散通量越大)为主;当0.43 1.3.5 光降解率测试 褪黑素壳聚糖微粒和褪黑素纯物质换算成10 mg/L的浓度添加到水溶液中。用4 W的LED灯管模拟可见光照射溶液,溶液与灯之间的距离为50 cm,分别在照射 1、2、3、4 h的时间间隔破坏性取样。之后将10 mL溶液加入离心管中,并以10000 ×g的离心力,4℃下离心20 min。测定上清液中褪黑素浓度。每个样品重复3次。 1.3.6 小麦幼苗生理指标测定 分别测定每个处理小麦幼苗株高、鲜重、干重、SPAD、根系长度、根表面积、根体积、根直径、抗氧化酶(超氧化物歧化酶、过氧化物酶、过氧化氢酶)活性和丙二醛含量。植株叶片 SPAD 值采用日本Minolta公司生产的SPAD-502叶绿素仪测定;采用万深LA-S根系扫描仪进行根系扫描,测量根系长度、根表面积、根体积、根直径。抗氧化酶活性的测定:取小麦幼苗叶片样品加入磷酸缓冲液冰浴研磨,低温离心后取上清液进行酶活性测定;超氧化物歧化酶(superoxide dismutase, SOD)活性测定采用氮蓝四唑(nitro-blue tetrazolium, NBT)法;过氧化物酶(peroxidase,POD)活性测定采用愈创木酚法;过氧化氢酶(catalase, CAT)活性测定采用紫外吸收法[17]。丙二醛(malondialdehyde, MDA)含量测定采用硫代巴比妥酸法[17]。 ANOVA方差分析及 Duncan 差异显著性检验通过Excel 2016和IBM SPSS软件完成;采用Excel 2016软件进行作图。 经过前期试验研究,CS、果胶、TPP浓度分别为0.1%、0.08%和0.1%,添加量分别为20、2和5 mL的条件下制备的褪黑素壳聚微粒的包封率是最佳的。在最适配比条件下分别测定了投入质量为1、3、5、10 mg褪黑素的包封率。褪黑素添加量在1、3和5 mg时包封率并无显著差异,添加量为10 mg时包封率显著降低。其中褪黑素添加量为1 mg时包封率不稳定,在21.8%~67.4%波动较大。投入褪黑素质量为5 mg时制备的褪黑素壳聚糖微粒(MP-MT)包封率最高且较为稳定(图2),平均包封率达52.14%,因此随后试验所用微粒均采用该比例进行制备。 图2 不同褪黑素投入量下褪黑素壳聚糖微粒的包封率Fig.2 The encapsulation efficiency of composite particles with different melatonin amount 图3为壳聚糖微粒(A、C)和褪黑素添加量为5 mg时制备的褪黑素壳聚糖微粒(B、D)在光学显微镜放大400倍(A、B)下的表观形貌和扫描电镜(C、D)下的微观形貌。400倍显微镜下壳聚糖微粒颗粒粒径较小,颗粒之间无团聚和黏连现象(图3A);图3B中形成的颗粒粒径较大,呈分散分布。扫描电镜显微照片图3C和D均能清楚观察到有颗粒物存在,基底为壳聚糖。图3C显示均匀的颗粒堆积,粒径较小;图3D显示大量的粒径较大颗粒,表面粗糙。这可能是由于添加褪黑素后褪黑素充斥于颗粒内部,从而导致颗粒粒径增大。 图3 壳聚糖微粒扫描电镜图Fig.3 Electron scanning images of chitosan particle structure 对褪黑素壳聚糖微粒进行了红外光谱(FTIR)分析,同时与MT、MP、CS、TPP、果胶FTIR光谱进行了比较(图4)。壳聚糖(CS)在3458、1658、1076 cm–1处的特征吸收峰分别归属于N―H拉伸振动峰、氧桥伸缩振动峰、碳氧伸缩震动吸收峰。TPP在1218 cm–1处有P―O拉伸振动峰,果胶在1638 cm–1处有COO–对称吸收峰。褪黑素(MT)的N―H拉伸振动,N―H弯曲振动和C―O―C拉伸振动分别是3301、1626和1213 cm–1的吸收峰。在MPMT的光谱中,观察到CS与TPP交联后,CS中3524 cm–1处的峰移至较低波数 3454 cm–1,在 1537 cm–1处出现了一个新峰(酰胺II),这可能是由于CS的–NH2基团与TPP磷酸基团之间存在静电相互作用造成的。通过MT-MP与MP对比,发现MPMT中拥有与MT相关的N―H弯曲振动和C―O―C拉伸振动峰,这能表明MP-MT中含有MT相关组分。 图4 褪黑素壳聚糖(MP-MT)、空载壳聚糖微粒(MP)、褪黑素(MT)、壳聚糖(CS)、三聚磷酸钠(TPP)和果胶(Pectin)的红外光谱Fig.4 Infrared spectra of melatonin chitosan (MP-MT),chitosan microparticles (MP), melatonin (MT), chitosan(CS), sodium tripolyphosphate (TPP), and pectin (Pectin) 从室温下MP-MT在pH 5.0或pH 7.0的磷酸缓冲溶液中的释放曲线(图5)可以看出,MP-MT呈现双相释放模式,初始阶段为快速释放,褪黑素在4 h内释放率达到 44.83% (pH 5.0)和 27.6% (pH 7.0),此后表现为缓慢释放,最终在36 h内释放率达到65.43% (pH 5.0)和 50.13% (pH 7.0)。初始阶段的爆发释放是由于吸附在MT-MP表层的褪黑素释放,而后期的缓释是由于壳聚糖微粒内部褪黑素缓慢释放。与pH7.0下相比,pH5.0下累积释放率升高。可见,褪黑素壳聚糖微粒可以有效延长褪黑素的释放时间,且MP-MT在酸性条件下会加快褪黑素的释放。 图5 褪黑素壳聚糖微粒在磷酸缓冲溶液中的释放速率Fig.5 Release rate of melatonin chitosan in phosphate buffer solution 使用Ritger-Peppas数学模型对释放数据进行拟合,MP-MT在pH 5.0的磷酸缓冲溶液中的释放指数和线性相关系数(R2)分别为0.138和0.86,MPMT在pH 7.0的磷酸缓冲溶液中的释放指数和线性相关系数(R2)分别为0.228和0.90 (图6)。两者的释放指数都小于0.45,这表示褪黑素在微粒中的释放行为主要以扩散控制为主。 图6 Ritger-Peppas数学模型拟合的褪黑素壳聚糖微粒中褪黑素随时间的释放率Fig.6 Melatonin release rate of melatonin chitosan with time fitted by Ritger-Peppas model 由褪黑素(MT)和褪黑素壳聚糖微粒(MPMT)水溶液在光照射下褪黑素的降解率(图7)可知,MT在1 h时的降解率为11.47%,4 h时的降解率为23.68%;MP-MT在1 h时褪黑素降解率为5.33%,在4 h时降解率仅为9.73%,相较于MT降解率降低了58.91%。这表明褪黑素负载在壳聚糖微粒后可有效降低褪黑素的降解,延长其持效时间。 图7 可见光下壳聚糖微粒负载褪黑素(MP-MT)和褪黑素(MT)随时间的降解率Fig.7 Degradation rate of melatonin with (MP-MT) and without chitosan microparticles (MT) under visible light 由表1可知,干旱对照(CK2)比正常对照(CK1)小麦幼苗株高、干重分别显著降低了25.72%、28.58%。与CK2相比,MP对小麦株高、生物量及SPAD值均无显著影响,MT和3个MP-MT处理有不同程度的增加,MT1.0处理和MP-MT0.5处理可以有效的提高小麦叶片的SPAD值14.47%和23.56%。与MT1.0相比,MP-MT1.0显著增加了小麦株高,3个MP-MT处理的小麦幼苗干重增加4.50%~22.73%,3个MP-MT处理均提高了SPAD值。以上结果表明,MT-MP提高小麦幼苗抗旱性的效果好于MT。 表1 干旱胁迫下不同处理小麦株高、鲜重、干重和叶片SPAD值Table 1 Plant height, fresh weight, dry weight and leaf SPAD value of wheat with different treatments under drought stress 干旱胁迫显著影响了小麦的根系发育情况(表2)。MP处理除根系体积外,其他指标与CK2处理无显著差异,而MT1.0、MP-MT0.5、MP-MT1.0和MPMT1.5处理的根长和根表面积则分别较CK2处理增加18.71%、37.75%、57.40%、40.65%和22.94%、25.59%、38.61%和17.82% (表2)。与MT1.0处理相比,3个MP-MT处理根系长度增加 15.92%~32.56%,增加幅度以MP-MT1.0最大。 表2 干旱胁迫下不同处理小麦根系生长情况Table 2 Root growth of wheat with different treatments under drought stress 过氧化物酶是植物体内活性氧清除系统的主要成分之一,能够缓解植物因干旱引起的氧化损伤。干旱条件会导致小麦叶片的SOD、POD、CAT活性下降(表3),而MT和MP-MT处理的小麦叶片SOD、POD、CAT活性均较CK2处理出现明显上升。其中,与MT1.0处理相比,3个MP-MT处理的过氧化酶活性提高了19.56%~20.34%。丙二醛(MDA)含量可以在一定程度上反映植物遭受干旱胁迫伤害的程度。MP-MT0.5、MP-MT1.0和MPMT1.5处理比CK2处理小麦叶片的MDA含量分别显著降低28.16%、27.80%和26.12%。与MT1.0处理相比,3个MP-MT处理的小麦幼苗MDA含量降低9.77%~12.30%。MP-MT0.5与MP-MT1.0、MPMT1.5处理之间POD、CAT活性和MDA含量无显著性差异。综合以上结果可知,干旱条件下,MT1.0处理能够增强小麦抗旱能力,而MT-MP处理较MT1.0处理进一步显著提升小麦幼苗的抗旱能力,且MP-MT0.5处理所需褪黑素施加量更少。 表3 干旱胁迫下不同处理小麦抗氧化酶活性和丙二醛含量Table 3 Antioxidant activity and malondialdehyde content with different treatments under drought stress 通过壳聚糖/三聚磷酸钠/果胶与褪黑素的杂化成粒可以实现褪黑素缓释保活。超高效液相色谱法测定,装载的MP-MT的封装效率为52.23%,与壳聚糖/卵磷脂载药体系相比包封率升高,这可能是体系中添加果胶的原因。果胶作为一种新的负电荷组分和易被吸收的植物分子,能够增强壳聚糖与三聚磷酸钠的交联反应,由此可能会获得更优的封装效果和更高的利用效率[18]。与褪黑素多孔淀粉封装系统相比,包封率虽无显著差异,但是壳聚糖/三聚磷酸钠/果胶的杂化包裹褪黑素会使其混合更为均匀,而且封装材料相比多孔淀粉等更为廉价易得,更加适用于农业生产[19]。相比壳聚糖/三聚磷酸钠制备的纳米颗粒,壳聚糖/三聚磷酸钠/果胶装载褪黑素的微粒粒径具有明显的增加,这可能与添加果胶有关,果胶是具有粘性的溶液会导致微粒的聚集变大。 褪黑素壳聚糖微粒是一种扩散控制的缓慢释放系统,表现为前期的爆发释放和后期的缓慢释放,这种延迟释放可以有效的增加植物对褪黑素的利用效率。前期快速释放使植物的胁迫状况可以及时得到缓解,后期缓慢释放使植物持续处于褪黑素分子的刺激作用下。在36 h时MP-MT的累计释放率为65.43%,对比卵磷脂/壳聚糖/褪黑素纳米颗粒4 h释放70%,缓释期明显增加。这主要与微粒的粒径相对较大有关,有研究表明微粒的粒径增加会增强缓释性能[20]。而且微粒成分中含有果胶,果胶与水接触后会迅速形成粘性溶液和凝胶,通过渗透作用调节膨胀程度,增加交联密度,调节释放速率[21]。有研究表明植物在逆境胁迫条件下,会通过分泌质子、有机酸等来抵抗逆境胁迫,从而导致局部根系pH的降低,MP-MT在酸性条件下加快释放,有利于褪黑素释放快速缓解植物的胁迫状况[22]。酸性条件下MPMT释放加速,主要与壳聚糖特性有关,弱酸条件下壳聚糖的氨基被质子化,破坏了壳聚糖分子间氢键作用,二级结构被破坏,使得褪黑素的溶出增加,释放加快[23]。本研究中发现壳聚糖封装系统还能有效的降低褪黑素的光降解作用。褪黑素的光降解可能是由于在光照和氧气存在的条件下,吲哚环生成过氧化物中间体,然后迅速成为稳定的产物N1-乙酰基-N2-甲酰-5-甲氧基犬尿氨酸(AFMK)所造成的。MP-MT光降解下降可能与壳聚糖外壳减少了褪黑素与光和氧的直接接触有关[10, 24]。 在干旱胁迫条件下,相比CK2处理,MT1.0处理和MP-MT0.5处理可以有效提高小麦叶片的SPAD值14.47%和23.56%,这可能与褪黑素参与调节光合作用相关的蛋白质有关。研究表明,褪黑素下调部分与叶绿素降解有关的蛋白或酶,如衰老脱水相关蛋白、α-淀粉酶,从而减少叶绿素的降解,维持叶绿体功能[25]。本试验中褪黑素壳聚糖微粒通过缓释褪黑素来提高干旱胁迫下叶绿素相关酶的表达,减少叶绿素降解,从而保证光合作用的正常进行。 促进根系发育,是减少干旱胁迫造成的不良影响的重要手段。在许多植物中,褪黑素已被证明能促进根的生长。在甜樱桃砧木的试验中,发现低浓度的褪黑素对砧木的根数和根长有自生反应[26];Zhou等[27]研究发现,mDREB1在转基因植物中可以调节褪黑素的合成,增加褪黑素的含量,从而减轻干旱胁迫对根系发育的抑制作用。在本研究中,通过对植株根系形态的对比分析,结果表明,MT1.0、MP-MT0.5处理分别显著促进根长和根表面积增长18.71%、37.75%和22.94%、25.59%,使其拥有更丰富的根去获取水分,从而抵御干旱胁迫,这与王华美等[28]的研究结果是一致的。褪黑素微粒在提高干重、SPAD值和根系发育方面的效用较MT更加明显,原因可能在于褪黑素在壳聚糖封装体系中降低光降解速率并缓慢释放,使得植物能够在干旱胁迫条件下,外源褪黑素浓度保持在有效范围之内,增强植物抗旱性。 干旱胁迫时,植物叶绿体和线粒体中积累大量自由基,破坏植物的正常代谢,导致作物减产[29]。Ali等[30]研究发现,干旱胁迫累积大量活性氧(ROS),导致植物细胞损伤产生MDA,抑制植物生长发育。施加褪黑素可以诱导干旱胁迫下植株抗氧化能力的提高,增强对细胞膜的保护作用。本研究中MP-MT0.5处理显著增强了干旱胁迫下小麦SOD、POD、CAT的活性,增强清除ROS的能力。这可能是因为外源褪黑素可以诱导内源一氧化氮的产生,从而下调miR398表达以激活ROS清除酶活性,促进相关基因的表达并最终清除细胞内ROS[31]。且MT1.0和MP-MT0.5处理显著降低了叶片MDA含量,其中MP-MT0.5降低效果更为明显,显著减少了28.16%。这可能与褪黑素提高了抗氧化酶活性和调节C-重复序列结合因子(CBFs)等逆境反应基因的表达有关[32]。本研究MP-MT处理在提升小麦幼苗抗旱性上明显优于MT处理,这主要是因为壳聚糖/三聚磷酸钠/果胶封装体系提高了褪黑素的利用率。另外本试验在不限制黑暗条件下施用且减少施用频次的情况下提高了小麦幼苗的抗旱能力,这可能与褪黑素壳聚糖微粒对褪黑素的缓慢持续释放和光降解速率降低有关。 壳聚糖/三聚磷酸钠/果胶体系能够有效包封褪黑素,在褪黑素加入量5 mg时,包封率达到52.14%;褪黑素壳聚糖微粒具有缓释性能,符合Ritger-Peppas释放机理Fick扩散;光降解试验表明,褪黑素壳聚糖微粒可有效降低褪黑素的光降解速率;小麦干旱胁迫试验表明,褪黑素壳聚糖微粒在降低褪黑素的使用量情况下,提高小麦幼苗SPAD值,促进根系发育,增强抗氧化酶活性,从而缓解干旱损伤,提高小麦幼苗抗旱能力。1.4 数据处理分析
2 结果与分析
2.1 褪黑素壳聚糖微粒的包封率
2.2 褪黑素壳聚糖微粒表面形貌

2.3 褪黑素壳聚糖微粒化学结构

2.4 褪黑素壳聚糖微粒的缓释特性和动力学拟合
2.5 褪黑素壳聚糖微粒的光降解性能
2.6 干旱条件下褪黑素壳聚糖微粒对小麦幼苗的生长状况和生理指标的影响

3 讨论
4 结论

