瘦素对氧糖剥夺∕复糖复氧后原代神经元的影响及相关机制☆
张艳 程道宾 揭春晓 胡诗俊
脑缺血后再灌注过程会出现氧化应激激增、炎症级联反应和细胞过度凋亡等,即脑缺血-再灌注损伤(cerebral ischemia∕reperfusion injury,CIRI)[1-2]。内质网应激(endoplasmic reticulum stress,ERS)是指在缺血缺氧情况下,折叠不良的蛋白异常聚集于内质网腔的状态。有研究证实,靶向ERS相关信号能抑制细胞凋亡的发生[3-4]。瘦素主要是由肥胖基因编码、脂肪组织合成的多肽激素[5],可与中枢神经系统的受体结合激活磷脂酰肌醇3-激酶∕蛋白激酶 B(phosphatidyl inositol 3-kinase∕protein kinase B,PI3K∕Akt)信号通路在神经系统疾病中发挥抗凋亡作用[6-7]。本课题组前期研究发现,瘦素通过调节ERS相关蛋白在局灶性缺血性卒中发挥神经保护作用[8],但具体机制尚不明确。因此,本研究用原代皮层神经元行氧糖剥夺∕复糖复氧(oxygen-glucose deprivation and reoxygenation,OGD∕R)拟建立 CIRI体外模型,旨在探讨瘦素是否通过激活PI3K∕Akt信号通路减轻OGD∕R诱导的ERS,为其用于后续临床应用提供良好的理论和实验基础。
1 材料与方法
1.1 动物新生24 h内的Sprague-Dawley乳鼠购自广西医科大学动物实验中心。所有实验步骤遵守中华人民共和国科技部发布的《实验动物福利伦理指南》,并经广西医科大学动物伦理委员会批准。
1.2 皮层神经元培养及鉴定参照Gaurav Das等[9]神经元原代培养的方法并稍加改进。取新生24 h内的Sprague-Dawley乳鼠大脑皮层组织进行原代培养:解剖的大脑皮层组织在剥离脑膜血管后,经剪碎、消化、离心,用含10%胎牛血清DMEM∕F-12制备单细胞悬液,并将其种植于预涂有多聚赖氨酸的孔板中。4 h后,换成含2%B27和1%谷氨酰胺的Neurobasal-A培养基。每3~5 d半量换液;在种板第7 d后通过神经元核抗原抗体NeuN鉴定神经元的纯度,具体步骤参照下文细胞免疫荧光。
1.3 氧糖剥夺/复糖复氧模型制作及分组原代神经元培养7 d后,将孔板中的Neurobasal-A培养基换成无糖培养基将神经元置于充满95% N2和5% CO2的模块化培养箱中分别培养1 h、2 h和4 h;然后换用正常培养基在正常培养箱中(37°C,5% CO2)继续培养24 h。
将细胞随机分为正常组、OGD∕R组、瘦素组和LY+瘦素组。正常组神经元不作OGD∕R处理,加入等剂量溶剂;OGD∕R组神经元在OGD∕R前给予等剂量溶剂;参照ZHANG等[10]及ZHANG等[11],瘦素组神经元在OGD∕R处理前选取400 ng∕mL瘦素(瑞士罗氏制药公司)预处理24 h;LY+瘦素组神经元用LY294002(美国MedChemExpress公司)预处理30 min,再予 400 ng∕mL 瘦素预处理 24 h,然后行OGD∕R处理。
1.4 细胞存活率测定将100 μL的细胞悬液加入96孔板中,密度约为 2×105∕孔,空白组加入不含细胞的等量培养基。各组细胞OGD∕R后,每孔加入10 μL CCK-8溶液并在37°C黑暗条件下孵育2 h。在全自动酶标仪上于450 nm波长处测定各孔吸光度值。细胞的存活率(%)=(实验组-空白组)∕(正常对照组-空白组)×100%。
1.5 透射电镜吸弃培养基,用2.5%戊二醛固定液固定OGD∕R后的神经元;细胞刮轻轻刮下细胞后,用巴氏管将细胞液吸入离心管中固定过夜;用1%四氯化锇再次固定1 h后,在梯度酒精中脱水30 min,并包埋于环氧树脂中;使用超薄切片机切成超薄切片(70~80 nm),用2%的乙酸铀酰和2%的乙酸铅染色切片;在透射电子显微镜(型号JEM-2000EX)下观察切片。
1.6 细胞免疫荧光将细胞转种于24孔板的盖玻片上,密度为2.5×105∕孔。用4%多聚甲醛将收集的细胞爬片室温固定20 min;用0.25%曲那通溶液37°C穿透15 min;5%山羊血清白蛋白37°C封闭1 h;加入按适当比例稀释的一抗混合液(鼠抗大鼠NeuN,1∶1000;兔抗大鼠GRP78,1∶1000;兔抗大鼠p-Akt,1∶400)并放置于4°C冰箱孵育过夜。次日,用PBS溶液洗涤3次后,加入配制好的二抗混合液(羊抗兔IgG抗体,1∶1000;羊抗鼠IgG抗体,1∶1000)于37°C孵育1 h;PBS溶液洗涤3次后,用含DAPI抗荧光淬灭剂封片。在荧光显微镜(型号:DMIL-RF1)下观察,每张细胞爬片随机选取5个不同视野获取图像。
1.7 蛋白免疫印迹提取细胞总蛋白,应用BCA法对蛋白定量;每10 μL含40 μg蛋白,加入适量的上样缓冲液煮沸10 min。用10%SDS-PAGE凝胶进行电泳使蛋白分离;随后将蛋白转移到PVDF膜上(200 mA,75 min)。用5%脱脂牛奶溶液封闭1 h后,PVDF膜与相应的一抗混合液(兔抗大鼠p-Akt,1∶2000;兔 抗 大鼠 Akt,1∶1000;兔 抗大 鼠GRP78,1∶1000;兔抗大鼠CHOP,1∶250;兔抗大鼠Caspase12,1∶500;兔抗大鼠β-actin,1∶2000)在4°C冰箱孵育过夜。TBST溶液洗膜3次后,与过氧化物酶偶联二抗溶液(1∶10000)于暗室常温孵育1 h。TBST溶液洗膜3次后,滴加ECL化学发光液于暗室曝光显影,结果用ImageJ软件作定量分析。
1.8 RT-PCR提取细胞总RNA后,紫外分光光度计检测RNA的含量和纯度,依据RT-PCR试剂盒逆转录为cDNA。根据Prime5.0软件设计出以下引物。GRP78:正向引物TCTGTGACACCTGACCGACC,反向引物TGAATACACCGACGCATAG。Caspase12:正向引物TTGGATACTCAGTGGTGATAAAGGA,反向引物:GGATGCCGTGGGACATAAAGA。CHOP:正向引物GCGGCTCAAGCAGGAAATC,反向引物TTGGCACTGGCGTGATGGT。β-actin:正向引物TCAGGTCATCACTATCGGCAAT,反向引物AAAG AAAGGGTGTAAAACGCA。按GenStar厂家建议构建20 μL反应体系,充分混匀后进行扩增,按照试剂说明书给出的反应程序进行RT-扩增。β-actin用于标准化不同样品中RNA的数量和质量。采用比较Ct法(ΔΔCt法)对数据进行分析。
1.9 统计学方法采用SPSS25.0进行数据分析。所有计量资料以±s表示。多组间比较采用单因素方差分析,两两比较采用LSD-t法。检验水准α=0.05。
2 结果
2.1 瘦素对OGD/R诱导的体外神经元损伤的作用
2.1.1 神经元纯度鉴定以及确定合理的OGD∕R时间和药物浓度 将培养7~8 d的神经元进行细胞免疫荧光染色。经荧光显微镜观察,所有细胞胞核被DAPI染成蓝色;FITC标记为阳性的细胞为红色,即神经元。计数神经元阳性率为90%以上(图1)。
如表1所示,与正常对照组相比,随着OGD时间的增加,细胞活力逐渐下降。在氧糖剥夺2 h和复糖复氧24 h后,细胞活力下降至42.06%。综合考虑,后续实验均采用2 h∕24 h作为OGD∕R时间。

表1 不同OGD时间对细胞存活率的影响
如表2所示,瘦素以浓度依赖的形式保护皮层神经元免受OGD∕R损伤。与OGD∕R组比较,在瘦素浓度达到400 ng∕mL时,瘦素的神经保护作用显著(P<0.01)。因此,选择400 ng∕mL的剂量作为后续实验瘦素预处理的浓度。

表2 不同瘦素浓度对细胞存活率的影响
2.1.2 瘦素对OGD∕R后神经元的影响 正常条件下培养的神经元,细胞核圆而亮且细胞质丰富,神经网络完整。经OGD∕R处理后,细胞形态发生改变,即细胞皱缩,胞浆较少,并且神经网络消失。与OGD∕R组比较,瘦素预处理后神经元的改变明显减少(图2)。
四组细胞存活率有统计学差异(F=215.00,P<0.01)。CCK-8结果与显微镜下观察结果一致(表3),即瘦素预处理后,神经元OGD∕R后的细胞存活率明显提高(P<0.01)。然而,在添加LY294002后,神经元OGD∕R后的细胞状态变差,且细胞活力明显下降(P<0.01)。
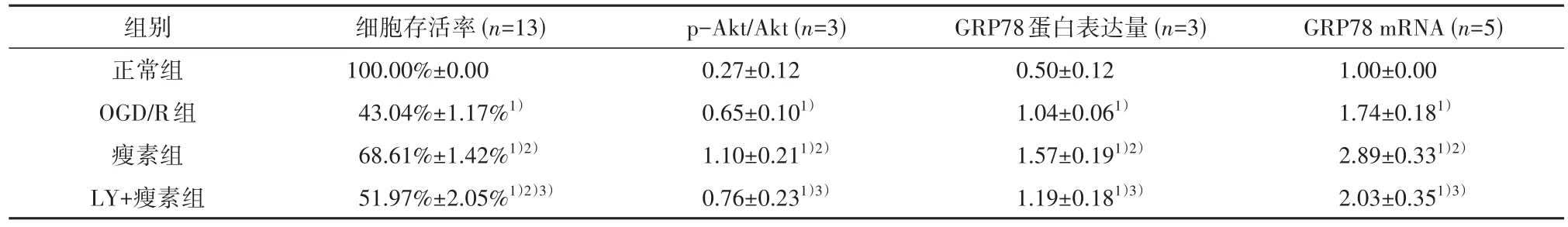
表3 各组神经元存活率、p-Akt/Akt、GRP78 mRNA及蛋白表达量比较
2.1.3 瘦素对PI3K∕Akt信号通路的影响 正常组神经元的胞质处见少量p-Akt的表达。与正常组比较,OGD∕R处理后神经元的胞核和胞质处p-Akt光密度明显增强;与OGD∕R组比较,瘦素预处理组p-Akt光密度明显增强。蛋白印迹技术结果与细胞免疫荧光结果一致,p-Akt∕Akt组间有统计学差异(F=11.73,P<0.05)。OGD∕R组p-Akt蛋白水平显著高于正常组(P<0.05);瘦素组p-Akt蛋白水平显著高于OGD∕R组(P<0.05);与瘦素组比较,LY+瘦素组p-Akt荧光强度及p-Akt∕Akt蛋白水平显著降低(P<0.05)(图3,表3)。
2.2 瘦素对OGD/R诱导的内质网应激的影响
2.2.1 瘦素对内质网超微结构改变的影响 正常组的粗面内质网呈扁平的囊腔,排列整齐,彼此相通,并且网膜胞质面附着大量核糖体;OGD∕R后出现扩张的和部分碎裂的内质网,嵌有少量核糖体;与OGD∕R组比较,瘦素预处理能极大地减少上述内质网结构的改变;然而,LY294002预处理神经元能明显干扰瘦素对内质网结构的影响(图4)。
2.2.2 瘦素对内质网相关的促细胞存活因子GRP78表达的影响 GRP78蛋白表达量(F=12.03,P<0.05)、GRP78 mRNA(F=15.67,P<0.05)组间差异有统计学意义。与正常组比较,OGD∕R组GRP78光密度明显增强,并且在瘦素预处理后进一步加强。蛋白印迹技术结果显示,与正常对照组比较,OGD∕R组的GRP78的mRNA和蛋白水平明显增高(P<0.05);与OGD∕R组比较,瘦素组神经元的GRP78 mRNA和蛋白水平显著增高(P<0.001,P<0.05);与瘦素组比较,LY+瘦素组GRP78 mRNA水平显著降低(P<0.01,P<0.001)(图5,表3)。
2.2.3 瘦素对内质网应激相关的促凋亡因子CHOP和Caspase12表达的影响 四组神经元中CHOP(F=17.36,P<0.05)和Caspase12(F=15.80,P<0.05)的蛋白表达量差异有统计学意义,神经元中CHOP mRNA(F=27.10,P<0.01)和 Caspase12 mRNA(F=45.47,P<0.01)的相对表达量差异有统计学意义。与正常组比较,OGD∕R组 CHOP和 Caspase12 mRNA水平及蛋白表达量明显增加(P<0.001);与OGD∕R组比较,瘦素组CHOP和Caspase12 mRNA水平及蛋白表达量显著下降(P<0.01);与瘦素组比较,LY+瘦素组CHOP和Caspase12 mRNA水平及蛋白表达量明显升高(P<0.05)(图6,表4、5)。

表4 各组神经元中CHOP和Caspase12的蛋白表达量比较

表5 各组神经元中CHOP和Caspase12 mRNA的相对表达量比较
3 讨论
近年来,瘦素被报告能通过减轻细胞炎症级联反应和细胞过度凋亡等改善多器官缺血-再灌注损伤[12-14]。然而,瘦素参与脑缺血-再灌注的损伤具体机制尚未完全清楚。本研究发现,瘦素通过抑制内质网应激减少OGD∕R诱导的神经元损伤,并且与其激活PI3K∕Akt信号通路有关。
瘦素是一种由脂肪细胞合成并分泌的脂肪细胞因子,它不仅在能量代谢和胰岛素敏感性调节方面发挥着重要作用,也在动脉粥样硬化的发生发展中至关重要[15]。本研究通过倒置显微镜观察神经元的形态及CCK-8试验检测神经元的存活率,结果显示瘦素能有效提高体外神经细胞存活率,维持细胞状态,这与先前的研究报告一致,即瘦素预处理对OGD∕R后神经元具有保护作用。PI3K∕Akt信号通路是细胞内重要信号转导通路之一,由G蛋白偶联受体或受体酪氨酸激酶激活PI3K引起的。活化的PI3K将4,5-二磷酸肌醇转化为第二信使3,4,5-三磷酸磷脂肌醇,它与含有PH结构域的信号蛋白Akt结合,使之移位到细胞膜。定位后,Akt(在Thr308残基处)可被其上游调节剂如磷酸肌醇依赖性激酶1磷酸化,而Akt完全活化需在Ser473残基处进一步磷酸化[16]。活化的Akt与细胞存活、新陈代谢和蛋白质合成等密切相关[17]。本研究通过免疫荧光观察到,激活的Akt在OGD∕R条件下从胞质转移到胞核,而这可能参与一系列生理过程,如促进细胞信号传导、增生和抑制细胞凋亡。另外,本研究发现神经元OGD∕R后p-Akt的表达明显提高,并且在瘦素预处理后p-Akt的表达进一步升高,提示瘦素在再灌注期间上调p-Akt的表达。然而,在LY294002预处理后瘦素的神经保护作用被削弱,如神经元存活率下降,细胞状态明显变差,且p-Akt的表达下降,提示瘦素通过激活PI3K∕Akt信号通路发挥其神经保护作用。
CIRI的病理生理过程错综复杂,受多种因素的调节,ERS是其中的重要机制。内质网作为多功能细胞器,其中存在数十种伴侣分子、酶和辅助因子,它们有助于新合成蛋白精确折叠,并协助多肽实现最终的功能构象[18]。在生理环境下,内质网的蛋白质折叠效率和信使核糖核酸翻译速率相平衡。脑缺血条件下,折叠不良的蛋白积聚于内质网腔,竞争性地与GRP78结合,导致3种跨膜蛋白激发未折叠蛋白反应的下游信号传导级联[19]。据报告,GRP78在内质网应激期间不仅充当压力传感器控制ERS激活,还作为内质网伴侣蛋白增强内质网折叠能力,抑制新生蛋白转运并帮助折叠不良的蛋白转运至胞质发生内质网相关降解以促进细胞存活[20]。此外,GRP78在ERS期间具有抗凋亡作用,如上调抗凋亡因子Bcl2的表达,并下调促凋亡蛋白Bax的表达[21-23]。本研究结果显示,OGD∕R显著诱导GRP78的表达,且瘦素预处理后GRP78的表达进一步升高,提示瘦素可能通过上调GRP78的表达抑制ERS以减轻OGD∕R损伤。若持续时间过长,蛋白质稳态无法恢复,ERS相关的细胞凋亡则会发生。CHOP相关的转录因子途径和Caspase12依赖性途径是ERS诱导细胞凋亡的两种特异性途径,特别是Caspase12[24]。Caspase12位于内质网外膜,是ERS介导细胞凋亡的特异性蛋白水解酶,并不受其他死亡形式所激活[25]。本研究结果显示,OGD∕R处理后CHOP和Caspase12的表达升高,但瘦素预处理后CHOP和Caspase12的表达明显降低,这提示瘦素可能通过下调CHOP和Caspase12的表达抑制OGD∕R诱导的ERS。在病理状态下,内质网结构改变与内质网功能和信号转导有关。透射电镜显示,与正常皮层神经元比较,OGD∕R后细胞的内质网肿胀且部分破碎,膜上镶嵌的核糖体明显减少,提示未折叠蛋白反应从促存活模式转向促凋亡模式。然而,瘦素预处理明显减轻了内质网结构扩张,表明瘦素可能通过抑制ERS来促进神经元存活。此外,LY294002预处理神经元后,上述现象明显被逆转,说明瘦素可能通过PI3K∕Akt信号通路抑制ERS。
如何改善CIRI是治疗缺血性卒中的一大挑战。本研究初步验证了瘦素抑制OGD∕R诱导的ERS,且PI3K∕Akt信号通路可能参与其中。然而,考虑到临床实践与细胞试验之间的差异,以及瘦素对多个组织的影响,有必要通过高质量、大样本及多中心前瞻性研究来衡量瘦素在CIRI患者中的疗效和安全性。此外,本研究未应用更多的抑制剂或激动剂来阻断或激活相关的信号通路以进行进一步验证。因此,瘦素的神经保护机制仍需进一步探索。

