猪SGK家族基因的生物信息学分析及其在猪脂肪组织和细胞中的表达
陈川河,刘嘉莉,张立兰,赵 莹,陶 聪,2
(1.中国农业科学院北京畜牧兽医研究所,北京 100193;2.岭南现代农业科学与技术广东实验室,广州 510642)
猪的脂肪沉积是复杂的经济性状之一,可通过调节机体能量平衡而显著影响猪的瘦肉率、饲料转化率和肉品质。传统的育种方法、分子育种和DNA分子标记辅助选择技术对猪背膘厚和瘦肉率的遗传改良均取得了很大进展。目前虽已鉴定出一些与脂肪沉积相关的基因,如黑素皮质素受体(MC4R)[1]、苹果酸酶(ME1)[2]、瘦素受体(LEPR)[3]、胰岛素样生长因子2(IGF2)[4]、解偶联蛋白1(UCP1)[5]、过氧化物酶体增殖物激活受体(PPARγ)[6]、脂联素(ADIPOQ)[7]、肌肉生长抑制素(MSTN)[8]、UCP3[9]等,但对影响猪脂肪沉积的基因挖掘还远远不足。哺乳动物的脂肪组织主要有存储能量的白色脂肪组织(WAT)、与非战栗产热密切相关的棕色脂肪组织(BAT)以及由WAT在一定的刺激条件下生成的米色脂肪组织。棕色、米色脂肪能够通过产热消耗能量,已成为人类减肥相关研究的热门靶点,也为降低猪的脂肪沉积提供了新的视角和思路。
血清和糖皮质激素诱导型激酶(SGKs)是丝氨酸苏氨酸蛋白激酶,包括SGK1、SGK2、SGK3 3个亚型。3种激酶均为离子通道活性、运输和转录的有效调节剂[10-12]。SGK1与SGK2均可调节膜蛋白的功能,如Na+/H+交换剂[13],有机阴离子转运蛋白[14-15]和肾脏近端肾小管细胞中的Na+通道[16-20]。SGK1或SGK3基因敲除小鼠均未观察到明显的表型[20-21],表明SGK1和SGK3均不是生存所必需的。研究表明,SGK1在脂肪组织中表达,通过磷酸化影响其亚细胞定位,抑制转录因子叉头框蛋白O1(FOXO1)的表达,激活脂肪细胞中PPARγ的表达,从而促进脂肪细胞的生成[22-24]。在小鼠体内,Herms等[25]将SGK2基因鉴定为在BAT中选择性表达的基因。SGK2基因在冷刺激的小鼠BAT中表达水平显著升高,在WAT中无显著差异[26]。在藏猪冷刺激后的腹股沟WAT中以及藏猪基质血管成分细胞(SVF)体外分化得到的米色脂肪细胞中均检测到SGK2基因高表达[27]。以上证据表明SGK2可能参与哺乳动物BAT发育及其产热功能,但是Park等[28]研究表明,SGK2基因全身性敲除小鼠体重无显著变化,且小鼠在4 ℃冷刺激后体温正常,β-3肾上腺素受体激动剂刺激后能量代谢正常,表明SGK2不直接参与小鼠棕色/米色脂肪的产热。目前,关于SGK2在米色脂肪发育及脂肪沉积中的功能意义还不清晰,尚没有关于猪SGK家族基因序列信息和功能的研究报道,特别是在猪脂肪形成过程中SGK家族基因的表达分析鲜见报道。7日龄猪腹股沟脂肪处于早期发育阶段,脂肪发育较旺盛;4月龄仔猪腹股沟脂肪趋于成熟,属于发育的晚期阶段。本研究以猪SVF细胞为试验材料,扩增SGK家族基因序列,运用生物信息学软件预测基因功能,并通过实时荧光定量PCR技术研究SGK家族基因在脂肪组织和细胞中的表达水平,为研究SGK家族基因的调控功能、改善猪脂肪沉积提供理论依据。
1 材料与方法
1.1 材料
1.1.1 样品 30日龄健康的巴马猪和藏猪各10头,分别购自广西瑶族自治县猪场和西藏林芝地区猪场。屠宰30日龄巴马猪,收集心脏、肝脏、脾脏、肺脏、肾脏、不同部位肌肉和脂肪组织;屠宰7日龄和4月龄巴马猪,收集腹股沟脂肪组织,用液氮快速冷冻后―80 ℃保存备用。用30日龄藏猪腹股沟脂肪分离获得藏猪SVF细胞。
1.1.2 主要试剂及仪器 TRIzol购自Invitrogen公司;反转录和实时荧光定量PCR试剂盒均购自TaKaRa公司;KOD FX、2×PCR Buffer for KOD FX、dNTPs均购自东洋纺(上海)生物科技有限公司;胎牛血清、DMEM高糖培养基均购自Gibco公司。冷冻离心机(5810R)购自Eppendorf公司;电泳仪(DYY-6B)购自北京六一仪器厂;超微量紫外分光光度计(NanoDrop 2000)购自Thermo Scientific公司;实时荧光定量PCR仪(ABI7500)购自Applied Biosystems公司;梯度PCR仪(C1000)购自Bio-Rad公司。
1.1.3 培养基的配制 生长培养基:1% 青-链霉素+10%胎牛血清+DMEM高糖培养基;诱导培养基:DMEM高糖培养基+5 μg/mL胰岛素+33 μmol/L生物素+17 μmol/L泛酸+0.25 mmol/L IBMX+0.1 μmol/L地塞米松+1 μmol/L罗格列酮+20 mmol/L HEPES;成熟培养基:DMEM高糖培养基+5 μg/mL胰岛素+33 μmol/L生物素+17 μmol/L泛酸+0.1 μmol/L地塞米松+1 μmol/L罗格列酮+20 mmol/L HEPES。
1.2 方法
1.2.1 藏猪SVF细胞的分离及其诱导分化 将30日龄藏猪处死后用75%酒精消毒,取出腹股沟脂肪组织,用含有青-链霉素的DPBS洗3遍;将WAT剪至1 mm3大小用胶原酶Ⅰ(1.5 mg/mL)在37 ℃消化30 min;消化后用生长培养基终止消化;用70 μm一次性细胞筛过滤,将滤液收集到15 mL离心管中,1 500 r/min离心5 min;弃上清,加入5 mL红细胞裂解液将底部沉淀轻柔吹打混匀,室温放置5 min,1 500 r/min离心5 min;弃上清,加入DMEM生长培养基将底部细胞吹打混匀后接种于培养皿,置于37 ℃、5% CO2培养箱中培养,每2 d换1次液。细胞100%汇合后,继续培养2 d(这种未分化的细胞定义为0 d);更换为诱导培养基,第5天半量换液为成熟培养基;第6天换为DMEM生长培养基,之后每2 d换1次液;第10天收集细胞,―80 ℃保存备用。
1.2.2 猪SGK家族基因PCR扩增及测序 TRIzol法提取体外分化第10天的藏猪SVF细胞RNA并反转录合成cDNA。根据GenBank中公布的猪(Susscrofa)SGK1(NM_001244459.1)、SGK2(XM_021078159.1)和SGK3(XM_021089284.1)基因序列,使用Primer Premier 5.0软件设计3对特异性引物,引物信息见表1。引物均由北京擎科生物科技有限公司合成。PCR反应体系25 μL:2× PCR Buffer for KOD FX 12.5 μL,上、下游引物各1 μL,cDNA 2 μL,KOD FX 0.5 μL,dNTPs 5 μL,ddH2O 3 μL。PCR反应条件:94 ℃预变性2 min;98 ℃变性10 s,60 ℃退火30 s,68 ℃延伸2 min,共35个循环;72 ℃延伸5 min。PCR产物经2.0%琼脂糖凝胶电泳检测正确后,送北京擎科生物科技有限公司测序。
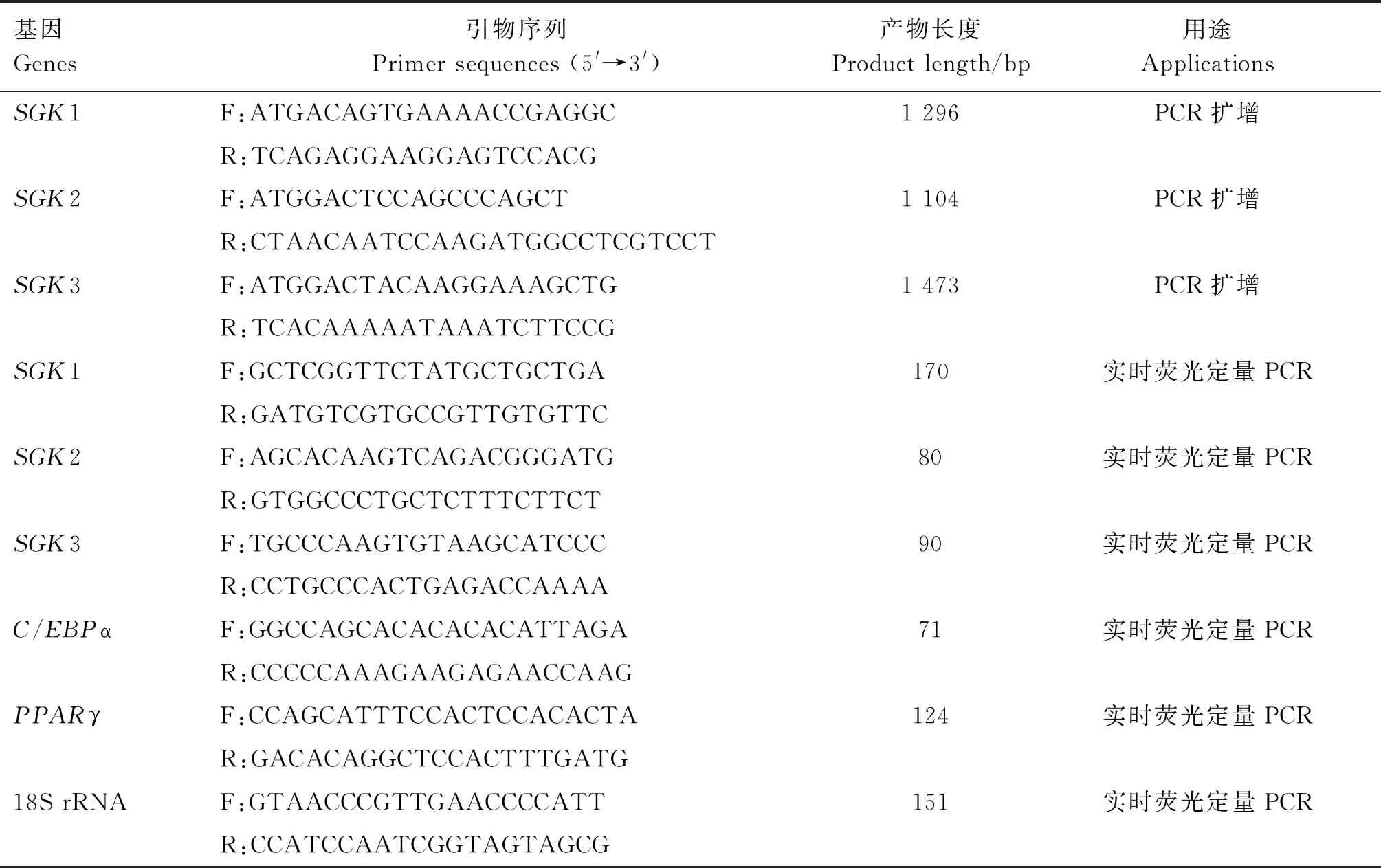
表1 引物信息
1.2.3 猪SGK家族基因生物信息学分析 采用ORF Finder工具进行开放阅读框预测分析;采用DNAMAN 7.0软件比对GenBank中公布的猪SGK家族基因序列与测序得到的DNA序列,明确SGK家族基因的起始密码子和终止密码子及各基因的SNP位点;据测序结果得到推测的蛋白序列,使用在线软件ExPASy(https:∥web.expasy.org/protparam/)分析猪SGK家族蛋白的理化性质,包括其基因组序列的编码序列、开放阅读框、分子质量、等电点、疏水性;利用在线软件WOLF PSORT(https:∥wolfpsort.hgc.jp)进行亚细胞定位预测;利用在线软件MapGen2Ch(http:∥mg2c.iask.in/ mg2c%5Fv2.0)绘制染色体定位图谱;利用在线软件GSDS 2.0(http:∥gsds.cbi.pku.edu.cn)分析SGK家族基因外显子分布;从UniProt网站(https:∥www.uniprot.org)下载人、小鼠、大鼠、牛、鸡和斑马鱼的SGK家族基因氨基酸序列以及上述扩增的猪SGK家族基因完整ORF所编码的氨基酸序列,用Mega X软件构建系统进化树,校验参数Bootstrap值设置为1 000,其他为默认值;SGK家族基因的结构域信息(PF00069和PF00433)下载自Pfam数据库(https:∥pfam.xfam.org),利用在线软件SMART(http:∥smart.emblhei-delberg.de)进行确认分析,将特征结构域序列进行序列比对及logo分析;使用在线软件MEME(http:∥memesuite.org/tools/meme)对猪SGK蛋白的保守基序进行分析,设置基序数量参数为5个,其余为默认;采用DNAMAN 7.0软件和在线软件WebLogo(https:∥weblogo.berkeley.edu/logo.cgi)分析SGK家族基因的保守序列。
1.2.4 组织和细胞中基因表达分析 利用TRIzol法提取巴马猪心脏、肝脏、脾脏、肾脏、肺脏、背部肌肉、腿部肌肉、颈部脂肪、背部脂肪、腹股沟脂肪、肾周脂肪等组织及藏猪SVF和由SVF分化10 d的脂肪细胞总RNA,反转录合成cDNA。以cDNA为模板,检测各组织中SGK家族基因的表达量,检测细胞中SGK家族基因及成脂分化标记基因PPARγ、C/EBPα的表达量。根据GenBank公布的猪SGK家族基因的mRNA序列(NM_001244459.1、XM_021078159.1、XM_021089284.1),使用Primer Premier 5.0软件设计实时荧光定量PCR引物,引物信息见表1。引物均由北京擎科生物科技有限公司合成。以18S rRNA为内参,进行实时荧光定量PCR反应。PCR反应体系20 μL:SYBR Green Premix ExTaq10 μL,上、下游引物(10 μmol/L)各0.4 μL,DyeⅡ 0.4 μL,cDNA 0.8 μL,ddH2O 8 μL。PCR反应条件:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火延伸34 s,共40个循环。用2-ΔΔCt法计算各基因的相对表达量。
1.3 数据统计分析
用SPSS 22.0软件进行单因素方差分析,用t检验进行组间差异分析。结果用平均值±标准差表示。用GraphPad Prism 6.0软件作图。P<0.05表示差异显著;P<0.01表示差异极显著。
2 结 果
2.1 猪SGK家族基因扩增及测序
由图1可知,SGK1、SGK2和SGK3扩增产物条带单一、清晰,片段大小分别为1 296、1 104和1 473 bp,均与预期相符。测序结果证实SGK1、SGK2、SGK3 CDS区序列长度均与PCR结果一致。通过ORF Finder工具进行开放阅读框预测分析,结果表明,SGK1、SGK2和SGK3基因分别编码431、367和490个氨基酸。DNAMAN 7.0软件分析表明,SGK家族基因起始密码子均为ATG,SGK1基因的终止密码子为TAG,SGK2和SGK3基因的终止密码子为TGA。经过与GenBank收录的猪SGK家族基因序列比对后发现,SGK1基因无SNP;SGK2基因存在2个SNPs位点;SGK3基因存在1个SNP位点,编码氨基酸均未发生变化。上传SGK2和SGK3基因CDS区序列至NCBI获得GenBank登录号:OM212064、OM212065。

M,DL1500 DNA Marker;1-3,SGK1,SGK2,SGK3
2.2 猪SGK家族基因的生物信息学分析
2.2.1 理化性质 通过ExPASy软件包对蛋白序列进行分析发现,猪SGK家族蛋白分子质量为41 402.32~56 412.39 u,等电点为6.45~8.71,SGK家族蛋白均为亲水性蛋白,SGK1蛋白的等电点>7.0,为碱性蛋白,SGK2和SGK3为酸性蛋白。亚细胞定位预测结果表明,SGK1和SGK2定位于细胞质,SGK3定位于细胞核(表2)。由图2可知,SGK1基因位于1号染色体,SGK2基因位于17号染色体,SGK3基因位于4号染色体。
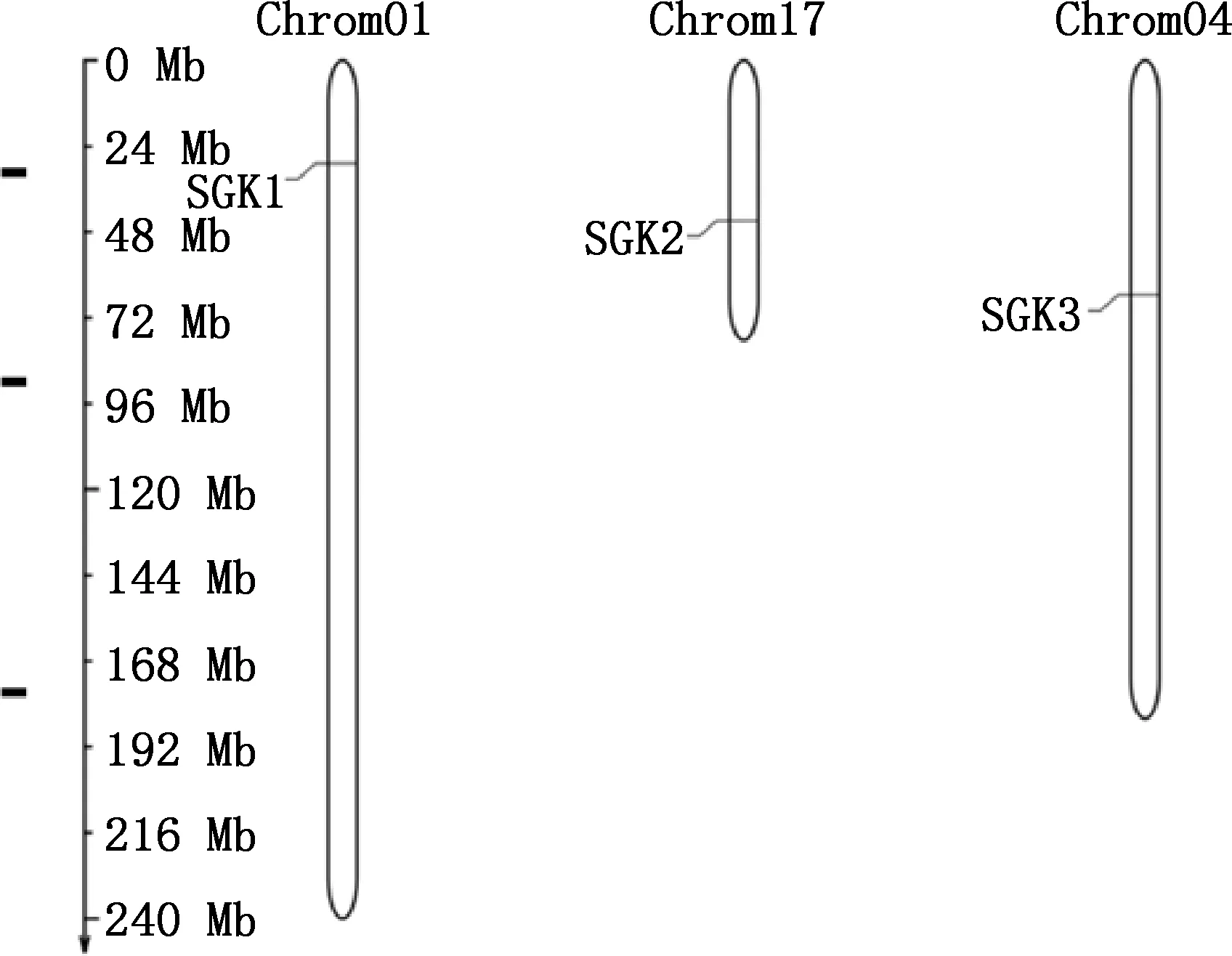
图2 猪SGK家族基因在染色体上的分布
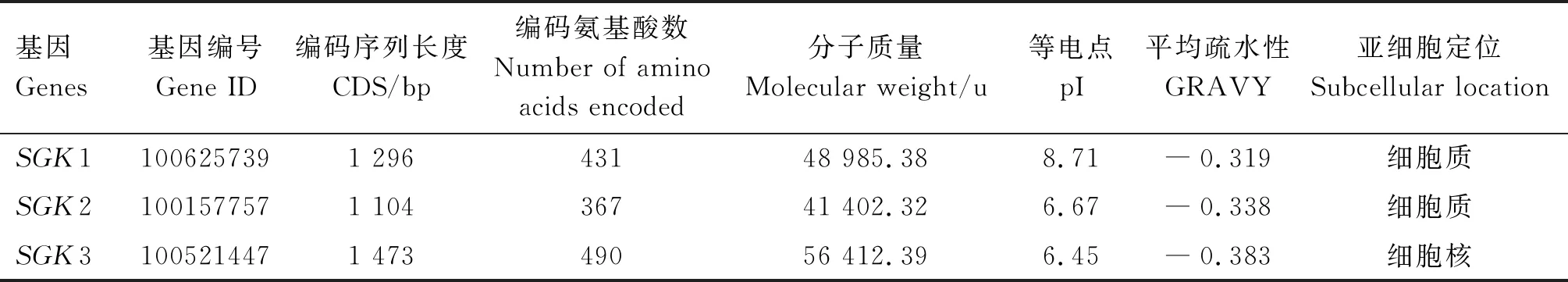
表2 猪SGK家族基因的序列特征
2.2.2SGK家族基因结构及保守基序分析 GSDS 2.0工具分析表明,SGK1、SGK2基因均有12个外显子,SGK3基因有16个外显子。SGK家族基因组序列最长的是SGK3基因,长度超过1 400 bp。利用MEME对3个SGK蛋白进行保守基序鉴定,3个蛋白均含有基序1~5(图3)。

A,猪SGK家族保守基序分布;B,基序logo分析
2.2.3 SGK家族蛋白结构域组成及进化树分析 Pfam数据库分析表明,猪SGK家族中所有成员都含有特征保守结构域,且该结构域由258个氨基酸残基组成,包括6个高度保守的组氨酸残基(X)44-His-(X)13-His-(X)30-His-(X)26-His-(X)20-His-(X)116-His-(X)3,保守性高(图4)。进化树分析结果显示,SGK家族成员均与猪和牛先聚为一支,再与人聚为一支;小鼠和大鼠聚为一支;SGK1和SGK3首先聚为一支,再与SGK2聚为一支;猪SGK蛋白与牛、人的SGK蛋白遗传距离较近,与斑马鱼SGK蛋白距离最远(图5)。

A,纵坐标为氨基酸序列堆叠的高度,表示该处的序列保守性;横坐标为氨基酸序列排列的顺序,表示该位置的每个氨基酸的相对频率;B,利用NovoPro在线多序列比对工具对保守结构域进行比对

图5 SGK蛋白的系统进化树
2.3 SGK家族基因在猪不同组织、不同生长阶段的表达
由图6可知,SGK1和SGK3基因在心脏、肝脏、脾脏、肺脏、肾脏、多种肌肉及脂肪组织中广泛表达,SGK2基因在不同组织中的表达量存在较大差异。SGK1和SGK3基因在猪肺脏中的表达量均显著高于其他组织(P<0.05);SGK3在背部肌肉和腿部肌肉中表达量最低;SGK2基因在颈部、背部、腹股沟、肾周脂肪中的表达量显著高于其他组织(P<0.05),在肝脏、肾脏中的表达量显著高于脾脏、背部肌肉、腿部肌肉(P<0.05),在心脏、肺脏中的表达量最低。相较于7日龄,SGK1和SGK2基因在4月龄猪腹股沟脂肪组织中极显著下调(P<0.01),SGK3基因无显著差异(P>0.05)。
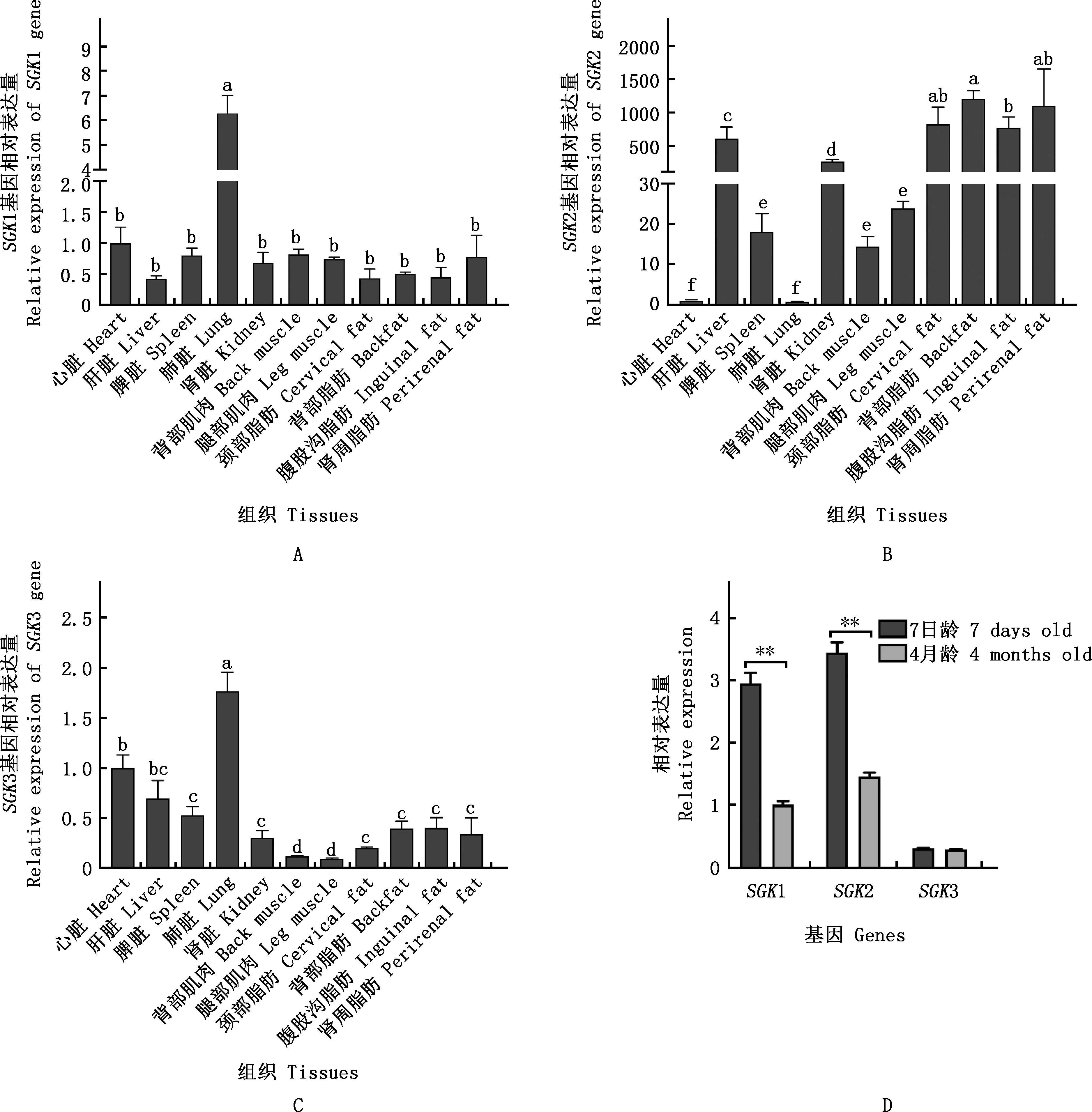
①A~C,SGK家族基因在猪不同组织中的表达;D,SGK家族基因在7日龄和4月龄猪腹股沟脂肪组织中的表达。②肩标不同字母表示差异显著(P<0.05);肩标相同字母表示差异不显著(P>0.05)。③**,差异极显著(P<0.01);无*,差异不显著(P>0.05)。下同
2.4 SGK家族基因在猪脂肪细胞分化前后的表达
与分化前的SVF细胞相比,在分化第10天的成熟脂肪细胞中C/EBPα和PPARγ基因的表达量极显著上调(P<0.01)(图7A);SGK1和SGK2基因在成熟脂肪细胞中表达量极显著上调(P<0.01),而SGK3基因的表达量在分化前后无显著差异(P>0.05)(图7B)。

图7 成脂分化标记基因(A)和SGK家族基因(B)在分化前后脂肪细胞中的表达
3 讨 论
为挖掘与猪脂肪沉积相关的基因,本研究对猪SGK家族基因进行解析,成功获得了SGK家族基因SGK1、SGK2和SGK3 CDS区序列,片段长度分别为1 296、1 104和1 473 bp,分别编码431、367和490个氨基酸,该结果与GenBank中预测的一致。对基因外显子进行研究,有助于了解该基因在结构和功能上的差异,猪SGK1和SGK2基因的外显子数量一致,说明SGK1和SGK2基因较为保守。对3个SGK蛋白进行保守基序鉴定,发现3个蛋白均具有5个保守基序。猪SGK蛋白序列均含有一段由258个保守氨基酸构成的序列(X)44-His-(X)13-His-o p(X)30-His-(X)26-His-(X)20-His-(X)116-His-(X)3,该结构域是蛋白激酶的催化结构域,具有共同的结构特征,可参与ATP结合。系统进化树结果表明,猪SGK蛋白与牛和人的遗传距离较近,与斑马鱼的遗传距离最远,表明SGK家族在哺乳动物中高度保守,可能具有相似的生理功能。通过以上对SGK家族蛋白信息和基因结构进行系统地分析,发现SGK家族蛋白保守性高,稳定性好。
本试验结果表明,SGK1和SGK3基因在猪各组织中均有表达,SGK2基因在肝脏、肾脏和不同脂肪组织中高表达,表明SGK2具有高度组织特异性,可能在特定器官及组织中发挥重要作用。相较于4月龄猪,7日龄仔猪的脂肪组织未发育成熟,含有大量的前脂肪细胞,成脂能力较强。本研究对不同日龄巴马猪脂肪组织中SGK家族基因进行表达分析,发现SGK1和SGK2在7日龄仔猪脂肪组织中表达量较高,在脂肪组织中SGK1和SGK2基因表达量高于SGK3基因,表明SGK1和SGK2可能参与猪早期脂肪发育,对脂肪组织的形成至关重要。猪SVF细胞成脂分化检测结果发现,SGK1和SGK2基因在分化后的前脂肪细胞中表达量显著升高,而SGK3基因没有变化,表明SGK1和SGK2可能参与了猪前体脂肪细胞的分化,在体外脂肪细胞形成过程中发挥关键作用,SGK3未参与脂肪细胞的分化。除此之外,在腹股沟脂肪组织中SGK2基因表达量高于SGK1基因,在分化成熟的脂肪细胞中SGK1基因的表达量高于SGK2基因,这可能是因为脂肪组织除脂肪细胞外还包含成纤维细胞、前脂肪细胞、单核细胞、巨噬细胞、血管基质细胞和神经细胞[29],成熟的细胞仅由SVF细胞分化而来,SGK2基因可能在除脂肪细胞外的其他细胞中也有较高表达,故SGK2基因在组织中表达量高于SGK1基因。有报道称,在脂肪细胞体外诱导分化过程中地塞米松可诱导SGK1基因表达上调[30],这可能也是在诱导分化的细胞中SGK1基因表达量较高的原因之一。
研究表明,SGK1受脂肪细胞代谢相关因子调节,可通过FOXO1参与脂肪细胞分化[24]。SGK1在肥胖和糖尿病患者的脂肪组织中高表达,与肥胖相关的炎症反应相关[22]。SGK1基因敲除小鼠对胰岛素、糖皮质激素敏感性降低,诱导SGK1表达有助于改善葡萄糖代谢和胰岛素敏感性[31]。SGK2对脂肪形成作用的研究尚未见报道。本研究发现,在猪的脂肪组织中SGK1与SGK2基因均高表达,且SGK2与SGK1基因均在7日龄仔猪的脂肪组织中高表达,表明SGK2与SGK1可能在功能上一致,在脂肪组织中发挥重要功能。鉴于SGK2在肾上皮细胞细胞Na+通道中的重要作用[16],推测SGK2可能通过调节离子通道参与脂质代谢。本研究结果表明,SGK家族中SGK1和SGK2参与猪脂肪沉积及脂肪细胞分化,推测二者可能在猪脂肪发育过程中发挥重要作用。
4 结 论
SGK1、SGK2和SGK3基因CDS区序列全长分别为1 296、1 104和1 473 bp,分别编码431、367和490个氨基酸,它们编码的蛋白具有相同的特征结构域及保守基序。SGK1和SGK3基因广泛表达于多种组织器官,SGK2基因在颈部、背膘、腹股沟、肾周的脂肪组织中表达量较高。SGK1和SGK2基因在成脂能力较强的早期脂肪组织中及在体外分化的脂肪细胞中高表达。表明SGK1和SGK2参与猪脂肪沉积及脂肪细胞分化,可作为研究猪脂肪沉积的重要候选基因。

